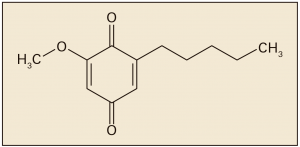
La incidencia de fracturas osteoporóticas es menor en los países de la cuenca mediterránea. El aceite de oliva virgen, un componente clave de la dieta mediterránea, con reconocidos efectos beneficiosos sobre el metabolismo y la salud cardiovascular, parece estar entre las causas de esta disminución del riesgo de fracturas osteoporóticas. Un reciente estudio ha explorado el efecto del consumo crónico de aceite de oliva total y sus variedades sobre el riesgo de fracturas relacionadas con la osteoporosis en una población mediterránea, tanto de mediana edad como en ancianos. Se incluyeron 870 participantes reclutados en el centro de Reus (España) del ensayo PREDIMED (PREvención con DIeta MEDITERRANEA). Las personas, de 55-80 años con alto riesgo cardiovascular, fueron asignadas al azar a una dieta mediterránea suplementada con aceite de oliva virgen extra o con nueces, o una simple dieta baja en grasas.
Se documentaron 114 casos de fracturas relacionadas con la osteoporosis durante una mediana de seguimiento de 8,9 años. Los participantes en el tercil superior de consumo de aceite de oliva virgen extra tuvieron un 51% menos de riesgo de fracturas (HR = 0,49; IC95% 0,29 a 0,81; p = 0,004) en comparación con los del tercil inferior.
- García Gavilán JF, Bulló M, Canudas S, Martínez González MA, Estruch R, Giardina S, et al. Extra virgin olive oil consumption reduces the risk of osteoporotic fractures in the PREDIMED trial. Clin Nutr. 2018; 37(1): 329-335. doi: 10.1016/j.clnu.2016.12.030.