Resumen
La folitropina delta es un análogo recombinante de la hormona foliculoestimulante humana (FSH), capaz de iniciar y mantener el crecimiento folicular múltiple en el ciclo de tratamiento de la estimulación ovárica controlada, para el cual ha sido autorizado su uso en mujeres que participan en un programa de Técnicas de Reproducción Asistida (TRA), tales como la fecundación in vitro (FIV) o ciclo de inyección intracitoplasmática de espermatozoides (ICSI). No parece que la eficacia o la seguridad clínicas de la folitropina delta dosificada de forma individualizada sean significativamente diferentes de las correspondientes a la folitropina alfa con dosificación convencional, en su uso para estimulación ovárica controlada para inducir el desarrollo de folículos múltiples en mujeres sometidas a técnicas de reproducción asistida.
ASPECTOS FISIOPATOLÓGICOS
La función ovárica es controlada por un conjunto de hormonas, genéricamente conocido como gonadotropinas, entre las que se incluyen a la hormona luteinizante o luteoestimulante (LH), a la hormona foliculoestimulante (FSH) y a la prolactina (PRL), que se producen en la adenohipófisis. También es preciso mencionar a la gonadotropina coriónica (hCG, gonadotropina coriónica humana) que se produce en el tejido corial a partir del huevo fecundado, y que es responsable del mantenimiento de la función del cuerpo lúteo gravídico.
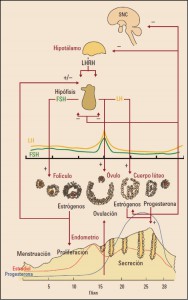
La FSH actúa sobre su receptor, localizado en la membrana de las células de la granulosa, induciendo el desarrollo folicular y la síntesis de estradiol. Interviene también en el reclutamiento, crecimiento y desarrollo del folículo dominante, que continúa desarrollándose a pesar de las concentraciones cada vez más bajas de FSH, lo que determina la atresia de los otros folículos que no son tan sensibles. Esta disminución de la FSH ocurre por el feedback negativo ejercido conjuntamente por los estrógenos y la inhibina.
El receptor para la LH, que es el mismo que para hCG, es muy abundante en la membrana de las células luteínicas, pero también está presente en las células de la teca y en las intersticiales, si bien en mucha menor cantidad. La LH actúa en el folículo maduro iniciando una cascada de acontecimientos que desembocan en la ovulación. Además, luteiniza las células de la teca y las granulosas maduras, transformando el folículo en cuerpo lúteo e incrementando en éste la producción de progesterona. Asimismo, la LH produce una lisis del cúmulo oóforo y reanuda la maduración del oocito. Esta hormona es, pues, responsable de la ovulación, de la maduración del oocito y de la luteinización del folículo.
La secreción de LH y FSH está regulada por la hormona liberadora de gonadotropinas (GnRH o LHRH), producida forma pulsátil por el hipotálamo, actuando sobre la adenohipófisis para inducir la síntesis y la secreción de LH y FSH. Pero éstas también son reguladas a través de un feedback negativo de los estrógenos y la progesterona, de forma que, si se interrumpe la síntesis y secreción de los esteroides sexuales por extirpación quirúrgica de los ovarios o al producirse el agotamiento folicular con la llegada de la menopausia, se produce un aumento marcado de ambas gonadotropinas, siendo la FSH la más sensible. Los receptores para GnRH se encuentran también sometidos a regulación negativa por parte de la inhibina y a un cierto efecto estimulante por parte de la activina. La reiteración del estímulo pulsátil con GnRH en presencia de una concentración de gonadotropinas incrementada produce, en un determinado momento, una liberación máxima de dichas gonadotropinas, lo que constituye el pico ovulatorio.
A través de estos mecanismos de regulación, en la mitad del ciclo aparece un pico secretor de LH y FSH que parece ser responsable de la ovulación y de la luteinización. La FSH actúa sobre el folículo, que ha alcanzado ya una fase avanzada (folículo antral) aunque mida todavía muy pocos milímetros.
Las técnicas de reproducción asistida (TRA) tienen como objetivo facilitar el embarazo en mujeres que tienen dificultades para concebir. Las más comunes son la fecundación in vitro y la inyección intracitoplasmática de espermatozoides. En ambos casos se requiere un tratamiento previo de inducción de la ovulación en la mujer, con el obvio objetivo de que ésta disponga de óvulos maduros para ser fertilizados.
Uno de los protocolos de inducción ovárica consiste en el tratamiento previo con el fin de provocar la supresión del eje hipotálamo-hipófisis-ovarios, una especie de desensibilización a las gonadotropinas fisiológicas, para así poder dirigir todo el proceso de una forma controlada. Para ello se utilizan, en aparente paradoja, agonistas o antagonistas de la hormona liberadora de gonadotropinas (GnRH). Los agonistas (o superagonistas) de GnRH (leuprorelina, buserelina, goserelina, triptorelina, etc.) se unen a los receptores de GnRH en la hipófisis e inicialmente estimulan la liberación brusca de las gonadotropinas. A través de un mecanismo de retroalimentación negativa (feed-back negativo) provoca una disminución en el número de receptores de GnRH, lo que da lugar a la liberación de menos gonadotropinas. En un protocolo de tratamiento tradicional los agonistas de GnRH se administran antes de comenzar con las gonadotropinas, lo que asegura que la elevación brusca habrá terminado cuando se inyecten las gonadotropinas. Por el contrario, la administración de los antagonistas de GnRH (ganirelix, cetrorelix) se puede iniciar después de administrar el tratamiento con gonadotropina porque se unen competitivamente al receptor, lo que provoca la supresión inmediata de la producción endógena de FSH y LH. Por lo tanto los antagonistas de GnRH pueden prevenir el aumento prematuro de la LH y sincronizar la cohorte del folículo. En este sentido, el uso de los antagonistas de GnRH parece dar lugar a una reducción de la incidencia del síndrome de hiperestimulación ovárica grave y menos días de tratamiento que con análogos de GnRH y gonadotropina menopausica humana (hMG), aunque a costa de una tasa ligeramente más baja de embarazos.
En definitiva, los agonistas de la GnRH controlan la maduración de los óvulos para que se produzca al mismo ritmo en todos los óvulos, de tal forma que no haya unos óvulos más maduros que otros. Por su parte, los antagonistas de la GnRh son más utilizados que los anteriores, fundamentalmente porque la mujer suele tolerarlos bien y la estimulación no es agresiva.
Existen varios métodos o protocolos de administración de hormonas en la estimulación ovárica. Actualmente se utilizan dos: el protocolo largo con agonistas y el corto con antagonistas, que difieren en duración y número de inyecciones a administrar. El protocolo corto (15-17 días) se inicia por lo general el día 3 de la menstruación con inyecciones de gonadotropinas, ya sea FSH sola o combinada con LH, hasta que maduren los folículos. A partir del día 8 del ciclo – 5 después de iniciar la administración de gonadotropinas – se administra el antagonista para evitar el pico de LH que desencadenaría la ovulación. Cuando los folículos estén maduros se administra hCG para provocar la ovulación 36 horas después. Por su parte, el protocolo largo (25-32 días) consiste en iniciar la administración de un agonista de la GnRH hasta que llegue la menstruación 10-14 días después en el ciclo menstrual previo, en torno al día 21 del ciclo, con el fin de evitar una ovulación espontánea; a continuación, se administran gonadotropinas hasta que se observe un tamaño folicular y niveles de estradiol adecuados que indiquen su madurez.
En ambos casos, la punción folicular para recoger los óvulos se debe hacer antes de que ocurra la ovulación. Cuando un número suficiente de folículos alcanza la madurez después de la estimulación, se administra la gonadotropina coriónica humana (hCG) para desencadenar la ovulación y de 34 a 36 horas después se realiza la recuperación de los ovocitos, que se fertilizan fuera el cuerpo. Tras la fecundación, un número variable (según el protocolo empleado) los embriones se transfieren el día dos o tres (estadio de división) o el día cinco o seis (estadio del blastocisto). Habitualmente se proporciona apoyo en la fase luteínica mediante un tratamiento con progestágeno o hCG, o una combinación de ambos.
ACCIÓN Y MECANISMO
La folitropina delta es un análogo recombinante de la hormona foliculoestimulante humana (FSH), capaz de iniciar y mantener el crecimiento folicular múltiple en el ciclo de tratamiento de la estimulación ovárica controlada, para el cual ha sido autorizado su uso en mujeres que participan en un programa de Técnicas de Reproducción Asistida (TRA), tales como la fecundación in vitro (FIV) o ciclo de inyección intracitoplasmática de espermatozoides (ICSI).
ASPECTOS MOLECULARES
La folitropina delta es una forma recombinante de la hormona foliculoestimulante (FSH) humana expresada en la línea celular PER. C6. La glicoproteína está compuesta por dos cadenas polipeptídicas (α y β) unidas no covalentemente. La subunidad α contiene 92 aminoácidos con 5 enlaces disulfuro (-S-S-) intracatrenarios, mientras que la β contiene 111 aminoácidos con 6 enlaces disulfuro. Cada subunidad está N-glicosilada en dos posiciones. La secuencia de aminoácidos de folitropina delta es idéntica a la secuencia de FSH humana endógena para las subunidades α y β, y a los productos de FSH recombinante derivados de ovario de hámster chino (CHO) existentes en el mercado, aunque la folitropina delta contiene patrones de sialilación α2,3 y α2,6, mientras que los productos recombinantes derivados de CHO llevan exclusivamente ácido siálico enlazado α2,3. El peso molecular de las cadenas α y β sin glicosilar es de 10,2 y 12,5 kDa, respectivamente, mientras que el de las formas glucosiladas es de 15,2 y 18,5, respectivamente, lo que supone que aproximadamente el 40% del peso molecular total de la folitropina delta corresponde a los glúcidos glicosilantes.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de la folitropina delta han sido adecuadamente contrastadas en las indicaciones autorizadas mediante un ensayo clínico de fase III (confirmatorio de eficacia y seguridad), en el que se comparó la folitropina delta con dosificación individualizada basada en los niveles séricos de hormona antimülleriana1 (AMH) y en el peso corporal, frente a folitropina alfa dosificada convencionalmente.
Se trata de un ensayo clínico de no inferioridad, de fase III, aleatorizado, multicéntrico (realizado en clínicas de medicina reproductiva) y ciego para el evaluador (ESTHER-1; Nyboe Anderson, 2017), en el que se incluyó a un total de 1.329 mujeres entre 18 y 40 años (media de 33,3; un 59% tenía menos de 35) que fueron sometidas a estimulación ovárica en el ámbito del desarrollo de una técnica de fertilización in vitro (FIV). La folotripina delta fue dosificada en función de los niveles de AMH (<15 pmol/L: 12 μg/24 h; ≥15 pmol/L: 0,10-0,19 μg/kg /24 h. hasta un máximo de 12 μg/24 h), o folitropina alfa (150 IU/d durante 5 días, con posibles ajustes de dosis, hasta un máximo de 450 IU/d). Como variable clínica principal se determinó la tasa de embarazos en curso y la de implantación, considerándose como margen de no inferioridad -8,0%.
Los resultados mostraron para la folitropina delta individualizada vs. folitropina alfa con dosificación convencional unas tasas de embarazo en curso del 30,7 vs. 31,6% (diferencia -0,9%: IC95% -5,9 a +4,1), de implantación continua del 35,2 vs. 35,8%; (-0.6%; IC95% -6,1 a +4,8) y de nacidos vivos del 29,8 vs. 30,7% (-0,9%; IC95% -5,8 a +4,0). Folitropina delta individualizada produjo una respuesta objetivo (8-14 ovocitos) en más mujeres (43,3 vs. 384%), menos respuestas pobres (<4 ovocitos con AMH <15 pmol / L) (11,8% vs. 17,9% ), menos respuestas excesivas (27,9 vs. 35,1% con ≥15 ovocitos en pacientes con AMH ≥15 pmol/L; 10,1% vs. 15,6%, con ≥20 ovocitos en pacientes con AMH ≥15 pmol), y menos medidas tomadas para prevenir el síndrome de hiperestimulación ovárica (2,3% vs. 4,5%), a pesar del rendimiento similar de oocitos (10,0 vs. 10,4) y de blastocistos (3,3 vs. 3,5), y menos uso de gonadotropinas (90,0 vs. 103,7 μg).
Desde el punto de vista de la seguridad, la folitropina delta presenta un perfil toxicológico generalmente benigno, equiparable al de otros agentes análogos. Los eventos adversos más comunes (1-10%) que aparecieron durante el tratamiento fueron cefalea, náuseas, síndrome de hiperestimulación ovárico (SHO), dolor pélvico/uterino y fatiga.
ASPECTOS INNOVADORES
La folitropina delta es un análogo recombinante de la hormona foliculoestimulante humana (FSH), capaz de iniciar y mantener el crecimiento folicular múltiple en el ciclo de tratamiento de la estimulación ovárica controlada, para el cual ha sido autorizado su uso en mujeres que participan en un programa de Técnicas de Reproducción Asistida (TRA), tales como la fecundación in vitro (FIV) o ciclo de inyección intracitoplasmática de espermatozoides (ICSI).
Los resultados del ensayo clínico aleatorizado y ciego para el evaluador mostraron unas tasas de embarazo en curso del 30,7% para la folitropina delta individualizada vs. 31,6% folitropina alfa con dosificación convencional (diferencia -0,9%: IC95% -5,9 a +4,1), mientras que las tasas de implantación continua fueron del 35,2 vs. 35,8%; (-0,6%; IC95% -6,1 a +4,8) y de nacidos vivos del 29,8 vs. 30,7% (-0,9%; IC95% -5,8 a +4,0). Folitropina delta individualizada produjo una respuesta objetivo (8-14 ovocitos) en más mujeres (43,3 vs. 38,4%), menos respuestas pobres (<4 ovocitos con AMH <15 pmol/L) (11,8% vs. 17,9%), menos respuestas excesivas (27,9 vs 35,1% con ≥15 ovocitos en pacientes con AMH ≥15 pmol/L; 10,1% vs. 15,6%, con ≥20 ovocitos en pacientes con AMH ≥15 pmol), y menos medidas tomadas para prevenir el síndrome de hiperestimulación ovárica (2,3% vs. 4,5%), a pesar del rendimiento similar de oocitos (10,0 vs. 10,4) y de blastocistos (3,3 vs. 3,5), y menos uso de gonadotropinas (90,0 vs. 103,7 μg).
La folitropina delta presenta un perfil toxicológico generalmente benigno, equiparable al de otros agentes análogos en esta misma indicación. Los eventos adversos más comunes (1-10%) que aparecieron durante el tratamiento fueron cefalea, náuseas, síndrome de hiperestimulación ovárico (SHO), dolor pélvico/uterino y fatiga. De todos ellos, lo más relevante es el SHO (precoz o tardío) cuya incidencia fue del 3,5% con folitropina delta vs 4,8% con folitropina alfa, aunque esta diferencia no fue estadísticamente significativa (p=0,238); incluso, considerando exclusivamente las formas precoces de SHO, la diferencia entre ambos tratamientos tampoco fue significativa (2,6 vs. 3,0; p=0,291).
Cabe indicar, en este sentido, que el síndrome de hiperestimulación ovárica (SHO) es una complicación derivada de la estimulación ovárica inducida que se produce durante la fase lútea o el embarazo temprano. El síndrome se refiere a una combinación de agrandamiento de los ovarios debido a múltiples quistes ováricos y a la incorporación de líquido desde el espacio intravascular al tercer compartimento debido al aumento de la permeabilidad capilar. El SHO sigue siendo actualmente una de las principales complicaciones de la estimulación ovárica dentro de las técnicas de reproducción asistida, con una incidencia que llega a superar el 2% en los países europeos, aunque probablemente sea incluso mayor ya que se considera que está infradocumentado. El SHO precoz (comienzo ≤ 9 días) generalmente ocurre después de la maduración folicular final en asociación con una respuesta ovárica exagerada a la estimulación con gonadotropina, mientras que el SHO tardío (> 9 días) se desarrolla en asociación con el embarazo. Se considera que aquellos casos que constituyen una combinación de hiperestimulación ovárica seguida por el embarazo son los más graves y duraderos (EMA, 2017).
En definitiva, no parece que la eficacia o la seguridad clínicas de la folitropina delta dosificada de forma individualizada sean significativamente diferentes de las correspondientes a la folitropina alfa con dosificación convencional, en su uso para estimulación ovárica controlada para inducir el desarrollo de folículos múltiples en mujeres sometidas a técnicas de reproducción asistida.

BIBLIOGRAFÍA