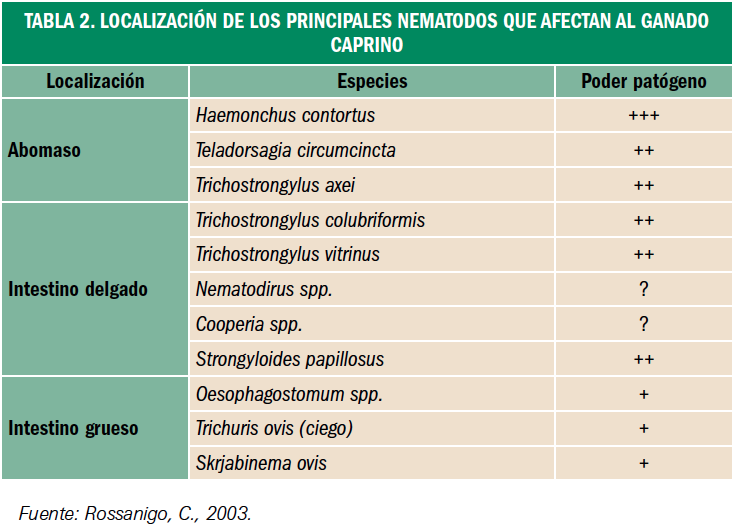
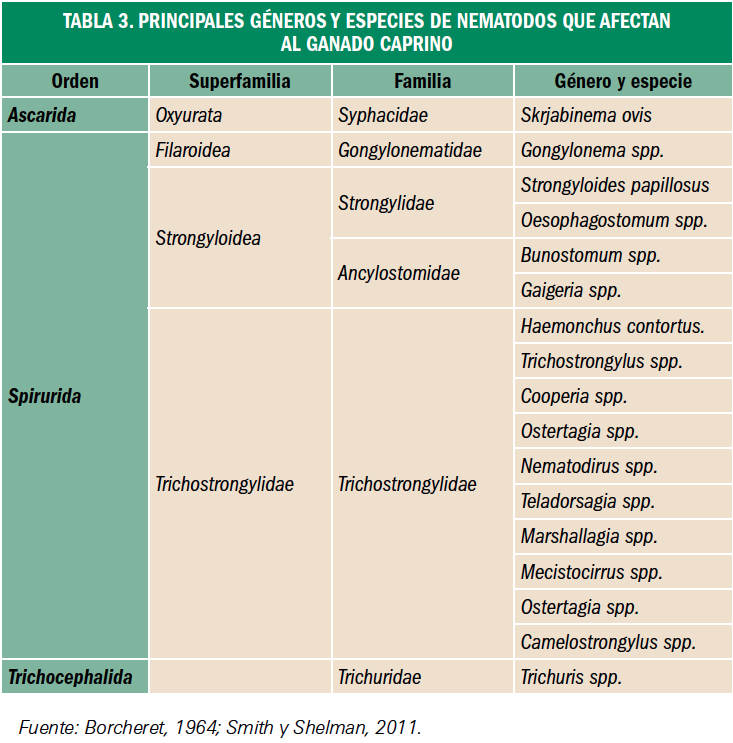
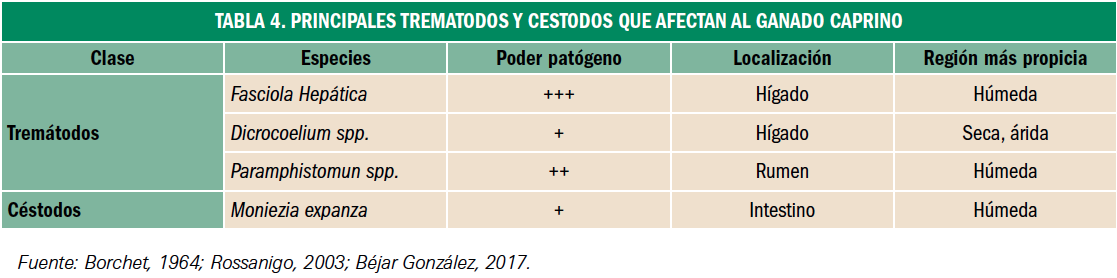
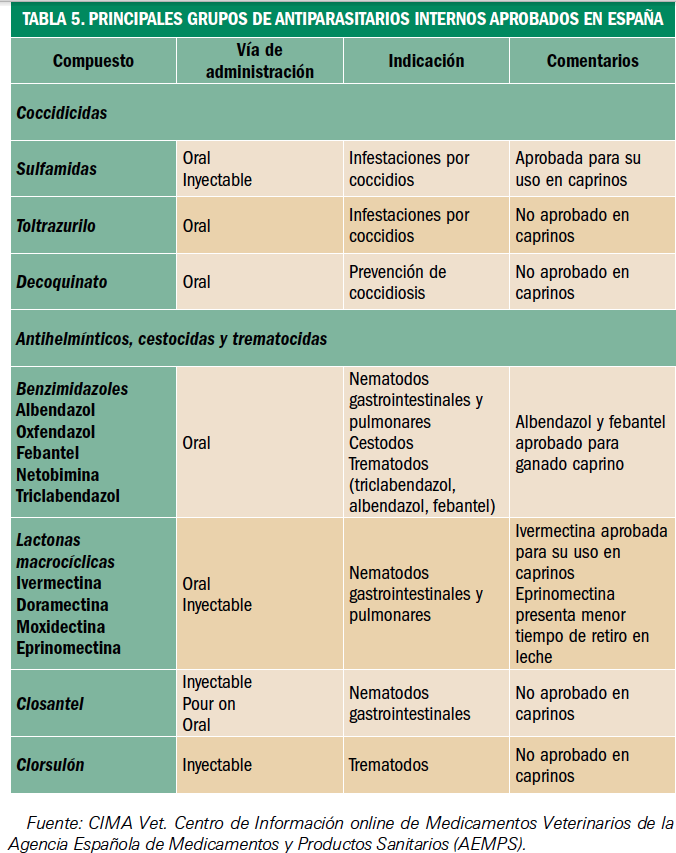
Resumen
Desde la creación por el Consejo General de Colegios Oficiales de Farmacéuticos, de la Base de Datos del Conocimiento Sanitario (Bot PLUS), la información que publica la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) ha sido una de las principales fuentes oficiales. Durante los últimos años, se ha incorporado en Bot PLUS la información codificada sobre las alertas de seguridad y de calidad de medicamentos, así como los problemas de suministro publicadas por la AEMPS. Esta información, sirve de base para la nueva sección incluida en Panorama Actual del Medicamento (PAM) desde este número: Alertas y comunicaciones de la AEMPS.
Uno de los objetivos y motivaciones de PAM, ya en los inicios de su andadura hace más de 40 años, fue el deseo de constituirse como un canal de actualización del Catálogo de Medicamentos y la Base de datos del conocimiento sanitario (Bot PLUS). La evolución de los sistemas de información ha llevado consigo la necesaria adaptación en la forma comunicación entre ambas publicaciones del Consejo General de Farmacéuticos, que persiguen el objetivo común, entre otros, de dotar al profesional de una información constantemente actualizada, capaz de dar soporte a su actividad diaria. En aras de seguir evolucionando esta estrecha relación, desde este año 2018, se crea una nueva sección en PAM que contendrá artículos divulgativos sobre determinados aspectos o novedades, relacionados con los contenidos de Bot PLUS. En este primer número, se exponen las informaciones sobre alertas de seguridad, calidad de medicamentos, así como los problemas de suministro, que publica la Agencia Española de Medicamentos (AEMPS) y que se integran en la información de Bot PLUS. A partir de esos contenidos de Bot PLUS, además, se extraerán mensualmente listados informativos que serán publicados en PAM, en la nueva sección Alertas y comunicaciones de la AEMPS
La información publicada por la AEMPS es una de las principales fuentes de información oficiales que se emplean en la elaboración de Bot PLUS. Por ejemplo, la información que publica la AEMPS relativa a notificaciones sobre seguridad y/o calidad de los medicamentos, así como los problemas de suministro de medicamentos, se incorpora a Bot PLUS de forma codificada para que, al acceder a la ficha del medicamento afectado, el programa advierta sobre estas posibles alertas y ofrezca información adicional al respecto. A continuación se describen las opciones de consulta de esta información En Bot PLUS:
Mediante pictogramas, asociados a los correspondientes mensajes de advertencia, se puede visualizar de forma rápida medicamentos afectados por alguna alerta de seguridad, de defectos de calidad, o problemas de suministro con tan solo entrar en su ficha:

Estas informaciones las podemos visualizar, además de como pictogramas en la parte superior de cada ficha, dentro de la pestaña de “Advertencias” del medicamento (Figura 1).
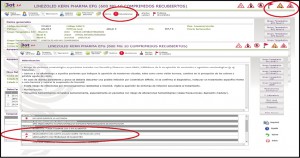
Figura 1. Pictogramas y mensajes de advertencia asociados a las alertas de seguridad, calidad y problemas de suministro de medicamentos.
Como complemento a lo anterior, tanto para las alertas por defectos de calidad, como para los problemas de suministro, Bot PLUS incluye una pestaña específica sobre cada uno de los conceptos, “Alertas Calidad” y “Problemas de suministro”, en la que se puede ampliar la información sobre cada uno de los conceptos:
Alertas de calidad: permite consultar los lotes concretos que han sido retirados, con sus respectivas fechas de caducidad, así como la descripción del defecto de calidad detectado y las medidas a adoptar. En esa misma pestaña, también se puede acceder directamente al documento (pdf) de esa alerta publicada por la AEMPS (Figura 2).
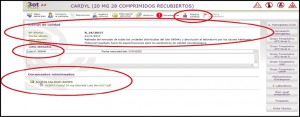
Figura 2. Información ampliada sobre retiradas de lotes por defectos de calidad.
Problemas de suministro: incluye una explicación más detallada del problema de suministro publicado por la AEMPS, recogiendo la información sobre las fechas previstas de inicio y fin del problema de suministro y las observaciones publicadas por la AEMPS, para conocer la situación prevista sobre ese medicamento y poder ofrecer al paciente información de interés. Se identifica si es un problema ”activo” o si ya se ha resuelto. En aquellos caso, por ejemplo, en los que recomendación es que el medicamento se puede solicitar como medicamento extranjero, se incluye dicha recomendación y el propio documento publicado por la AEMPS con los puntos de contacto o el acceso a la Nota que la propia AEMPS haya podido publicar, en su caso, respecto de ese problema de suministro (Figura 3).
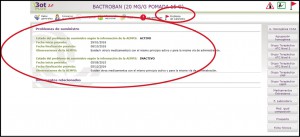
Figura 3. Información ampliada sobre problemas de suministro.
Además, mencionar que todas estas informaciones pueden ser explotada a través de las búsquedas libres, una opción de Bot PLUS que nos permite obtener listados específicos de medicamentos afectados por estas informaciones; por ejemplo, podremos obtener un listado de medicamentos con alguna alerta de farmacovigilancia, con lotes retirados (o inmovilizados) o todos aquellos que presentan un problema de suministro publicado por la AEMPS. Para ello, en la pantalla de búsquedas libres están disponibles los respectivos mensajes de advertencia mencionados anteriormente que permitirán buscar medicamentos por esos conceptos (Figura 4).
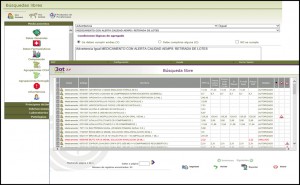
Figura 4. Búsqueda libre de medicamentos que llevan el mensaje de advertencia sobre retirada de lotes por alerta de calidad.
Toda esta información permanece constantemente actualizada con los nuevos datos publicados por la AEMPS, respecto a las condiciones de seguridad y retirada/inmovilización de lotes por defectos de calidad de medicamentos, así como los problemas de suministro. Cabe destacar que este nivel de codificación de la información, identificando por ejemplo los lotes concretos retirados, es un aspecto novedoso de la Base de Datos del Consejo General (Bot PLUS), puesto a disposición de todos los usuarios con el objetivo de ofrecer una herramienta informática capaz de interoperar con otros sistemas de información y mejorar la gestión e identificación de estos medicamentos, en los que es fundamental la labor asistencial y de control por parte del profesional.