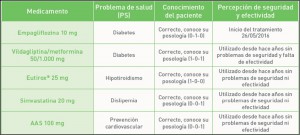
El control de la hipertensión arterial (HTA) pasa por el alcance de los objetivos de niveles de presión sistólica y diastólica. Sin embargo, el umbral a partir del cual se considera que comienza el problema no ha estado muy claro, por lo que no había pruebas de que un control más intensivo, con objetivos más exigentes de presión, fuera más adecuado. El estudio SPRINT (Systolic blood PRessure Intervention Trial) ha mostrado que se produce una reducción significativa del riesgo de muerte y de incidencia de eventos cardiovasculares mediante un control intensivo (con objetivo de <120 mmHg), respecto de un control estándar (con objetivo de <140 mmHg), en pacientes hipertensos adultos con elevado riesgo cardiovascular y sin historia de diabetes, ictus o insuficiencia cardíaca. Un elemento por investigar es, entonces, la eficiencia de dicho control intensivo en comparación con el estándar.
Para dar respuesta al problema mencionado, los autores1 diseñaron un modelo de microsimulación para estimar los costes y los resultados clínicos del manejo de los pacientes de referencia con ambos tipos de control: intensivo y estándar. Los eventos cardiovasculares estimados fueron infarto de miocardio, ictus e insuficiencia cardíaca; asimismo, se estimaron eventos adversos graves como hipotensión, síncope, bradicardia, anormalidad en los electrolitos y daño renal agudo.
El modelo asumía que, durante los 5 primeros años, los pacientes presentaban una buena adherencia al tratamiento, así como que podían presentar un evento cardiovascular mortal o no o muerte por cualquier causa. Tras ese período de tiempo, se simularon 4 escenarios de persistencia en el tratamiento para estimar el nivel del efecto del tratamiento intensivo en cada uno de ellos. En el primer escenario (E1), que constituía el caso base, se asumía que la adherencia, y por tanto el efecto conseguido, se reducían paulatinamente hasta cero después de 15 años; la probabilidad de adherencia al tratamiento se diferenció en función del tipo de tratamiento: menor adherencia a mayor número de fármacos. En el segundo escenario (E2), que conformaba el peor caso, los pacientes abandonaban el tratamiento después del período inicial de 5 años. El tercer escenario (E3), mejor caso en 15 años, asumía que los pacientes mostraban la misma adherencia durante los 15 años siguientes, cesando ésta al cabo de dicho tiempo. En el cuarto escenario (E4), mejor caso durante toda la vida, la adherencia observada en el período inicial se mantenía el resto de la vida. Por su parte, los costes incorporados incluían los de la intervención (fármacos, consultas, test de laboratorio), manejo de los eventos cardiovasculares, eventos adversos, así como el tratamiento de patologías no vasculares. Finalmente, la utilidad de los estados de salud por los que transitaban los pacientes en el modelo, se extrajeron de los resultados obtenidos en el estudio SPRINT mediante el instrumento EQ-5D.
Para una cohorte de 10.000 pacientes, los resultados estimados en el caso base (E1) estimaron una tasa de incidencia de la variable principal del estudio SPRINT de 17,3 y 22,2 eventos por 1000 persona-años, en los grupos de tratamiento intensivo y estándar, respectivamente (HR: 0,78; IC95%: 0,70-0,87). El ratio coste-efectividad incremental (RCEI) mostró valores por debajo del umbral de la eficiencia en EE. UU. (50.000 $/AVAC) (Tabla 1). El análisis probabilístico estimó que para una disposición a pagar máxima de 50.000 $/AVAC, la probabilidad de que el control intensivo fuera eficiente era del 54% en el caso base (E1), incrementando hasta el 79% en el mejor caso (E4).
|
Tabla 1 |
|||||
|
Escenario |
Coste ($) |
Beneficio (AVAC) |
RCEI |
||
|
|
C. Intensivo |
C. Estándar |
C. Intensivo |
C. Estándar |
($/AVAC) |
|
Caso base (E1) |
284.637 |
271.841 |
12,45 |
12,17 |
46.546 |
|
Peor caso (E2) |
283.401 |
270.965 |
12,31 |
12,06 |
49.851 |
|
Mejor caso (E3) |
286.161 |
274.163 |
12,58 |
12,25 |
36.352 |
|
Mejor caso (E4) |
285.909 |
274.146 |
12,82 |
12,40 |
27.617 |
Los autores concluyen que el control intensivo de la presión arterial previene casos de eventos cardiovasculares graves y aumenta la supervivencia a un coste que ofrece un estimador de la eficiencia inferior a los umbrales habitualmente manejados en EE. UU., independientemente de si los beneficios se mantienen o no después de los 5 primeros años de tratamiento.