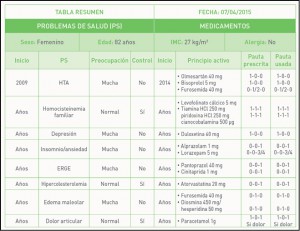
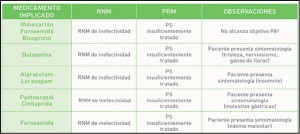
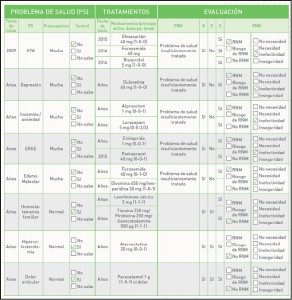
Sabemos lo complicado que es convencer a los pacientes adultos para que se vacunen. A diferencia de lo que ocurre a los padres con respecto a la vacunación pediátrica, los adultos suelen tener la creencia errónea, cuando se trata de protegerse ellos mismos, de que enfermedades como gripe o neumonía son patologías banales que no requieren vacunación. Además suelen desconfiar de la vacuna en cuanto a su seguridad o eficacia y les cuesta sacar tiempo para administrarse la vacuna. Por todos estos motivos, las coberturas en adultos son muy inferiores a las pediátricas y por supuesto, inferiores a las mínimas deseables.
Es en estos casos donde debemos aprovechar lo que se conoce como “oportunidad de vacunación”, que no es más que aprovechar el momento en el que el paciente decide vacunarse y administrarle todas las vacunas que necesite, pero ¿sabemos si esto es conveniente? Depende del caso:
- En pacientes mayores de 65 años o pacientes crónicos las vacunas frente a gripe y neumococo pueden administrarse en el mismo acto vacunal.
- Si además nuestro paciente tiene prescrita la vacuna del herpes zóster, puede vacunarse de gripe mediante inyecciones separadas y en distintas partes del cuerpo, pero debe estar separada de la antineumocócica polisacárida de 23 serotipos al menos 4 semanas.
- Con respecto a las embarazadas, si coincide la campaña de vacunación antigripal con la administración de tosferina, ambas vacunas pueden administrarse en la misma visita, en lugares anatómicos distintos.
Huelga recordar que las vacunas son medicamentos que precisan receta médica para su dispensación.
Bibliografía