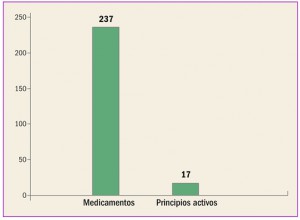
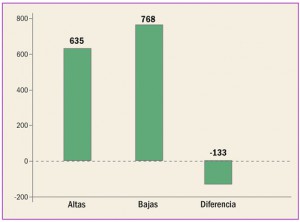
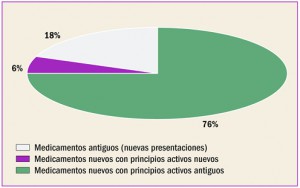
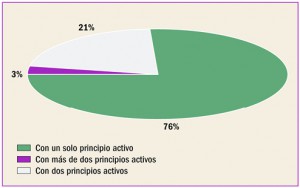
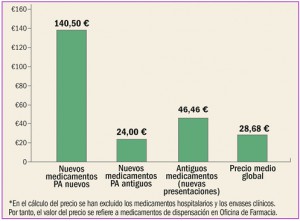
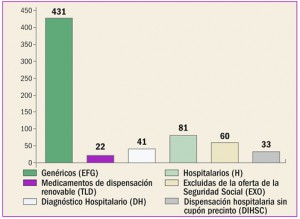
Enfermedad vascular aterosclerótica
Ácido acetilsalicílico y/o rivaroxabán
Entre los pacientes con enfermedad vascular aterosclerótica estable, los pacientes tratados con la combinación de rivaroxabán y ácido acetilsalicílico, se registraron mejores resultados cardiovasculares pero también más episodios hemorrágicos importantes que los tratados con solo con ácido acetilsalicílico solo. Por su parte, el rivaroxabán solo no produjo mejores resultados cardiovasculares que el ácido acetilsalicílico solo y resultó en más eventos hemorrágicos importantes.
En ensayo clínico (COMPASS) aleatorizado y doblemente ciego, se asignó al azar a 27.395 participantes con enfermedad vascular aterosclerótica estable para recibir rivaroxabán (2,5 mg/12 h) y ácido acetilsalicílico (AAS) (100/24 h), rivaroxabán (5 mg dos veces al día) solo o AAS solo (100 mg/24 h). La variable primaria consistió en la incidencia de un resultado compuesto de muerte cardiovascular, accidente cerebrovascular o infarto de miocardio. El estudio se detuvo antes de su final programado, debido a la superioridad del grupo rivaroxaban-AAS después de un seguimiento medio de 23 meses.
El resultado primario se produjo en menos pacientes en el grupo de rivaroxaban-AAS que en el grupo tratado con AAS solo (4,1 vs 5,4%; p < 0,001), pero se produjeron eventos hemorrágicos mayores en más pacientes del grupo rivaroxaban-AAS (3,1 vs 1,9%; p < 0,001). No hubo diferencias significativas en la hemorragia intracraneal o fatal entre estos dos grupos. La mortalidad fue del 3,4% en el grupo de rivaroxaban-AAS, en comparación con el 4,1% en el grupo AAS solo (cociente de riesgo, 0,82; p = 0,01). El resultado primario no ocurrió en una proporción significativamente menor de pacientes en el grupo de rivaroxaban solo con relación al de AAS solo, pero ocurrieron eventos hemorrágicos mayores en más pacientes en el primero.