Introducción
Más de dos millones de europeos viven con cáncer de próstata, provocando la muerte a más de 92.000 cada año; los costes asociados a la enfermedad y al eventual fallecimiento superan los 9.000 millones de € anualmente, de los que 5.800 millones corresponden a gasto sanitario. El hecho de que la hiperplasia prostática se asocie con una mayor incidencia de cáncer de próstata, hasta el punto de que se multiplique el riesgo entre 1,5 y 4 veces, invita a considerar el tema de la salud prostática como un todo, especialmente si se tiene en cuenta que la hiperplasia prostática afecta en Europa (y en otros regiones del mundo) entre un tercio y la mitad de la población masculina por encima de los 60 años, superando las tres cuartas partes de la población de varones mayores de 80 años. Y, en esta misma línea, cabe considerar otras patologías prostáticas que, como la prostatitis, también inciden de forma relevante en la salud de los varones, aunque su prevalencia sea netamente inferior a las dos condiciones antes mencionadas.
Anatomía y fisiología de la próstata
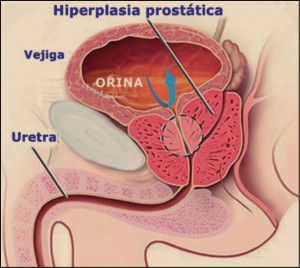
La próstata es una glándula masculina de secreción externa, que se sitúa por debajo de la vejiga urinaria de los hombres, rodeando la parte proximal de la uretra. Tiene un peso de aproximadamente 20 g y está constituida por dos partes; una interior (periuretral), de naturaleza glandular, y otra exterior, con contenido fundamentalmente fibromuscular.

La principal función fisiológica de la próstata es contribuir a la formación del fluido seminal, del que es responsable en un 20-40% de su contenido en volumen; también parece ejercer otras actividades, tales como la de proteger a la vejiga y al resto del tracto urinario de las infecciones ascendentes. Es un órgano andrógeno-dependiente: la testosterona sintetizada en los testículos regula el metabolismo, la proliferación y la muerte de las células de la próstata normal, aunque requiere la acción de la 5α-reductasa, que la transforma en dihidrotestosterona (DHT), la cual es capaz de penetrar en el núcleo celular y unirse al receptor de andrógenos, cuya activación – o bloqueo – determina el metabolismo celular.
Hiperplasia prostática benigna (HPB)
Según las estimaciones de la Asociación Española de Urología (AEU), el 50% de los varones españoles mayores de 50 años y el 80% de los mayores de 80 siente molestias al orinar y se levantan por las noches para ir al baño. Se calcula que actualmente la hiperplasia benigna de próstata (HBP) afecta a unos 4 millones de varones entre 50 y 80 años, y a más de 770.000 mayores de 80 años.
La obesidad abdominal y el nivel sérico de leptina se asocian positivamente con el crecimiento de la próstata, mientras que el nivel sérico de adiponectina está inversamente asociado con la presencia de agrandamiento prostático (Jung, 2016). Es interesante constatar que los pacientes con síndrome metabólico e hiperplasia prostática tienen, según reciente estudio epidemiológico, una tasa de crecimiento de la próstata significativamente mayor (+0,67 ml/año; p <0,001) y mayor volumen de próstata (+6,8 ml; p= 0,010) que los pacientes con síndrome metabólico, aunque no se han encontrado diferencias significativas en la puntuación de síntomas (IPSS) (diferencia de medias combinada = 1,58; p = 0,202) ni en el flujo máximo de orina (–1,41 mL/s; p = 0,345) (Wang, 2016).
La edad y las comorbilidades asociadas a la hiperplasia prostática influyen en el aumento de la prevalencia de los hombres que sufren disfunción eréctil. Un amplio estudio ha mostrado que la disfunción eréctil estaba presente en el 96% de los pacientes con síntomas urológicos asociados a la hiperplasia prostática (Dutkiewicz, 2012).
Muchos hombres suponen que los perjuicios causados por esta patología están asociados a la edad. La consecuencia más inmediata es una alteración importante de la calidad de vida, por la presencia continua o intermitente de síntomas miccionales, de llenado (urgencia, frecuencia miccional aumentada, escapes de orina) o de vaciado (chorro flojo y entrecortado, goteo postmiccional), incluso, con disfunción eréctil concomitante. No obstante, si no se trata adecuadamente la hiperplasia benigna de próstata, los pacientes pueden sufrir complicaciones relevantes para la salud:
- Retención de orina.
- Infecciones y formaciones de cálculos.
- Daños renales.
El proceso de la hiperplasia benigna prostática (HBP) implica histológicamente un aumento del número de células normales de la próstata, no del tamaño celular; por ello, el término “benigna” es incorrecto (por supérfluo), en términos anatomopatológicos. Se pueden manifestar dos tipos básicos de síntomas de la hipertrofia prostática benigna:
- Síntomas irritativos, relacionados con el almacenamiento de la orina en la vejiga: nicturia1, aumento de la frecuencia de micciones y urgencia de éstas.
- Síntomas obstructivos, relacionados con el vaciado de la vejiga: dificultad para comenzar la micción, reducción de la velocidad de micción, sensación de vaciado incompleto de la vejiga, incapacidad para detener bruscamente la micción y, ocasionalmente, retención urinaria completa.
- Síntomas posmiccionales, relacionados con la merma del control neurológico y del esfínter uretral: sensación de haber vaciado la vejiga de forma incompleta y goteo posmiccional.
Fisiopatológicamente, los síntomas que afectan a la micción son atribuibles al crecimiento glandular y al aumento de la resistencia uretral mediada por el tono de la musculatura lisa constitutiva de la glándula y del cuello vesical. Adicionalmente, se reconoce un papel relevante a otros factores, entre los que destaca el componente vesical del músculo detrusor, cuya función contráctil es susceptible de cambiar en relación con alteraciones del sistema nervioso y con el envejecimiento.
La HBP es la patología de localización en órganos genitourinarios más frecuente en el varón y es la primera causa de consulta al urólogo, siendo el tumor benigno más frecuente en varones de más de 50 años y la segunda causa de intervención quirúrgica y una patología habitual en la práctica clínica extrahospitalaria. La hipertrofia prostática benigna es una enfermedad muy prevalente entre los hombres maduros; la próstata permanece estable en la mayoría de los varones hasta los 50 años, aunque ya entre los 30 y los 40 años la prevalencia global es del 8% y a los 40 años un 20% de los hombres la padecen. Esta incidencia aumenta progresivamente – a razón de un 2-3% anualmente – hasta llegar al 40-50% entre los 50 y los 60 años, aumentando progresivamente con la edad hasta más del 80% en los varones mayores de 80 años. Por ello, no es extraño que la prostatectomía sea la segunda de las intervenciones de cirugía mayor de un hospital después de la intervención de catarata y que el 25-30% de los que llegan a los 80 años y el 12-17% de los que llegan a los 70 han sido operados.
No se ha establecido una relación directa entre el aumento del tamaño prostático y los síntomas asociados a la hiperplasia benigna. Igualmente, una de las cuestiones aparentemente contradictorias es que la reducción del tamaño de la próstata tampoco implica necesariamente la resolución de los síntomas que acompañan a la enfermedad. Incluso en muchos pacientes los síntomas, especialmente los de carácter subjetivo, desaparecen o se atenúan de forma espontánea, sin necesidad de ningún tratamiento.
Tampoco se conoce con exactitud la causa de la enfermedad pero parece estar estrechamente relacionada con la acción de la testosterona y, muy especialmente, con la de su metabolito biológico, la dihidrotestosterona (DHT) mucho más potente como andrógeno que la propia testosterona. Este metabolito es producido por acción del enzima 5α-reductasa. Aunque el papel de los andrógenos como factor causante es todavía hoy objeto de debate, es indudable que juegan un rol, al menos, facilitador del desarrollo de la hiperplasia benigna prostática. En realidad, los pacientes con hiperplasia prostática benigna no presentan niveles elevados de DHT, manteniéndose normales durante el envejecimiento, mientras que los niveles plasmáticos de testostorona disminuyen. Se han descrito dos isoformas del enzima 5α-reductasa; el tipo 1 está presente en la mayoría de los tejidos donde se expresa el enzima, siendo la forma predominante en las glándulas sebáceas, mientras que el tipo 2 es dominante en los órganos genitales, incluyendo la próstata.
El estudio del valor y la influencia de los síntomas en la repercusión sobre la función vesical y la calidad de vida se hace hoy utilizando un cuestionario validado por la Organización Mundial de la Salud (OMS) denominado IPSS (International Prostate Symptom Score). Este cuestionario valora 7 síntomas (vaciado incompleto, aumento de frecuencia, intermitencia, urgencia, disminución del chorro miccional, tiempo de inicio de micción y nicturia) puntuados de 0 a 5 y obtiene un número que mide la intensidad de los síntomas y que puede oscilar entre 0 y 35. Valores entre 0 y 7 se consideran sintomatología menor, entre 8 y 19 moderada, y entre 20 y 35 severa.
Aunque la hiperplasia benigna de próstata (HBP) es anatómicamente muy frecuente (50% de todos los varones) entre los 50 y 80 años (y 80% para los mayores de 80), solo el 6% experimenta una sintomatología importante y el 24% moderada; es decir, en prácticamente la mitad de los pacientes la HBP son asintomáticos, algunos incluso durante varias décadas. La valoración objetiva de la obstrucción se puede hacer mediante:
- Flujometría: se valora cómo orina el paciente mediante la medida del pico de flujo máximo, que debe ser superior a 15 mL/s, y la medida del flujo medio, > 10 mL/s.
- Determinación del volumen residual: es el volumen de orina intravesical tras la micción. Es significativo por encima de 50 mL.
- Estudio urodinámico: se emplea únicamente cuando el resto de las pruebas no es concluyente. Permite valorar la capacidad vesical funcional, la relación presión/flujo, que es la medida exacta de la obstrucción, si existen contracciones involuntarias del detrusor y si hay sinergia entre el esfínter y la vejiga, datos que podrían modificar el tratamiento.
El antígeno específico prostático (PSA) no es un marcador específico de cáncer de próstata, sino de tejido prostático. Tiene una baja especificidad, ya que se encuentra elevado en pacientes que presentan otras patologías prostáticas, como la HBP y las prostatitis, y puede ser normal en pacientes con carcinoma prostático. No obstante, la combinación de PSA y tacto rectal es el método más efectivo para la detección precoz del cáncer de próstata.
Está demostrada la relación positiva y estadísticamente significativa entre el PSA y el volumen prostático, lo que le otorga la condición de eficaz marcador de crecimiento prostático. Valores de PSA > 1,4 ng/ml triplican el riesgo de retención urinaria aguda. Sin embargo, a partir de los 60 años de edad se consideran valores normales los valores de PSA < 4 ng/ml, aunque hasta un 25% de los hombres con cáncer de próstata pueden tener valores de PSA < 4 ng/ml. Por otro lado, un nivel más alto de PSA no confirma necesariamente la presencia de cáncer.
El tacto rectal (a través del ano) es un procedimiento diagnóstico clásico contemplado y recomendado por todas guías urológicas, ya que permite valorar la mucosa rectal (masas rectales o anales, fisuras, hemorroides), el tono del esfínter anal y, en lo que se refiere específicamente a la próstata:
- Sensibilidad a la palpación, que produce dolor, en el caso de prostatitis.
- Tamaño, agrandado en HBP
- Consistencia, pétrea en el carcinoma, blanda en la HBP.
- Límites, irregulares en carcinoma, bien delimitados en HBP
- Movilidad, móvil en HBP, adherida en carcinoma.
La próstata normal tiene un tamaño de unos 15-20 cc, paulatinamente con la edad, a partir de los 30 años, presenta un crecimiento histológico progresivo. Con el tracto rectal se suele infravalorar el tamaño real de la próstata y, de hecho, la prueba tiene una sensibilidad del 50% y una especificidad del 80%. Un tracto rectal normal no descarta el cáncer de próstata, ya que en las fases más iniciales de éste solo se detectan el 10% y a través del tacto rectal solo se detecta a partir de un estadio T2. El valor predictivo positivo de esta prueba para el diagnóstico de un cáncer de próstata es bajo (26-34%) (Brenes, 2015).
Con un valor de PSA > 10 es recomendable la realización de una biopsia guiada por ecografía. Cuando el valor se encuentra entre 4 y 10 es preciso considerar el ritmo evolutivo del crecimiento, estimándose como patológico un aumento de 0,75 ng/ml anual o de un 20% anual de su valor inicial; asimismo, es preciso considerar la densidad del PSA, que relaciona su valor con el del volumen prostático obtenido por ecografía. Una relación superior a 0,15 es sugerente de carcinoma de próstata, mientras que si es inferior a 0,10 apunta a HBP. Finalmente, un cociente PSA libre/PSA total inferior al 20% es sugerente de cáncer de próstata, mientras que si es superior al 20%, el diagnóstico más probable es el de HBP.
Tratamiento
Los objetivos del tratamiento de la hiperplasia prostática son mejorar los síntomas urológicos asociados y la calidad de vida, evitar la progresión clínica de la enfermedad, reducir el riesgo de complicaciones y la necesidad de cirugía. Básicamente, existen tres opciones de tratamiento consisten en:
- Sin intervención: espera vigilante con supervisión clínica periódica y cambios activos del estilo de vida.
- Tratamiento farmacológico: indicación de primera línea en pacientes con síntomas de intensidad moderada a grave que producen impacto en la calidad de vida, en ausencia de complicaciones y sin una indicación absoluta de cirugía.
- Tratamiento quirúrgico: Cuando la hiperplasia prostática comienza a provocar manifestaciones clínicas importantes (retención urinaria, infecciones urinarias frecuentes, hidronefrosis, etc.).
Seguimiento clínico y cambios en el estilo de vida
En pacientes con sintomatología leve o moderada y poca afectación de su calidad de vida el seguimiento clínico y la información al paciente sobre la naturaleza de la sintomatología, con consejos sobre el estilo de vida más adecuado, es la opción prioritaria. De hecho, en algunos pacientes los síntomas pueden mejorar de forma espontánea, mientras que en otros se mantienen estables durante muchos años. Un amplio estudio (Roehrborn, 2015) demostró que más de un tercio de los hombres con hiperplasia prostática con síntomas urológicos tuvieron mejoría sintomática sin ninguna intervención farmacológica, es decir, solo con la ayuda del consejo sobre su estilo de vida.
No obstante, existen dudas sobre los posibles beneficios que esta actitud expectante pueda tener, particularmente en relación con el retraso de la necesidad de tratamiento quirúrgico. En cualquier caso, no parece que sea adecuada una intervención intrusiva inicial, salvo que la intensidad de la sintomatología o su incidencia sobre la calidad de vida del paciente así lo aconseje.
Básicamente, las recomendaciones se centran en el control de los síntomas urológicos y, particularmente, en la reducción de la urgencia urinaria y la nicturia.
- Realizar actividades encaminadas a reducir el estrés.
- No beber una cantidad excesiva de líquidos, especialmente de una sola vez (es mejor repartir la bebida en pequeñas cantidades a lo largo del día y evitar beber dos horas antes de acostarse).
- No ingerir bebidas alcohólicas o con alto contenido en cafeína (cefé, té, refrescos de cola, bebidas energéticas, etc.)
- Evitar el estreñimiento, utilizando una dieta rica en fibra
- Evitar utilizar medicamentos con efectos sobre el tracto urinario inferior, como los antihistamínicos (en particular, los más antiguos: clorfenamina, difenhidramina, doxilamina, etc.) o descongestivos (vasoconstrictores) por vía sistémica, ya que puede reducir la micción. Es importante tener en cuenta que este tipo de medicamentos está presente en numerosos preparados “anticatarrales”, hipnóticos, etc.
- Intentar mantener una disciplina miccional, orinando cuando se presenta la necesidad inicial cuando el momento y el lugar lo permitan, aunque no se sienta la necesidad de orinar.
- Evitar el frío y las corrientes de aire, porque inducen la micción aunque la vejiga esté vacía.
- Realizar ejercicio físico moderado, incluyendo ejercicios pélvicos para fortalecer la musculatura abdominal.
- Hacer una dieta sana y variada, evitando engordar ya que ello puede favorecer el desarrollo hiperplásico de la próstata.
Tratamiento farmacológico
La terapia farmacológica es paliativa y está indicada en manifestaciones leves o moderadas del cuadro, o para el alivio de la sintomatología a la espera de la intervención, o en pacientes donde la cirugía no esté indicada. Es un tratamiento crónico, cuyo efecto se pierde al ser suspendido. Por otro lado, el desconocimiento de la etiología del cuadro supone un serio inconveniente para el desarrollo de tratamientos eficaces. Los actuales se basan en la consideración de que la disuria asociada a la hipertrofia prostática tiene dos componentes: uno “estático” derivado del aumento de tamaño de la glándula, y otro “dinámico” por aumento del tono del músculo liso del cuello de la vejiga y de la uretra intraprostática.
En este sentido, se ha estimado que aproximadamente el 40% del total de la presión uretral en hiperplasia prostática benigna es debida a la activación de receptores α1 adrenérgicos. Esto ha determinado la sugerencia de emplear fármacos que bloqueen estos receptores (alfabloqueantes). De hecho, han demostrado incrementar significativamente el flujo urinario en los pacientes tratados, obteniendo un efecto equivalente al 55% del conseguido con la prostatectomía. Estos fármacos presentan la ventaja de reducir la prevalencia de retención urinaria en los casos más avanzados. Por este motivo, se les considera preferibles en general a otros tratamientos farmacológicos de la hiperplasia benigna de próstata.
Alfabloqueantes
Su utilización se fundamenta en: a) la inervación de la uretra posterior y del cuello vesical es α-adrenérgica fundamentalmente; y b) el músculo liso prostático es de inervación α-adrenérgica y constituye una parte fundamental del estroma prostático. El tejido muscular constituye el 39% del peso de la glándula. El bloqueo α-adrenérgico produce una relajación de la uretra prostática y del tejido muscular liso prostático facilitando la apertura del cuello vesical y como consecuencia el vaciado vesical. Esto explica los buenos resultados clínicos que se obtienen en los múltiples estudios realizados.
- No selectivos: fenoxibenzamina (no utilizado en la actualidad).
- Selectivos α1: doxazosina (EFG, Carduran Neo®, Progandol®), terazosina (EFG, Alfaprost®, Deflox®, Magnurol®, Sutif®) y alfuzosina (EFG, Benestan®, Unibenestan®).
- Selectivos α1A: prazosina (Minipres®), tamsulosina (EFG, Omnic®, Urolosin®) y silodosina (Silodyx®, Urorec®). Teóricamente, más específicos que el resto; sin embargo, no hay evidencias clínicas que justifiquen su uso preferente.
De los estudios realizados se concluye que no hay ningún grupo que sea mejor que el resto en mejoría clínica y/o urodinámica. Globalmente, la mitad de los pacientes mejora en ambos conceptos; un 60-90% mejora la sintomatología clínica, mientras que en los patrones urodinámicos solo responde el 40-50%. Los agentes selectivos de larga duración parecen mejorar la sintomatología clínica con una frecuencia ligeramente superior al resto, aunque las mejoras conseguidas en el flujo miccional son prácticamente idénticas con todos estos fármacos. La tamsulosina es probablemente el alfabloqueante más experimentado en adenoma prostático, aunque todos parecen equiparables en eficacia y en efectos adversos.
Su efecto es relativamente rápido (2-3 semanas, tras alcanzar la dosis máxima) y son más eficaces a corto plazo que los inhibidores de la 5α-reductasa. Sin embargo, producen una incidencia relativamente alta de efectos secundarios cardiovasculares que obligan a un ajuste de la dosis. Existe también temor a que el efecto se pierda con el tratamiento continuado (tolerancia farmacológica). Globalmente, los efectos adversos alcanzan el 10-15% pero son reversibles, y son más comunes en pacientes más jóvenes. El más importante es la alteración de la eyaculación (significativamente mayor en los selectivos α1A que con el resto de los α1-bloqueantes). Otro efecto es el síndrome del iris flácido, que afecta al 2% de los operados de cataratas que toman α-bloqueantes. Todo paciente que vaya a operarse de cataratas debe dejar la medicación, aunque no se conoce el tiempo de lavado.
La acción antihipertensiva puede ser un beneficio adicional en los hipertensos y en los normotensos el descenso de presión sanguínea es poco pronunciado. El tratamiento consigue un aumento significativo del flujo urinario, y disminución de síntomas obstructivos y, en menor medida, de los irritativos.
Inhibidores de la 5 alfa-reductasa
La proliferación de tejido prostático parece dependiente de andrógenos, en especial de la dihidrotestosterona (DHT). Esta hormona se produce dentro de la próstata a partir de testosterona exógena. El enzima que lleva a cabo la transformación es la 5α-reductasa. Este enzima permite la conversión, en la próstata, de testosterona a dihidrotestosterona, mucho más potente que su antecesor. De hecho, la dihidrotestosterona es el principal andrógeno intracelular. La observación de que una deficiencia genética del enzima resultaba en retraso en el desarrollo de la próstata ha llevado a la introducción en terapéutica de inhibidores de la 5α-reductasa, de los cuales se dispone de finasterida (EFG, Proscar®) y dutasterida (EFG, Avidart®).
La dutasterida bloquea las isoenzimas 1 y 2, mientras que la finasterida es más selectiva por el tipo 2. En la próstata predomina el tipo 2, pero en hígado, piel y pituitaria el dominante es el tipo 1 y en estos órganos se produce la síntesis del 25% de la dihidrotestosterona circulante, que empaña la acción de la finasterida. Ambos inducen una deficiencia de dihidrotestosterona (dan lugar a una reducción del 70-95% los niveles de DHT, tanto en suero como en la próstata); en contraposición, los niveles medios de testosterona pueden aumentar ligeramente.
Los resultados clínicos con finasterida incluyen disminución del 22-27% del tamaño prostático, disminución del 27-50% del valor del antígeno prostático específico (PSA) y una modesta mejoría clínica (1,5- 3 mL/s). Un efecto indeseable es la impotencia (3%). Con la dutasterida se ha observado una reducción del tamaño prostático del 24% y una disminución del 50% del PSA. Este tipo de fármacos parecen ser más efectivos en hombres con próstatas grandes. En cualquier caso, hay datos clínicos que muestran que el riesgo de someterse a la cirugía de próstata relacionada con la HBP es menor entre los hombres que usan dutasterida en comparación con finasterida (Kuiper, 2016).
El tratamiento, para ser eficaz, debe ser de 6 meses como mínimo. No obstante, debe mantenerse porque al año los efectos han desaparecido. Reducen en un 50% los niveles plasmáticos de PSA (antígeno específico de próstata), lo que debe ser considerado en la prevención y seguimiento del cáncer de próstata. Se ha discutido cuál de los dos fármacos es mejor. Hay algún estudio retrospectivo que compara la finasterida con la dutasterida en el que hay diferencias significativas a favor del segundo en episodios de retención aguda y requerimientos de cirugía pero los estudios bien diseñados no objetivan diferencias.
Al ser independientes los efectos de los inhibidores de la reductasa y alfabloqueantes, la terapia combinada de ambos es el tratamiento más eficiente. Hay datos clínicos que evidencian superioridad de la combinación de finasterida y doxazosina frente a la doxazosina o la finasterida solas. Se reduce el riesgo de progresión en un 66% frente a un 39% con doxazosina y un 34% con finasterida solas. Los pacientes con síntomas moderados-intensos y próstata grande como los mejores candidatos a tratamiento combinado.
Desde el año 2010, está disponible en España la asociación a dosis fija de 0,5 mg dutasterida y 0,4 mg tamsulosina (Duodart®), autorizada para reducir el riesgo de retención aguda de orina y de cirugía en pacientes con síntomas de HBP de moderados a graves. Esta circunstancia, junto con las evidencias clínicas disponibles en pacientes con síntomas urológicos (tracto urinario inferior) asociados a hipertrofia benigna de la próstata de alto riesgo de progresión, han llevado al grupo de consenso español a proponer la elección del tratamiento combinado de dutasterida y tamsulosina de inicio en pacientes con IPSS (International Prostate Symptom Score) moderado (8-20), volumen prostático grande al tacto rectal y PSA > 1,5 ng/ml (Molero, 2010).
Fitoterapia
Hay una serie de preparados de origen vegetal que proceden de la medicina popular. Actualmente está comercializado en España el extracto de Pygeum africanum, aunque asociado a otras sustancias, como la bencidamina (Prosturol®), o a aminoácidos (Tebetane compuesto®); también se mantiene el extracto de Serenoa repens (Permixon®, Prostamed®, Sereprostat®). Algunos modelos moleculares (Governa, 2016) sugieren que tanto los esteroles como los ácidos grasos presentes en sus extractos podrían desempeñar un papel en la inhibición de la 5α-reductasa. Se ha sugerido que disminuyen la resistencia uretral y el tamaño de la glándula, pero este extremo nunca se ha probado. Los estudios clínicos son escasos y la mayoría de ellos con importantes deficiencias metodológicas, aunque con resultados globales clínicamente favorables. Concretamente, la evidencia contrastada sugiere que Serenoa repens2 es capaz de mejorar de forma significativamente superior al placebo los síntomas urológicos (urgencia y nocturia) y el flujo urinario. Asimismo, produciría resultados similares a los obtenidos con finasterida, con una incidencia de efectos adversos inferior a esta última.
No se conoce con precisión cuáles son los componentes activos de Pygeum africanum, aunque se han sugerido múltiples objetivos moleculares. En concreto, se ha planteado la hipótesis de que los efectos están relacionados con flavonoides, betasitosterol, campesterol, ácido atrárico o N-butilbencenosulfonamida, que se encuentran en los extractos. Los mecanismos precisos son desconocidos, aunque se ha demostrado in vitro que el ácido atrárico y la N-butilbencenosulfonamida son potente inhibidores del receptor de andrógenos y del crecimiento celular (Larré, 2012).
Una revisión sistemática realizada en el año 2000 incluyendo a 18 ensayos clínicos aleatorizados y a 1.562 hombres, en los que se comparó Pygeum africanum vs. placebo, se encontró que el extracto vegetal mejoró significativamente los síntomas en comparación con placebo 65 vs.30%. También se encontró que P. africanum aumentó significativamente el flujo máximo de orina comparado con el placebo a las 4 a 16 semanas (incremento promedio del 23% comparado con placebo) y redujo el volumen residual de orina (reducción media del 24%). No obstante, como indican los propios autores de la revisión, los resultados deben interpretarse con cautela, ya que los ensayos clínicos incluidos en la revisión estaban limitados por su corto período de seguimiento (máximo 16 semanas). Los diseños de los ensayos y la composición de los preparados utilizados variaban, lo que dificulta la generalización de los resultados (McNicholas, 2011).
Hay numerosas revisiones posteriores que cuestionan el valor de la fitoterapia en el tratamiento sintomático de la hiperplasia prostática, a pesar de considerárseles seguros desde el punto de vista toxicológico. Se ha sugerido que en pacientes con síntomas leves que son reacios a tomar la terapéutica farmacológica estándar, estos agentes podrían ser una alternativa siempre que el paciente entienda las limitaciones de su eficacia y aquellos con hiperplasia prostática moderada o grave deberían ser desalentados con relación al uso de tratamientos alternativos y complementarios a la farmacoterapia convencional (Keen, 2015).
Anticolinérgicos
Los síntomas urológicos de llenado en los varones, como polaquiuria y nocturia, son frecuentes en la no solo en la hiperplasia benigna de próstata, sino también en la vejiga hiperactiva y en otras situaciones que cursan con obstrucción infravesical. Todos ellos provocan síntomas miccionales, tanto irritativos como obstructivos y, en el caso de los varones, los síntomas de llenado son más comunes que los de vaciado o posmiccionales y aumentan con la edad. En la hiperplasia prostática, los síntomas de vaciado u obstructivos son más específicos, pero en realidad son los de llenado los que más afectan a la calidad de vida.
Cada vez es mayor la evidencia de coexistencia entre vejiga hiperactiva y obstrucción secundaria del tracto urinario por la hiperplasia prostática (50-70%), con síntomas urológicos superpuestos. Por este motivo, aquellos con coexistencia de síntomas urológicos de llenado e hiperplasia prostática con o sin vejiga hiperactiva se pueden beneficiar de un tratamiento combinado con alfabloqueantes y anticolinérgicos.
Sin embargo, ninguno de los anticolinérgicos actualmente comercializados en España para el tratamiento de la vejiga hiperactiva (fesoterodina, flavoxato, mirabegron, oxibutinina, solifenacina, tolterodina y cloruro de trospio) tiene reconocida – como monofármacos – la indicación para el tratamiento de los síntomas urológicos asociados a hiperplasia prostática3. No obstante, ante las nuevas evidencias disponibles procedentes de diferentes estudios controlados, existe un amplio consenso para recomendar la utilización de los fármacos anticolinérgicos en pacientes con síntomas urológicos sugestivos de hiperplasia prostática, en asociación a alfabloqueantes en varones con síntomas moderados a graves, con persistencia de los síntomas de almacenamiento, a pesar del tratamiento con alfabloqueantes (Gravas, 2015).
Agentes hormonales
Dado que el desarrollo de las partes glandular y fibromuscular de la próstata es estimulado por gonadotropinas y andrógenos, se ha sugerido el empleo de superagonistas de la gonadorrelina (buserelina, leuprorelina, nafarelina, etc.), cuya administración repetida es capaz de anular la liberación de gonadotropinas desde la hipófisis, reduciendo con ello la producción de testosterona en los testículos (se trata, de hecho, de una ablación testicular “química”). De hecho, se han obtenido resultados interesantes con leuprorelina, cuyo uso es capaz de reducir en un 60% el volumen prostático. Sin embargo, los efectos adversos son numerosos (impotencia, disminución de la libido, etc.), requieren administración parenteral o intranasal, que los hacen poco apropiados para la hiperplasia benigna de próstata y, sobre todo, la próstata vuelve a incrementar su volumen tras la suspensión del tratamiento. Algo similar sucede con los antagonistas de los receptores de andrógenos (antiandrógenos), como la flutamida, cuya toxicidad es importante. Por estos motivos, los superagonistas y los antiandrógenos son reservados para el tratamiento del carcinoma de próstata y no están oficialmente indicados en la HBP.
Consumo de medicamentos para la hiperplasia prostática en el SNS
El consumo de medicamentos en el ámbito del Sistema Nacional de Salud para el tratamiento sintomático ha experimentado un importante incremento en los diez últimos años (2006-16), pasando de 8.633.198 unidades dispensadas en 2006 a 12.747.917 en 2016, lo que supone un incremento del 48% en el periodo; es reseñable, asimismo, que la tendencia de los últimos años (2014-6), también es creciente (+2,5%). En la Tabla 1 puede observarse la evolución de la terapéutica real, destacando el hecho de que la tamsulosina es el fármaco más empleado en todo momento ya que, sola o en asociación a otros fármacos, suponía en 2006 el 41% mientras que en 2016 acumulaba el 68%; todo ello, en detrimento de otros fármacos del mismo grupo, como la alfuzosina o la terazosina; la silodosina también ha entrado con fuerza en este grupo de tratamiento en los últimos años; en este sentido, un reciente estudio sugiere que este fármaco podría ser una de las terapias de primera línea para el alivio rápido y eficiente en pacientes con síntomas urológicos asociados a la hiperplasia prostática (Yoshida, 2017).
|
Tabla 1. Número de envases de medicamentos (ordenados por sus principios activos) prescritos y dispensados en el ámbito del Sistema Nacional de Salud en 2006, 2014 y 2016, para el tratamiento de la hiperplasia benigna de próstata |
||||||
|
GT |
Fármaco |
2006 |
2014 |
2016 |
∆ 2014/2016 |
∆ 2006/2016 |
|
G04CA: Antagonistas de los receptores alfa adrenérgicos |
Alfuzosina |
1.028.655 |
389.169 |
312.518 |
–19,7% |
–70% |
|
Tamsulosina |
3.578.887 |
4.924.732 |
4.901.070 |
–0,4% |
+37% |
|
|
Tamsulosina + dutasterida |
— |
2.835.188 |
3.336.857 |
+17,7% |
— |
|
|
Tamsulosina + solifenacina |
— |
— |
445.947 |
— |
— |
|
|
Terazosina |
818.020 |
329.584 |
252.493 |
–23,4% |
–69% |
|
|
Silodosina |
— |
976.665 |
1.122.234 |
+14,9% |
— |
|
|
G04CB: Inhibidores de la testosterona 5α-reductasa |
Dutasterida |
528.575 |
504.203 |
422.361 |
–16,2% |
–20% |
|
Finasterida |
888.845 |
576.734 |
550.291 |
–4,6% |
–38% |
|
|
G04CX: Otros fármacos usados en la hipertrofia prostática benigna |
Serenoa repens |
832.797 |
1.004.764 |
1.052.872 |
+4,8% |
+26% |
|
Pygeum africanum |
879.253 |
403.953 |
351.272 |
–13,0% |
–60% |
|
|
Serenoa repens + Pygeum africanum |
78.166 |
— |
— |
— |
— |
|
|
TOTAL |
|
8.633.198 |
11.944.992 |
12.248.699 |
+2,5% |
+42% |
En cuando a los inhibidores de la 5α-reductasa, su uso como monofármacos ha ido en declive de forma manifiesta en los últimos diez años (-31%) y en la práctica su uso mayoritario (al menos en lo que se refiere a la dutasterida) se hace en combinación con tamsolosina; en 2006 representan el 16% del total, mientras que en 2016 solo acumulaban – como medicamentos monofármacos – el 8%. En cuanto al resto de medicamentos, representados por los preparados fitoterapéuticos (extractos de Serenoa repens y de Pygeum africanum), han experimentado un descenso durante 2006-2016 del 22% y representan actualmente el 11% dentro de los medicamentos prescritos y dispensados en el SNS para la hiperplasia prostática, frente al 21% que suponían en 2006, y con tendencia ligeramente decreciente (–0,3%) entre 2014 y 2016.
Tratamiento quirúrgico
La indicación del tratamiento quirúrgico es variable en función de la gravedad de la situación:
- Clara: retención urinaria, azotemia con hidronefrosis, intensa hematuria, infección urinaria, incontinencia por rebosamiento.
- Moderada: valoración de síntomas y alteraciones urodinámicas.
- Débil: tamaño prostático.
El tratamiento quirúrgico incluye:
- La cirugía abierta convencional. Muy poco utilizada en la actualidad (menos del 10%). Está indicada en pacientes con próstatas de elevado volumen (> 100 cc). Supone para el paciente una incisión infraumbilical de 10 cm, un ingreso hospitalario de al menos 5 días, riesgo de sangrado (a veces muy importante), la necesidad de llevar una sonda uretral 5 días y un mes como mínimo para su incorporación a la vida normal.
- Resección transuretral de próstata (RTU): se la considera como el tratamiento quirúrgico de referencia (gold standard) actualmente y, de hecho, supone el 85-90% de los intervenidos quirúrgicamente. Se practica a través de la uretra y, por ello, no implica herida quirúrgica alguna; por tanto, es poco agresiva, tiene un riesgo de sangrado significativo en menos del 5%, aunque requiere llevar sonda uretral 3 días y la estancia hospitalaria es de 3-4 días. La recuperación es de 2-3 semanas. Plantea las incomodidades y complicaciones propias de toda intervención quirúrgica (infecciones, hemorragias, etc.), amén de algunas posibles complicaciones de incidencia variable (disfunción eréctil, incontinencia urinaria, etc.).
- Otras técnicas: en los últimos años se ha intentado minimizar los inconvenientes de la cirugía, sin menoscabo de la eficacia, reduciendo la agresividad, el sangrado, la necesidad de sonda, la estancia y el tiempo de recuperación para las tareas habituales. El láser KTP (“láser verde”) se encuadra en este marco. Actúa por fotovaporización, es decir, el tejido de la próstata se calienta y esto genera que el tejido se convierta en vapor de agua que se elimina a través de un sistema de irrigación continua. El KTP tiene una especial afinidad por la hemoglobina y esto explica que el sangrado sea muy escaso y condiciona que la sonda se pueda quitar al día siguiente y el paciente se pueda ir a casa. Debe indicarse electrovaporización con láser KTP en pacientes con próstatas pequeñas hasta que haya resultados concluyentes sobre la idoneidad de las indicaciones.
Prostatitis
La prostatitis aguda es una infección complicada. Se caracteriza por un cuadro agudo de fiebre alta, escalofríos (frecuentemente tiritona), molestias miccionales (dolor miccional, polaquiuria y, ocasionalmente, retención aguda de orina que requiere sondaje vesical) y dolor o molestia perineal. Un varón con infección urinaria y fiebre alta suele presentar una prostatitis aguda bacteriana. El tacto rectal es característico, con una próstata aumentada de tamaño, tensa, dolorosa (muy dolorosa habitualmente) y caliente. A veces, después del tacto rectal y como consecuencia del mismo, se presenta supuración uretral.
Inicialmente, suele hacerse tratamiento empírico con aminoglucósido + cotrimoxazol, o fluoroquinolona, o cefalosporina de tercera generación. Después de 3 días sin fiebre y asintomático, se continúa con terapia oral (preferentemente quinolonas) hasta completar 4-6 semanas para prevenir la aparición de recurrencias que son frecuentes. Como posibles complicaciones excepcionalmente puede aparecer un absceso prostático que requiere drenaje quirúrgico endoscópico.
La eficacia microbiológica y clínica, así como el perfil de efectos adversos, de diferentes fluoroquinolonas orales utilizados en clínica son equivalentes. Los agentes antimicrobianos alternativos probados para el tratamiento de la prostatitis bacteriana crónica causada por agentes patógenos tradicionales son cotrimoxazol, betalactámicos y tetraciclinas, pero no hay datos definitivos con respecto a la función de estos últimos. En los pacientes con prostatitis bacteriana crónica causada por agentes patógenos intracelulares obligatorios, los macrólidos muestran mayores tasas de curación microbiológica y clínica en comparación con las fluoroquinolonas (Perletti, 2013).
Cáncer de próstata
Epidemiología
La International Agency for Research on Cancer (IARC) estima que el cáncer de próstata representará en 2020 el tipo de cáncer más comúnmente diagnosticado en los varones españoles, con un 21,9% (32.689) de todos los nuevos casos de cáncer diagnosticados en varones en España (148.998). En cuanto a la mortalidad, el número estimado de varones españoles que morirán en 2020 debido a un cáncer de próstata se prevé que sea de 6.217, lo que supone el 8,5% de todas las defunciones previstas por cáncer en varones en 2020 (73.424), solo por debajo de las producidas por el cáncer de pulmón y el de colon. En la Unión Europea (UE-28), el número de casos previstos de cáncer de próstata en 2020 es de 397.984, lo que representa un 24,6% de los 1.620.153 casos de cáncer en varones; por lo que respecta al número de muertes asociadas a este tipo de cáncer, la previsión para 2020 arroja valores de 83.980, un 10,2% del total de muertes por cáncer en varones (820.325).
Estadísticamente, 1 de cada 6 varones desarrollará en España un cáncer de próstata a lo largo de su vida. Esta probabilidad aumenta con la edad, ya que 9 de cada 10 casos se diagnostican en mayores de 65 años. Afortunadamente, de todos los varones diagnosticados de cáncer de próstata, el 97% se mantienen vivos a los 5 años del diagnóstico, cerca del 80% a los 10 años y el 60% a los 15 años, considerando todos los estadios del cáncer de próstata, aunque excluyendo a los que mueren por otras causas.
La hiperplasia prostática se asocia con una mayor incidencia de cáncer de próstata según un metanálisis reciente (Dai, 2016). Según el mismo, el riesgo se cuadruplica en los estudio de casos y controles (RR = 3,93; IC95% 2,18 a 7,08), aunque es mucho más moderado en los estudios de cohorte (RR = 1,41; IC95% 1,00 a 1,99); también se asocia con el cáncer de vejiga en estudios de casos y controles (RR = 2,50; IC95% 1,63 a 3,84) y en estudios de cohortes (RR = 1,58; IC95% 1,28 y 1,95). El análisis por grupos étnicos sugirió que la asociación entre la HBP y el cáncer de próstata era mucho más fuerte en los asiáticos (RR = 6,09; IC95% 2,96 a 12,54) que en los caucásicos (RR = 1,54; IC95% 1,19 a 2,01).
Actualmente, no existe un factor de riesgo ocupacional establecido para el cáncer de próstata. Sin embargo, en los años ochenta, un estudio de casos y controles en el área de Dortmund mostró un alto riesgo para los mineros de carbón y, en pocos casos, para pintores y barnices. Aproximadamente, 10 años más tarde un estudio similar en relación con el cáncer de próstata se realizó en esta área. En total, 292 pacientes con cáncer de próstata sometidos a prostatectomía radical y 313 controles sometidos a resección transuretral de una hiperplasia prostática benigna fueron investigados, encontrándose que las exposiciones ocupacionales relacionadas con un riesgo elevado de cáncer de próstata fueron exposiciones a productos de combustión (20% de casos frente a 11% de controles) y tintes y colorantes (19 vs. 13%) (Krech, 2016).
El sistema de estadificación tumoral más utilizado en cáncer de próstata es el índice de Gleason, el cual diferencia distintos patrones celulares (grupos mayoritarios) procedentes de varias muestras obtenidas en una biopsia de la próstata, cuantificándoles entre 1 (células normales) y 5 (células muy indiferenciadas). En el informe se utilizan dos números, representando el primero de ellos el patrón predominante y el segundo el patrón que le sigue en frecuencia (que puede tener el mismo índice que el primero, lo que significa que las muestras son muy homogéneas). El Gleason mínimo es 2 (1+1) y el máximo es 10 (5+5), siendo inusual que el Gleason primario y secundario difieran en más de una unidad. En general, la sobrevida específica de la enfermedad para los pacientes con Gleason de 7 es alrededor de 10 años, aquellos con 6 sobreviven en torno a 16 años y por debajo de este valor de Gleason la supervivencia general supera los 20 años.
La edad media de diagnóstico de cáncer de próstata en España es de 69 años y más de la mitad un Gleason ≤ 6; en concreto, por encima del 70% se diagnostican cuando aún están localizados o confinados dentro de la próstata y al menos en el 85% no se ha extendido a los tejidos de alrededor de la próstata ni a los ganglios linfáticos. Por este motivo, muchos de los pacientes recién diagnosticados probablemente acabarán muriendo por cualquier otra causa sin haber padecido jamás ninguna alteración significativa proveniente de su cáncer de próstata. Sólo un 6% de los hombres con cáncer de próstata presentan extensión a otras partes distantes del cuerpo en el momento del diagnóstico; entre estos la supervivencia al cabo de cinco años es del 34%, aunque dado que la tasa de crecimiento tumoral es muy variable, algunos pacientes con metástasis distales tienen una supervivencia mucho más prolongada.
Un 70% de los tumores prostáticos crecen en la zona periférica de la glándula, otro 15-20% en la zona central y el restante 10-15% en la zona transicional; la mayoría son multicéntricos. Más del 95% de los cánceres primarios de la próstata son adenocarcinomas (tumores glandulares). En general, el grado de diferenciación tumoral y la anormalidad del comportamiento histológico de crecimiento están directamente relacionados con la probabilidad de metástasis y de muerte. Otros factores que afectan el pronóstico de pacientes con cáncer de próstata incluyen el grado histológico del tumor, la edad del paciente, la coexistencia de otras enfermedades y la concentración sérica de antígeno prostático específico (PSA).
Aspectos clínicos

El cáncer de próstata generalmente es asintomático en los estadios iniciales, cuando el tumor se encuentra localizado en el interior de la próstata (T1 y T2), e incluso si ha invadido la cápsula o las vesículas seminales (T3). Los síntomas se relacionan con la presencia de metástasis (T4) en los huesos (dolor, fracturas, compresión medular) e invasión masiva de ganglios linfáticos (edemas de extremidades inferiores).
En los tumores de gran tamaño, se pueden producir síntomas miccionales obstructivos o retención aguda de orina por la compresión uretral. Si el tumor invade la vejiga, se puede producir hematuria (sangre en la orina). También en los tumores avanzados o metastásicos se pueden observar síntomas generales como anorexia, pérdida de peso o caquexia (Cuéllar, 2015).
El cáncer de próstata tiende a ser multifocal y con frecuencia afecta a la cápsula glandular. Al contrario que la hipertrofia benigna de próstata, el cáncer de próstata predomina en la periferia de la próstata. Ambas características (multifocal y periférica) hacen muy complicada y frecuentemente impracticable la resección transuretral del tumor, especialmente cuando se encuentra en una fase avanzada.
Tratamiento
El tipo de tratamiento depende de varios factores: estadio clínico, factores pronósticos y expectativa de vida del paciente. En general se opta por una terapia con intención curativa cuando la expectativa de vida es mayor de 10 años, incluyendo la cirugía (prostatectomía radical) y la radioterapia.
Terapia con intención curativa
En los estadios iniciales de la enfermedad (estadios T1 y T2) en los que el tumor se considera localizado o de bajo riesgo, existe consenso en la realización de tratamiento con intención curativa, ya sea con cirugía radical, o con radioterapia externa o interna (esta última denominada braquiterapia), si la expectativa de vida del paciente es superior a 10 años. En varones muy ancianos o con expectativa de vida menor de 10 años, la actitud de esperar y ver – vigilancia expectante o activa, watchful waiting – es la opción terapéutica de referencia, especialmente cuando los tumores están bien diferenciados. También es una opción en los pacientes con tumores Gleason ≤ 6, al menos dos biopsias positivas y ≤ 50% de afectación por cáncer en cada biopsia, así como en pacientes con una expectativa de vida de menos de 10 años o que no acepten las posibles complicaciones relacionadas con otros tratamientos. En los pacientes con tumor localmente avanzado (estadio T3) y expectativa de vida mayor de 10 años, el tratamiento más aceptado es la radioterapia con tratamiento hormonal neoadyuvante (iniciado 6 meses antes) y adyuvante (hasta 3 años después de finalizar la radioterapia). El tratamiento hormonal también se puede plantear como alternativa en los pacientes con expectativa de vida inferior a 10 años.
La prostatectomía radical (PR) con intención curativa sólo está indicada en cuando exista una biopsia de vesículas seminales y estudio de extensión negativos, factores de buen pronóstico asociados y linfadenectomía iliobturatriz bilateral previa a la cirugía con biopsia intraoperatoria negativa. Tras la realización de una prostatectomía radical, la indicación de radioterapia adyuvante se establece en los casos de alto riesgo de recidiva local. En general, la prostatectomía radical está especialmente indicada en los pacientes con cáncer de próstata localizado de riesgo bajo e intermedio (T1a-T2b, Gleason de 2-7 y PSA ≤ 20) y una esperanza de vida > 10 años; también lo está opcionalmente en pacientes seleccionados con cáncer prostático localizado de alto riesgo y bajo volumen (T3a, Gleason de 8-10 o PSA > 20) e incluso en pacientes muy seleccionados con tumores localizados de muy alto riesgo (cT3b-T4 N0, o cualquier T N1) en el contexto de un tratamiento multimodal. En general, no se recomienda el tratamiento neoadyuvante a corto plazo (3 meses) con análogos de la GnRH en caso de enfermedad en estadio T1-T2.
La radioterapia externa postoperatoria inmediata tras una prostatectomía radical en pacientes con cáncer avanzado o de muy alto riesgo mejora la supervivencia global y la supervivencia libre de progresión tumoral. Por su parte, la braquiterapia (radioterapia interna) es un procedimiento consistente en la inserción de implantes radiactivos en la glándula prostática con el fin de destruir las células cancerosas. Estos implantes pueden ser emisores de alta o baja radiación. La técnica requiere la utilización de una sonda (habitualmente de ultrasonidos o una tomografía axial computadorizada, TAC) para visualizar la zona y la colocación del implante, que se coloca con agujas o aplicadores especiales a través del perineo. La braquiterapia produce buenos resultados y la mayoría de pacientes permanecen libres de cáncer prostático o lo mantienen bajo control durante muchos años. En general, la braquiterapia tiene menos complicaciones y efectos secundarios que la radioterapia externa, aunque entre las complicaciones descritas figuran impotencia sexual, dificultades miccionales, irritación cutánea en el recto o sangrado proveniente de éste y llagas o fístulas en el recto y estrechamiento de la uretra; aunque todos ellos son poco comunes, en caso de producirse pueden persistir hasta varios meses.
Terapia hormonal (privación androgénica)
Es bien conocido que al principio de su ciclo natural el cáncer de próstata es dependiente de las hormonas androgénicas, pero al final de su evolución clínica deja de serlo y, por ello, se hace resistente al tratamiento de privación androgénica. Sin embargo, es probable que el cáncer de próstata contenga subpoblaciones de células dependientes de andrógenos incluso en las fases en las que el tumor es globalmente independiente de estas hormonas; por ello, la supresión androgénica continuada mantiene un valor relevante incluso en los varones con cáncer de próstata andrógeno-independiente.
En principio, es importante alcanzar concentraciones séricas de testosterona lo más bajas posible para que el tratamiento de privación androgénica logre reducir al mínimo la estimulación de las células cancerosas de la próstata. Las concentraciones séricas de testosterona que corresponden a los niveles de castración se han establecido en menos de 50 ng/dl (0,5 ng/ml; 1,7 nmol/l). La consecución de valores de testosterona equivalentes a los de la castración es un criterio indirecto de valoración aceptable en el cáncer de próstata avanzado sensible a hormonas que puede asociarse a un descenso del dolor causado por las metástasis óseas, a una mejoría del flujo urinario y, en algunos casos, al retraso de la progresión del tumor, si bien no se ha demostrado una clara relación con la ampliación de la supervivencia. Por esto último, la privación androgénica se considera un tratamiento paliativo.
Antiguamente, para lograr la supresión de la testosterona se recurría a la orquiectomía bilateral (castración quirúrgica). Entre sus desventajas están los efectos psicológicos, la pérdida de la libido, la aparición de impotencia, de osteoporosis, de rubor y de sofocos. Actualmente sigue siendo un recurso, pero la terapia hormonal farmacológica permite obtener una auténtica castración química, sin las complicaciones que toda intervención quirúrgica plantea, además del propio rechazo psicológico por parte de algunos pacientes. Dicha castración química es conseguida mediante el uso, a veces combinado, de diversos agentes farmacológicos que impiden la síntesis o la actividad de las hormonas androgénicas, principalmente la testosterona y su principal metabolito intracitoplasmático, la dihidrotestosterona (DHT).
El 90-95% de toda la testosterona es producida por los testículos en los varones humanos y la mayor parte del restante 5-10% es producido en las glándulas suprarrenales. Pese a ello, la castración quirúrgica o la farmacológica tradicional (a base de superagonistas de GnRH) solo reduce la concentración de testosterona y de dihidrotestosterona (DHT) en un 70-80% en el interior de las células prostáticas. Esto es debido a la secreción por las glándulas suprarrenales de ciertas moléculas con propiedades débilmente androgénicas como la dihidroepiandrosterona (DHEA) y la androstenediona; de hecho, ésta se ha convertido en una diana farmacológica que ha permitido el desarrollo de los modernos inhibidores del citocromo CYP17, que anulan dicha vía. Con todo y con ello, en los pacientes con cáncer de próstata metastático, además hay una producción de testosterona por las propias células tumorales prostáticas y ello podría activar a las células tumorales hormonodependientes.
Se considera que al menos una tercera parte de los pacientes diagnosticados de cáncer de próstata recibirán un tratamiento hormonal en algún momento de su vida. Los beneficios aportados por el bloqueo androgénico en los pacientes con enfermedad avanzada son:
- Menos eventos urológicos (obstrucción uretral y/o ureteral, hematuria).
- Menos eventos óseos (microfracturas patológicas, dolor óseo, compresión medular).
- Menos metástasis extraesqueléticas.
En general, el tratamiento hormonal en el cáncer de próstata es inicialmente muy eficaz, con una mejoría sintomática en aproximadamente el 70-80% de los pacientes y una duración de la respuesta de dos años, pero todavía no está claro si se debe iniciar el tratamiento hormonal, es decir, si debe ser o no diferido hasta la aparición de síntomas o de progresión de la enfermedad, y la posibilidad de poder realizar un tratamiento hormonal intermitente frente a uno continuo, con una potencial mejoría en la calidad de vida por la disminución de la toxicidad derivada de los tratamientos.
En general, el bloqueo androgénico está indicado en las siguientes situaciones clínicas:
- Tumor localizado en pacientes ancianos o con expectativa de vida inferior a 10 años.
- Asociado a radioterapia en tumores localmente avanzados.
- Tumor metastásico.
- Como tratamiento de rescate tras recidiva bioquímica (elevación de PSA) después de la realización de tratamiento con intención curativa (cirugía radical o radioterapia).
Análogos sintéticos de gonadorelina
En condiciones fisiológicas, la liberación pulsada cada 60-120 minutos de la hormona liberadora de gonadotropinas (gonadoliberina, gonadorrelina, Gonadotropin Release Hormone, GnRH) produce la secreción por la hipófisis anterior de hormona luteinizante (LH) y de hormona foliculoestimulante (FSH). La LH produce la secreción de testosterona a nivel testicular, mientras que la FSH activa la espermatogénesis. La GnRH es un decapéptido, en cuya estructura la sustitución de algunos aminoácidos produce cambios que prolongan su acción y aumentan su resistencia a la degradación enzimática, dando origen a los análogos sintéticos de GnRH: buserelina (Suprefact®), goserelina (Zoladex®), leuprorelina (Eligard®, Lutrate®, Procrin®) y triptorelina (Decapeptyl®, Gonapeptyl®).
Los análogos de GnRH se administran habitualmente como implantes por vía subcutánea o como microesferas por vía intramuscular, de forma mensual, trimestral, semestral o incluso anual. Las respuestas obtenidas con los diferentes análogos de GnRH en pacientes con cáncer de próstata metastásico son superponibles, con respuestas objetivas que oscilan entre el 80% y el 93% de los casos, dependiendo de los meses de tratamiento. Tampoco se han observado diferencias en cuanto a las respuestas objetivas y la sobrevida entre los pacientes tratados con análogos de GnRH y los pacientes tratados con castración quirúrgica o con estrógenos.
Antagonistas de gonadorelina
Bajo la hipótesis de que los antagonistas de gonadorelina podrían ejercer efectos similares a los análogos (superagonistas) de LHRH, pero sin los efectos adversos ligados a la hiperestimulación (flare), particularmente los sofocos intensos típicos de estos últimos, se han desarrollado una nueva serie de fármacos, cuya cabeza de serie es el degarelix (Firmagon®). Éste se une de forma competitiva y reversible a los receptores hipofisarios de GnRH, disminuyendo rápidamente la liberación de gonadotropinas (LH: hormona luteinizante y FSH: hormona folículoestimulante) y, con ello, reduce drásticamente la secreción testicular de testosterona. Ha sido autorizada para el tratamiento de pacientes varones adultos con cáncer de próstata avanzado hormono-dependiente.
Los datos clínicos contrastados indican que el degarelix efectivamente provoca una drástica y rápida caída de los niveles de FSH, LH y testosterona, hasta alcanzar valores similares a los obtenidos con la castración quirúrgica (< 0,5 ng/ml de testosterona), manteniéndolos así durante todo el tratamiento. En este sentido, no es inferior a la leuprorelina y, posiblemente, otros agonistas de GnRH. Presenta un perfil de seguridad previsible, ligado claramente a descenso de los niveles de testosterona, aunque peor tolerancia local (dolor/induración) que la leuprorelina y una incidencia ligeramente superior de sofocos. Sin embargo, por el contrario, el degarelix se asocia con una menor incidencia de trastornos cardiacos (incluyendo dolor torácico ligado a isquemia coronaria); con todo, la suspensión del tratamiento por eventos adversos graves ha sido más habitual con degarelix (6%) que con leuprorelina (1,5%) en ensayos clínicos controlados.
Algunos datos parecen apuntar que el degarelix podría producir un mejor control de los síntomas urológicos y renales asociados al cáncer prostático y mejorar la calidad de vida de los pacientes, previniendo los efectos (flare up) del pico inicial de testosterona y reduciendo el relativo riesgo cardiaco de los (super)agonistas de GnRH. El NICE (2015) ha indicado que el degarelix es beneficioso para evitar el brote de testosterona, lo que podría ser de gran interés en las personas con metástasis vertebrales, algunos de los cuales se pueden desarrollar compresión de la médula espinal; de hecho, podría haber una relación entre el brote de testosterona cuando comience el tratamiento hormonal y la compresión de la médula espinal. En este sentido, el riesgo de compresión de la médula espinal podría ser menor en las personas que usen degarelix en comparación con agonistas de GnRH porque degarelix no produce el brote inicial en los niveles de testosterona. Sin embargo, el NICE llegó a la conclusión de que no es posible identificar de forma fiable y definir con precisión un subgrupo de pacientes que se enfrentan a un mayor riesgo de desarrollar la compresión de la médula espinal de la población más amplia de pacientes con metástasis vertebrales de la próstata.
Antiandrógenos de acción directa
Los antiandrógenos de acción directa bloquean competitivamente el receptor de andrógenos en el núcleo de las células prostáticas (tanto en las normales como en las tumorales). Según su estructura, se distinguen entre esteroídicos y no esteroídicos; tales diferencias estructurales tienen importantes implicaciones farmacológicas y toxicológicas. Entre los antiandrógenos esteroídicos se distinguen la ciproterona y el megestrol, aunque actualmente su uso clínico está limitado al tratamiento de los sofocos producidos por la supresión androgénica.
Mucho más utilizados actualmente son los denominados antiandrógenos puros o no esteroídicos. La flutamida (EFG, Grisetin®, Prostacur®) actúa bloqueando la unión de la dihidrotestosterona (DHT) con su receptor en la célula prostática. No se puede utilizar como monoterapia, sino que se debe asociar a análogos de GnRH, para contrarrestar el aumento en la liberación de LH, con el consiguiente aumento de la secreción de testosterona que finalmente competiría con la propia flutamida por el receptor y la desplazaría. Por su parte, la bicalutamida (EFG, Casodex®, Pencial®) presenta un perfil farmacológico similar, aunque su afinidad hacia el receptor androgénico es el doble que la de la flutamida (pero 30 veces inferior que la de la DHT); hay datos clínicos contrastados que demuestran una mayor eficacia en términos de supervivencia, con menor toxicidad y menor tasa de suspensión del tratamiento.
Aunque la enzalutamida (Xtandi®) está estrechamente relacionado con los anteriores antagonistas del receptor androgénico, tiene mayor afinidad hacia éste y, lo que es más importante, reduce la translocación nuclear del receptor activado, resultando en una disminución significativa de la cantidad de receptores androgénicos presentes en el citoplasma, dificulta la unión del receptor activado con el ADN celular e interfiere con el reclutamiento del co-activador, todo lo cual resulta en una disminución del crecimiento celular y la inducción de apoptosis celular y, en definitiva, conduce a una reducción del volumen tumoral prostático.
Inhibidores de la síntesis de andrógenos
La castración quirúrgica o el tratamiento con superagonistas de la gonadorelina o de antagonistas de ésta solo son eficaces en la reducción de la síntesis de andrógenos a nivel testicular, pero no afectan a otras rutas bioquímicas minoritarias de producción de andrógenos, como las glándulas suprarrenales o las propias células tumorales prostáticas. La abiraterona (Zytiga®) es un inhibidor de la biosíntesis de andrógenos a todos los niveles orgánicos, provocando una drástica reducción de los niveles de testosterona – hasta niveles indetectables en suero – cuando se administra a pacientes tratados con agonistas de la gonadorelina (GnRH) o castrados quirúrgicamente (orquiectomía bilateral). Es un irreversible y selectivo del enzima 17α-hidroxilasa/C17,20-liasa (CYP17), que impide la síntesis de todos los precursores biológicos de la testosterona, concretamente de la deshidroepiandrosterona (DHEA) y de la androstenodiona, lo que conduce a la práctica desaparición de la testosterona a nivel testicular, suprarrenal y prostático (incluyendo a las células tumorales productoras de testosterona) y, además, a un incremento colateral de la síntesis de mineralcorticoides en las suprarrenales. La abiraterona carece de efectos significativos sobre la aromatasa ni la 5α-reductasa.
El medicamento ha sido autorizado para su uso en combinación con prednisona o prednisolona para el tratamiento del cáncer de próstata metastásico resistente a la castración en hombres adultos que sean asintomáticos o levemente sintomáticos tras el fracaso del tratamiento de deprivación de andrógenos en los cuales la quimioterapia no está aun clínicamente indicada, así como para el tratamiento del cáncer de próstata metastásico resistente a la castración en hombres adultos cuya enfermedad ha progresado durante o tras un régimen de quimioterapia basado en docetaxel.
Presenta un moderado perfil toxicológico, manejable mediante medidas relativamente sencillas, que deriva de la activación mineralcorticoide – una derivación secundaria, consecuencia del bloqueo del CYP17 –, que se manifiesta fundamentalmente como edema periférico, hipopotasemia e hipertensión. Aunque la incidencia de trastornos cardiacos es mayor que la del placebo, no lo es la mortalidad ligada a ellos (1%).
Quimioterapia
El papel de la quimioterapia en el cáncer de próstata era muy cuestionado hasta hace no mucho tiempo. Sin embargo, actualmente se acepta el uso de potentes agentes antineoplásicos en el cáncer metastásico de próstata hormono-independiente, con el objetivo de disminuir el crecimiento del cáncer y reducir el dolor, obteniéndose respuestas parciales objetivas que alcanzan entre el 10 y el 40% de los casos.
El docetaxel (Taxotere®) es un análogo sintético del paclitaxel, cuyo efecto antitumoral se basa en la interrupción de la función de los microtúbulos en el mantenimiento de la morfología y la división celular. Además, los taxanos reducen la expresión de Bcl-2, uno de los oncogenes que actúan bloqueando la apoptosis. También estimulan la síntesis de enzimas y factores de transcripción relacionados con la proliferación celular, la apoptosis y la inflamación. Cuando se usan con concentraciones menores de las que producen citotoxicidad, los taxanos actúan inhibiendo la angiogénesis. Además tiene un efecto radiosensibilizante al impedir la progresión del ciclo celular en G2, que es cuando la célula es más susceptible al daño inducido por las radiaciones ionizantes. En combinación con prednisona o prednisolona, el docetaxel está indicado para el tratamiento de pacientes con cáncer de próstata metastásico refractario a hormonas; de hecho, actualmente es considerado como el antineoplásico de referencia y de primera elección en esta indicación. El cabazitaxel (Jevtana®) también forma parte del grupo de los taxanos; ha sido autorizado para el tratamiento, en combinación con prednisona o prednisolona, de pacientes adultos con cáncer de próstata metastásico resistente a la castración, tratados anteriormente con una pauta terapéutica conteniendo docetaxel.
La mitoxantrona (EFG, Novantrone®) es empleada en combinación con corticosteroides, como quimioterapia inicial para el tratamiento de pacientes con dolor causado por cáncer de próstata avanzado resistente al tratamiento hormonal. Su papel en la quimioterapia del cáncer de próstata hormonorresistente ha ido perdiendo protagonismo a favor de los taxanos. Algo parecido ha ocurrido con el fluorouracilo (EFG).
Radiofármacos
Como ya se ha indicado, el bloqueo androgénico tradicional (antiandrógenos puros y análogos de la GnRH) tiene una limitada duración en su eficacia (entre 18 y 24 meses), tras lo que es preciso recurrir a fármacos que interfieran más selectivamente el estímulo androgénico, como la enzalutamida o la abiraterona, así como a la quimio y a la inmunoterapia selectivas; estos recursos terapéuticos se utilizan también – junto con la radioterapia externa o interna – en caso de metástasis óseas. En concreto, hasta ahora los radiofármacos disponibles para uso interno con indicación de metástasis tumorales óseas, son el cloruro de estroncio (89Sr), el lexidronam de samario (153Sm) y el cloruro de radio [223Ra] que se utilizan habitualmente cuando hay ausencia de metástasis viscerales.
El estroncio [89Sr] (Metastron®), debido a sus propiedades electroquímicas, es capaz de incorporarse en las zonas de proliferación óseas, tal y como ocurre con el calcio in vitro. Se trata de un radioisótopo emisor beta, con una vida media física de 50,5 días. Por su parte, el samario [153Sm] (Quadramet®) es un emisor de radiación beta (70%) y gamma (30%). Tiende a acumularse sobre las lesiones osteoblásticas (en una proporción 5:1 sobre el hueso normal). Tiene un vida media relativamente corta (46 horas). Como emisor gamma que es y dada su elevada selectividad hacia las lesiones osteoblásticas, permite además la realización de escintigrafía para determinar los parámetros dosimétricos individuales de cada lesión.
El radio [223Ra] (Xofigo®) es un radiofármaco emisor de partículas alfa, que es incorporado a las metástasis óseas, al emular químicamente al calcio. La similitud del comportamiento químico del radio [223Ra] en relación al calcio [Ca] facilita la incorporación del radioisótopo a la hidroxiapatita del hueso, ocupando el lugar del calcio; desde ahí ejerce un efecto citotóxico local sobre las células tumorales próximas, así como sobre los osteoblastos y osteoclastos presentes en la lesión ósea metastásica. Las partículas alfa (α) emitidas por el radio [223Ra] tienen un alcance muy corto (menos de 100 µ, lo que equivale a menos de 10 diámetros celulares), limitando así sus efectos citotóxicos al entorno de la lesión metastásica (Cuéllar, 2015). Tras su administración en forma de bolo IV, el radio [223Ra] es rápidamente distribuido hacia los tejidos periféricos, particularmente hacia el óseo (44-77% en las primeras 4 horas). A los 7 días, aproximadamente el 76% de la actividad administrada ha desaparecido del organismo.
El papel asistencial del farmacéutico
Son dos, básicamente, los componentes asistenciales que los farmacéuticos deben desarrollar para optimizar la salud prostática de la población masculina.
- Gestión de la salud pública:
- Suministro de información personalizada sobre la prevención y detección de problemas potencialmente relacionados con alteraciones prostáticas.
- Detección de cuadros patológicos ocultos o minusvalorados por los propios pacientes.
- Seguimiento farmacoterapéutico:
- Optimización de la adherencia del tratamiento farmacológico.
- Prevención y control de eventos adversos e interacciones farmacológicas.
Prevención y detección
La salud de la próstata, obviamente, no puede aislarse del resto de medidas de conservación y mejora integral de la salud. Sin embargo, dada la elevada incidencia de patologías prostáticas y la eventual gravedad de algunas de ellas, aconseja reservar un importante nivel de atención a este tipo de cuestiones, para aclarar las dudas más relevantes y, en su caso, facilitar la remisión de algunas personas a la consulta médica para su examen detallado.
En el caso de la hiperplasia benigna de próstata, existe una serie de signos y síntomas que pueden sugerir la existencia real de este problema. En general, es recomendable remitir al médico a todos aquellos varones que refieren un incremento progresivo de la necesidad de levantarse por la noche a orinar y a la sensación de urgencia urinaria (aunque la cantidad de orina miccionada sea muy pequeña), la dificultad creciente para comenzar la micción y reducción de la velocidad de ésta; así como la sensación de vaciado incompleto de la vejiga, el goteo incontrolado de orina tras la micción y la incapacidad para detener bruscamente ésta. Obviamente, la experiencia de una retención urinaria completa requiere una atención médica urgente.
En ocasiones, algunos de estos síntomas pueden estar relacionados con el empleo de determinados medicamentos, en particular aquellos con propiedades anticolinérgicas y diuréticas. Es importante, para ello, utilizar aplicaciones informáticas para contrastar esta información, como Bot PLUS. En este sentido, una simple búsqueda en esta aplicación indica que 139 principios activos tienen registrada la retención urinaria como un efecto adverso asociado, mientras que 66 se asocian a incontinencia urinaria. El examen del botiquín o del historial farmacoterapéutico del consultante es, por tanto, muy relevante.
Tan importante como informar adecuadamente y, en su caso, remitir a la consulta médica, es reforzar la información que el médico haya transmitido al paciente. Algunos de los pacientes, tras acudir al médico de familia o incluso del especialista (urólogo), pueden sentirse defraudados “por no haber recibido ningún tratamiento”. En línea con las explicaciones médicas recibidas, es muy importante que el paciente comprenda que la opción prioritaria para aquellos con sintomatología leve o moderada y poca afectación de su calidad de vida consiste en lo que se conoce como “vigilancia expectante”, es decir, el seguimiento clínico con consejos sobre el estilo de vida más adecuado, pero sin necesidad de utilizar ningún medicamento. De hecho, en algunos pacientes los síntomas pueden mejorar de forma espontánea, mientras que en otros se mantienen estables durante muchos años; más de un tercio de los hombres con hiperplasia prostática con síntomas urológicos leves o moderados obtienen una mejoría sintomática sin ninguna intervención farmacológica, es decir, solo con la ayuda de algunos cambios en su estilo de vida.
Las recomendaciones relativas al estilo de vida están básicamente dirigidas hacia una mejora del control de los síntomas urológicos:
- Realizar actividades encaminadas a reducir el estrés.
- No beber una cantidad excesiva de líquidos, especialmente de una sola vez; es preferible repartir la bebida en pequeñas cantidades a lo largo del día y evitar beber dos horas antes de acostarse o antes de un viaje largo.
- No ingerir bebidas alcohólicas o con alto contenido en cafeína (café, té, refrescos de cola, bebidas energéticas, etc.).
- Evitar el estreñimiento, utilizando una dieta rica en fibra.
- Evitar utilizar, sin el debido asesoramiento médico y farmacéutico, medicamentos con efectos sobre el tracto urinario inferior, como los antihistamínicos (en particular, los más antiguos: clorfenamina, difenhidramina, doxilamina, etc.) o descongestivos (vasoconstrictores) por vía oral, ya que pueden alterar la micción. Es importante tener en cuenta que este tipo de medicamentos está presente en numerosos preparados “anticatarrales”, hipnóticos, etc.
- Intentar mantener una disciplina miccional, orinando cuando se presenta la necesidad inicial cuando el momento y el lugar lo permitan, aunque no se sienta la necesidad de orinar (como al inicio de un viaje largo).
- Evitar el frío y las corrientes de aire, porque inducen de forma refleja la micción aunque la vejiga esté vacía.
- Realizar ejercicio físico moderado, incluyendo ejercicios pélvicos para fortalecer la musculatura abdominal.
- Hacer una dieta sana y variada, evitando engordar ya que ello puede favorecer el desarrollo hiperplásico de la próstata.
La aparición de un cuadro agudo de fiebre alta, escalofríos (frecuentemente tiritona), molestias miccionales (dolor miccional, polaquiuria y, ocasionalmente, retención aguda de orina que requiere sondaje vesical) y dolor o molestia perineal puede sugerir una prostatitis aguda, que es una infección complicada y que requiere una evaluación médica detallada y urgente.
A pesar de la alta incidencia de cáncer de la próstata (de hecho, es el cáncer más prevalente entre los varones), todavía existe controversia en cuanto al significado de los exámenes de detección. No existen suficientes datos para demostrar que el cribado sistemático (poblacional) del cáncer de próstata por medio del tacto rectal y de la determinación del antígeno prostático específico (PSA) reduzca la mortalidad. Lo que sí se ha demostrado es que estos métodos de cribado son capaces de detectar algunos cánceres que nunca habrían causado problemas de importancia. Este hecho podría conducir a un sobretratamiento de esta enfermedad por medio de cirugía y/o radioterapia, del que pueden derivar graves secuelas como la disfunción eréctil y la incontinencia urinaria, entre otras.
El antígeno específico prostático (PSA, por sus siglas en inglés Prostatic Specific Antigen) es una glucoproteína producida y concentrada en la glándula prostática, cuyo nivel en sangre aumenta cuando existe alguna patología que altera la estructura de la próstata (prostatitis, hipertrofia benigna de próstata, tumores cancerosos, etc.). El PSA puede circular en sangre de forma libre (PSA libre) o bien unido a proteínas, preferentemente a la alfa-1 antiquimiotripsina (PSA complejo) y la alfa-2 macroglobulina, siendo la suma de todos el PSA total. Debe tenerse en cuenta que los fármacos utilizados el tratamiento de la hiperplasia benigna de próstata (especialmente los inhibidores de la 5α-reductasa) reducen hasta en un 50% sus niveles. No está definido el nivel de PSA que caracterice con certeza la existencia de un cáncer de próstata, debiendo valorarse especialmente la edad del paciente, aunque sí se ha constatado que la probabilidad de presentar un cáncer de próstata se incrementa significativamente para niveles de PSA>4 ng/ml, pero al mismo tiempo hay que tener en cuenta que el riesgo no es en absoluto desdeñable de personas con un PSA<4 (hasta una cuarta parte de los pacientes). Sea como fuere, la Asociación Europea de Urología considera que debe valorarse la necesidad de realizar una biopsia de próstata en hombres con niveles elevados de PSA, con PSA libre/PSA total < 20% y ritmo de incremento del PSA > 0,75 ng/ml/año.
El cribado poblacional o colectivo implica la exploración sistemática de varones asintomáticos (pero con características consideradas como de riesgo, como la edad), mientras que la detección precoz o cribado oportunista conlleva búsquedas de casos individuales, que son inducidas por el propio sujeto o por su médico. Actualmente, la Asociación Europea de Urología no considera apropiado el cribado colectivo (poblacional) del cáncer de próstata; sí, en cambio, la detección precoz (cribado oportunista) es valorada como una medida adecuada que debe ofrecerse a personas que estén bien informadas al respecto. En concreto, se ha propuesto una determinación inicial del PSA a los 40 años de edad en la que podría basarse el intervalo de cribado posterior. En general, un intervalo de cribado de 8 años podría considerarse como suficiente en los varones con un valor inicial de PSA ≤ 1 ng/ml, sin que fuesen necesarios nuevos determinaciones de PSA en los varones mayores de 75 años con un PSA basal ≤ 3 ng/ml, debido a que el riesgo de fallecer por cáncer de próstata en estos pacientes es muy bajo.
Seguimiento farmacoterapéutico
La eficacia de los tratamientos farmacológicos en la hiperplasia prostática está contrastada, pero su experiencia subjetiva por los pacientes puede resultar poco relevante y ello hace que, en algunos casos, exista una cierta tendencia al abandono del tratamiento, ante una supuesta falta de eficacia. Dado que, por otro lado, algunos efectos adversos asociados al tratamiento – aunque en general, leves – suelen manifestarse al principio de éste, el balance subjetivo que pueden experimentar algunos pacientes puede llegar a ser negativa y, con ello, justificar su actitud negativa y el propia abandono del tratamiento, lo que en muchas ocasiones no es informado por el paciente al médico. La percepción de que la hiperplasia prostática es un fenómeno inevitablemente ligado al envejecimiento puede contribuir a esta actitud negativa.
Un amplio estudio (Cindolo, 2015) ha mostrado que la adherencia total al tratamiento farmacológico de la hiperplasia prostática a lo largo de un año es, globalmente, de apenas un 29%; en concreto, de un 35% para monoterapia con alfabloquantes (AB), de un 18% con inhibidores de la 5a-reductasa (5ARI) y del 9% para la terapia combinada (TC) con medicamentos monocomponente. Aún más, la adherencia del paciente disminuyó progresivamente al 15%, 8% y 3% para AB, 5ARI y TC, respectivamente, en el quinto año de seguimiento. Los pacientes con TC tuvieron una mayor tasa de interrupción a lo largo de todo el seguimiento en comparación con aquellos bajo monoterapia con AB o 5ARIs (todos p < 0,0001); sin embargo, la TC se asoció con un menor riesgo de hospitalización por cirugía relacionada con la hiperplasia prostática (HR = 0,94; p < 0,0001) en comparación con la monoterapia con AB.
Desde la oficina de farmacia es especialmente importante ofrecer un servicio personalizado de dispensación (SPD), empleando para ello dispositivos adecuados para una correcta aplicación de las pautas posológicas y una adecuada adherencia al tratamiento de los medicamentos prescritos por el médico, ya que los pacientes con cáncer de próstata suelen estar polimedicados. Puede ofrecérsele al paciente o a su cuidador un seguimiento farmacoterapéutico que incluya la revisión del botiquín, a fin de eliminar todos los medicamentos caducados o potencialmente peligrosos que no hayan sido prescritos recientemente, así como advertir la posibilidad de peligrosas interacciones farmacológicas. En este sentido, es fundamental evitar el consumo de ningún medicamento que no haya sido prescrito por el médico, aunque sea de uso habitual.
Es importante asesorar a los pacientes sobre los posibles eventos adversos que pueden producirse durante el tratamiento con los fármacos específicamente indicados para el cáncer de próstata. Los análogos de GnRH – leuprorelina (Procrin® y Eligard®), goserelina (Zoladex®), triptorelina (Decapeptyl®, Gonapeptyl®), buserelina (Suprefact®) e histrelina (Vantas®) – no son especialmente tóxicos. La mayoría de los pacientes presenta pérdida de libido, disfunción eréctil y sofocos; cuando estos últimos llegan a ser especialmente molestos, el médico responsable suele prescribir pequeñas dosis de estrógenos o de agentes antiandrógenos. En cualquier caso, el efecto adverso más prominente (aunque no el más grave) de estos fármacos es el flare up, que se produce en respuesta al brusco incremento de la testosterona plasmática durante los primeros 7 días tras la aplicación de la primera dosis del análogo de GnRH. Se observa en el 6-10% de los casos y se manifiesta clínicamente en los pacientes como dolor óseo, obstrucción urinaria y, en los casos más graves (y menos frecuentes, afortunadamente), compresión medular, que puede llegar a producir paraplejia. Afortunadamente, la aparición del flare up puede paliarse o incluso evitarse con la administración de antiandrógenos desde 7 días antes de la aplicación del análogo de GnRH, por lo que es frecuente que el médico proceda a su prescripción.
La ciproterona (Androcur®) y el megestrol (Megefren® y Borea®) son utilizados precisamente para el tratamiento de los sofocos producidos por la supresión androgénica. Entre sus efectos secundarios pueden citarse pérdida de la libido y de la potencia sexual, ginecomastia y mastodinia (dolor mamario), cardiopatía isquémica y enfermedad tromboembólica y edema periférico.
La flutamida (EFG, Eulexin®, Grisetin®, Prostacur®) no se utiliza en monoterapia, sino en combinación con algún análogo de GnRH. Sus efectos adversos más frecuentes son ginecomastia, diarrea – que puede llegar a ser lo suficientemente grave como para interrumpir el tratamiento de algunos pacientes – y alteraciones de la función hepática. Por su parte, los efectos adversos más frecuentes la bicalutamida (EFG, Bicarbex®, Casodex®, Pencial®, Probic®) son mastodinia (dolor mamario), ginecomastia y diarrea, aunque esta última solo excepcionalmente alcanza una intensidad que obliga a suspender el tratamiento.
En cuanto a la abiraterona (Zytiga®), las reacciones adversas observadas con más frecuencia son hipopotasemia (que puede manifestar como calambres musculares), hipertensión y edema periférico. Los fármacos específicamente citotóxicos (docetaxel, cabazitaxel, mitoxantrona, capecitabina, etc.) suelen ser administrados en el ámbito hospitalario.
Finalmente, debería hacerse un especial esfuerzo en desacreditar las terapias “milagrosas”, que algunos individuos o empresas sin escrúpulos anuncian habitualmente a través de internet o incluso en medios de comunicación generalistas, porque manipulan emocionalmente – y desvalijan económicamente – a los pacientes y a sus familias, asegurando la consecución de unos resultados que en ningún caso van a conseguir realmente.
Bibliografía
