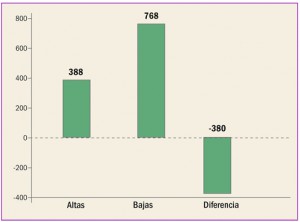
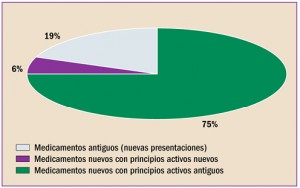
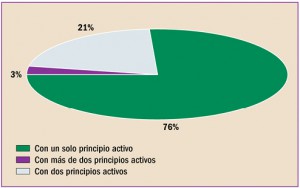
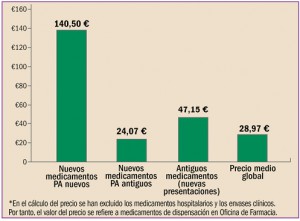
|
CAMBIOs DE PRECIO con cambio de CóDIGO NACIONAl |
|||
|
CN Nuevo |
PVPiva |
NOMBRE Y PRESENTACIÓN |
CN Antiguo |
|
700681 |
8,41 |
Antabus 250 mg 40 comprimidos |
914671 |
|
700680 |
14,3 |
Dolquine 200 mg 30 comprimidos |
685173 |
|
700683 |
16,64 |
Vinblastina 1 vial |
654104 |
|
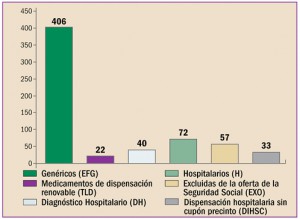
CAMBIO EN LAS CONDICIONES DE DISPENSACIÓN/OFERTA AL SNS (acumulado desde enero 2017) |
|
|
MEDICAMENTO |
ACTUAL |
|
960294 Apiretal niños 250 mg 5 supositorios |
Exclusión SNS. No facturable marzo 2017 |
|
745695 Bactil 10 mg 20 comprimidos |
Exclusión SNS. No facturable febrero 2017 |
|
914879 Bactil Forte 20 mg 20 comprimidos |
Exclusión SNS. No facturable febrero 2017 |
|
973487 Canesmycospor crema 20 g |
Exclusión SNS. No facturable diciembre 2017 |
|
664880 Coversoral 5 mg 30 comprimidos |
Exclusión SNS. No facturable diciembre 2017 |
|
664881 Coversoral 10 mg 30 comprimidos |
Exclusión SNS. No facturable diciembre 2017 |
|
868091 Efferalgan Vitamina C compr eferv |
Exclusión SNS. No facturable diciembre 2017 |
|
870253 Efferalgan Odis 500 mg 16 compr Bucodisp |
Exclusión SNS. No facturable diciembre 2017 |
|
651132 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
651135 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
651136 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
664292 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
664326 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
700627 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
700628 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
700629 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
700630 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
672546 Ibuprofeno (arginina) Ratiopharm 20 sobres |
Exclusión SNS. No facturable diciembre 2017 |
|
672547 Ibuprofeno (arginina) Ratiopharm 40 sobres |
Exclusión SNS. No facturable diciembre 2017 |
|
663060 Ibuprofeno (arginina) Teva 600mg 20sobre |
Exclusión SNS. No facturable diciembre 2017 |
|
663061 Ibuprofeno (arginina) Teva 600mg 40sobre |
Exclusión SNS. No facturable diciembre 2017 |
|
708258 Ibuprofeno Mabo Farma 600 mg 40 compr |
Exclusión SNS. No facturable abril 2018 |
|
701705 Junifen 20 mg/ml suspensión 200 ml |
Exclusión SNS. No facturable septiembre 2017 |
|
802140 Junifen 200 mg 24 comprimidos bucodisp |
Exclusión SNS. No facturable marzo 2018 |
|
701703 Junifen 20 mg/ml suspensión 100 ml |
Exclusión SNS. No facturable septiembre 2017 |
|
855429 Junipro 20 mg/ml 150 ml |
Exclusión SNS. No facturable febrero 2017 |
|
779314 Leuco Hubber 5 óvulos vaginales |
Exclusión SNS. No facturable enero 2018 |
|
654768 Lixacol 400 mg 100 comprimidos |
Exclusión SNS. No facturable julio 2017 |
|
688499 Locetar 50 mg/ml barniz uñas |
Exclusión SNS. No facturable septiembre 2017 |
|
677725 Menveo 1 vial |
Inclusión SNS septiembre 2017 |
|
690375 Nimenrix 1 vial |
Inclusión SNS septiembre 2017 |
|
729061 Nolotil 5 ampollas |
Exclusión SNS. No facturable julio 2017 |
|
691352 Nutrineal PD4 1.1% Aminoacidos |
Paso a Hospital. No facturable agosto 2017 |
|
691360 Nutrineal PD4 1.1% Aminoacidos |
Paso a Hospital. No facturable agosto 2017 |
|
691386 Nutrineal PD4 1.1% Aminoacidos |
Paso a Hospital. No facturable agosto 2017 |
|
700632 Nutrineal PD4 1.1% Aminoacidos |
Paso a Hospital. No facturable agosto 2017 |
|
650993 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
650996 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
650997 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
651295 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
691311 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
700631 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
700639 Oestraclin 0.6 mg gel 80 g |
Exclusión SNS. No facturable octubre 2017 |
|
705051 Omeprazol Abdrug 20 mg 28 cápsulas Fco |
Exclusión SNS. No facturable abril 2017 |
|
705050 Omeprazol Abdrug 20 mg 14 cápsulas Fco |
Exclusión SNS. No facturable abril 2017 |
|
705052 Omeprazol Abdrug 20 mg 14 capsulas Blis |
Exclusión SNS. No facturable abril 2017 |
|
705055 Omeprazol Abdrug 20 mg 28 cápsulas Blis |
Exclusión SNS. No facturable abril 2017 |
|
684906 Paracetamol Ratio 1 g 20 compr eferv |
Exclusión SNS. No facturable diciembre 2017 |
|
684907 Paracetamol Ratio 1 g 40 compr eferv |
Exclusión SNS. No facturable diciembre 2017 |
|
695673 Paracetamol Teva 1 g 40 compr eferv |
Exclusión SNS. No facturable diciembre 2017 |
|
684906 Paracetamol Teva 1 g 20 compr eferv |
Exclusión SNS. No facturable diciembre 2017 |
|
683193 Pentasa 1000 mg 7 envases rectales |
Exclusión SNS. No facturable abril 2017 |
|
650738 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
650741 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
650742 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
779462 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858696 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858811 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858829 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858852 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858878 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
872226 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
650732 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
650733 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
650734 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
779579 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858886 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858894 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858902 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858910 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858928 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858944 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
650735 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
650736 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
650737 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
779587 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
858951 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859249 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859298 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859447 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859470 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859404 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
651137 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
651138 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
651139 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
765230 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
765867 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
766352 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
766360 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
651140 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
651143 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
651144 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
766519 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
766576 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
766741 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
766774 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
651145 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
651146 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
651147Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
766782 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
766808 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
766972 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
767889 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
654443 Prevenar 13 1 jer prec |
Sin cupón precinto. No facturable enero 2017 |
|
654147 Romilar jarabe 200 ml |
Exclusión SNS. No facturable marzo 2018 |
|
819581 Romilar 15 mg 20 comprimidos |
Exclusión SNS. No facturable marzo 2018 |
|
823799 Silarine 80 mg 30 cápsulas |
Exclusión SNS. No facturable julio 2017. |
|
825554 Solu Moderin 40 mg 1 vial |
Exclusión SNS. No facturable marzo 2018 |
|
825562 Solu Moderin 40 mg 3 viales |
Exclusión SNS. No facturable marzo 2018 |
|
759936 Tracleer 125 mg 56 comprimidos |
Exclusión SNS. No financiado enero 2017 |
|
759928 Tracleer 62.55 mg 56 comprimidos |
Exclusión SNS. No financiado enero 2017 |
|
654252 Uromitexan 15 ampollas 2 ml |
Paso a Hospital. No facturable diciembre 2017 |
|
698670 Ursitan 3 mg/ml 20 monodosis |
Exclusión SNS. No facturable septiembre 2017 |
|
916478 Viaflex glucosa 20 % bolsa 250 ml |
Exclusión SNS. No facturable febrero 2018 |
|
916486 Viaflex glucosa 20 % bolsa 500 ml |
Exclusión SNS. No facturable febrero 2018 |
|
933093 Viaflex glucosa 20 % bolsa 1000 ml |
Exclusión SNS. No facturable febrero 2018 |
|
957209 Viaflex glucosa 50 % bolsa 250 ml |
Exclusión SNS. No facturable febrero 2018 |
|
957217 Viaflex glucosa 50 % bolsa 500 ml |
Exclusión SNS. No facturable febrero 2018 |
|
957225 Viaflex glucosa 50 % bolsa 1000 ml |
Exclusión SNS. No facturable febrero 2018 |
|
962019 Viaflex glucosa 70 % bolsa 250 ml |
Exclusión SNS. No facturable febrero 2018 |
|
962027 Viaflex glucosa 70 % bolsa 500 ml |
Exclusión SNS. No facturable febrero 2018 |
|
962035 Viaflex glucosa 70 % bolsa 1000 ml |
Exclusión SNS. No facturable febrero 2018 |
|
801605 Viaflo Hartman Ringer Lactada 500 ml |
Paso a Hospital. No facturable abril 2017 |
|
728709 Vincristina Pfizer 1 vial 2 ml |
Paso a Hospital. No facturable diciembre 2017 |
|
728279 Vincristina Pfizer 1 vial 1 ml |
Paso a Hospital. No facturable diciembre 2017 |
|
703582 Voltaren 1 mg/ml 10 unidosis |
Exclusión SNS. No facturable noviembre 2017 |
|
699686 Zavedos 5 mg 1 vial polvo |
Paso a Hospital. No facturable octubre 2017 |
|
699694 Zavedos 10 mg 1 vial polvo |
Paso a Hospital. No facturable octubre 2017 |
|
cambio DE NOMBRE (acumulado desde enero 2017) |
|
|
ACTUAL |
ANTERIOR |
|
Ácido Acetilsalicílico Tarbis (Tarbis) |
Ácido Acetilsalicílico Codramol (Farmalider) |
|
Ácido Alendrónico Semanal Bluepharma |
Ácido Alendrónico Semanal Onedose |
|
Äcido Ibandrónico Aurovitas Spain |
äcido Ibandrónico Actavis |
|
Adexyl |
Aripiprazol Mylan |
|
Anastrozol Aristo |
Anastrozol UR |
|
Aristine |
Famylette |
|
Atenolol Placasod |
Atenolol Sandoz |
|
Azitromicina Bluepharma |
Azitromicina Onedose |
|
Capecitabina Aurovitas Spain |
Capecitabina Actavis |
|
Celenib |
Celecoxib Qualigen |
|
Ciprofloxacino Bluepharma |
Ciprofloxacino Onedose |
|
Claritromicina Bluepharma |
Claritromicina Onedose |
|
Clopidogrel Viso Farmacéutica (Aurovitas) |
Clopidogrel Pharmathen (Glenmark) |
|
Dorzolamida/Timolol Aurovitas |
Dorzolamida/Timolol Actavis |
|
Epirubicina Aurovitas |
Apirubicina Actavis |
|
Escitalopram VIR Pharma |
Escilan |
|
Fosinopril Aurovitas Spain |
Fosinopril Actavis |
|
Gemfibrozilo Tarbis |
Gemfibrozilo Ur (Germed) |
|
Ibuprofeno Bluepharma |
Ibuprofeno Onedose |
|
Irbesartan/Hidroclorotiazida Aristo |
Irbesartan/Hidroclorotiazida Edigen |
|
Levetirazetam Exeltis (Exeltis) |
Levetirazetam Juste (Juste) |
|
Levodopa/Carbidopa/Entacapona Kern Pharma |
Levodopa/Carbidopa/Entacapona Gadur (Vegal) |
|
Levofloxacino Bluepharma |
Levofloxacino Onedose |
|
Memantina Aurovitas Spain |
Memantina Actavis |
|
Micofenolato de mofetilo Aurovitas |
Micofenolato de mofetilo Actavis |
|
Miflodine Breezhaler |
Miflodine |
|
Montelukast Aurovitas Spain |
Montelukast Actavis |
|
Nabila (Exeltis Helathcare) |
Memantina Juste |
|
Olmesartan Tecnigen |
Olmesartan Premium Pharma |
|
Olmesartan/Hidroclorotiazida Combix |
Olmesartan/Hidroclorotiazida Ric |
|
Omeprazol Bluepharma |
Omeprazol Onedose |
|
Pantoprazol Bluepharma |
Pantoprazol Onedose |
|
Paracetamol Bluepharma |
Paracetamol Onedose |
|
Paracetamol Aristo |
Paracetamol Unither |
|
Risperidona Flas Mylan |
Rispemylan |
|
Tramadol/Paracetamol Aurovitas |
Tramadol/Paracetamol Actavis |
|
Rupatadina Kern Pharma (Kern Plarma) |
Rupatadina Binomil (Uriach) |
|
Sumapriptan Bluepharma |
Sumatriptan Onedose |
|
Tramadol/Paracetamol Bluepharma |
Tramadol/Paracetamol Onedose |
|
Venlafaxina Bluepharma |
Venlafaxina Onedose |
|
Virelbina Aurovitas |
Vinorelbina Actavis |