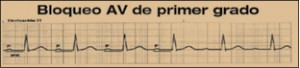
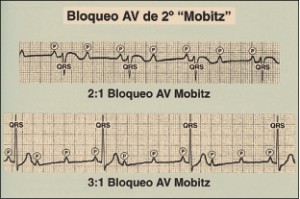
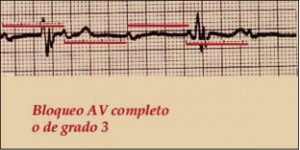
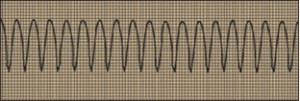
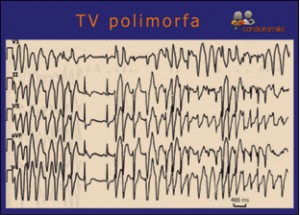
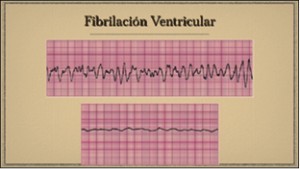
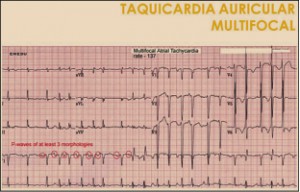
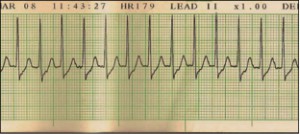
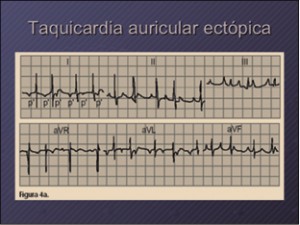
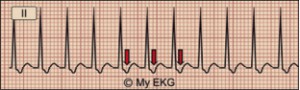
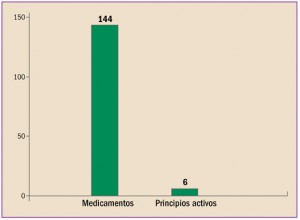
NUEVOS MEDICAMENTOS Y PRINCIPIOS ACTIVOS
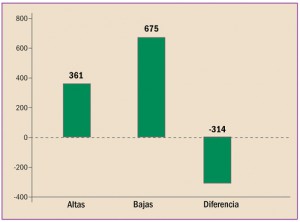
ALTAS Y BAJAS DE PRESENTACIONES COMERCIALES
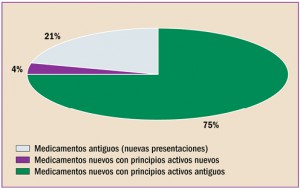
NUEVAS PRESENTACIONES COMERCIALES DE MEDICAMENTOS
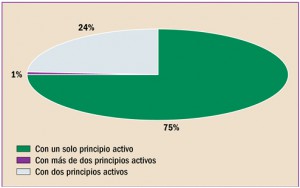
COMPOSICIÓN CUANTITATIVA DE LOS NUEVOS MEDICAMENTOS
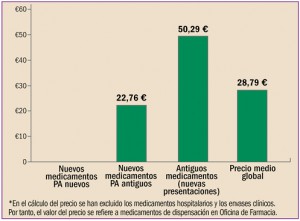
PRECIO MEDIO DE LAS NUEVAS PRESENTACIONES
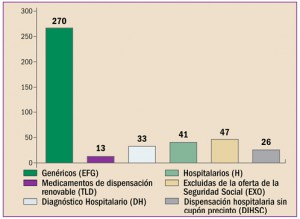
Presentaciones con características especiales