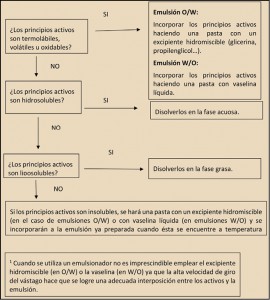
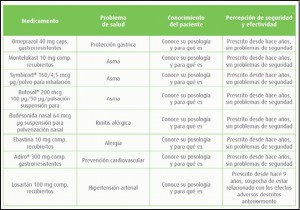
Diabetes mellitus
Retinopatía e hiperlipidemia
El control deficiente de los niveles sanguíneos de lípidos se confirma como un factor de riesgo para la incidencia y la progresión de la retinopatía diabética. Los niveles anormales de todos los tipos de lípidos se asocian con el riesgo de edema macular y la progresión hacia la retinopatía proliferativa.
La diabetes mellitus, en su evolución, afecta a diferentes órganos, entre ellos los ojos. La microangiopatía diabética afecta de manera precoz y específica a la retina. La aparición de la retinopatía está directamente relacionada con el tiempo de evolución de la enfermedad y del control metabólico. La microangiopatía diabética en la retina muestra alteraciones específicas como son los microaneurismas, los exudados duros o blandos, las microhemorragias intrarretinianas, dilataciones venosas arrosariadas y anomalías microvasculares intrarretinianas. Todas estas alteraciones causan el cierre capilar con la consiguiente isquemia o extravasación del contenido intravascular al estroma provocando edema.
Hay estudios que han mostrado que el control de la hipertensión arterial y la hiperlipemia reducen el reducen el riesgo de aparición y progresión del edema macular. Con el fin de determinar específicamente la influencia del control de los niveles séricos de los lípidos sobre la incidencia y progresión de la retinopatía diabética y el edema macular diabético en pacientes con diabetes tipo 2, se ha llevado a cabo un estudio observacional longitudinal basado en la población en un entorno hospitalario, incluyendo a un total de 890 sujetos.
Los resultados mostraron que un inadecuado control del colesterol total fue asoció claramente con la incidencia de retinopatía potencialmente amenazadora de la vista (OR = 7,2; IC95% 1,5 a 34,3; p = 0,012) y edema macular (OR = 5,5; IC95% 1,4 a 27,4; p = 0,037) después de ajustar los posibles factores de confusión. Adicionalmente, un mal control de los niveles séricos de triglicéridos se asoció con la progresión a la retinopatía diabética proliferativa (PDR) (OR = 3,2; IC95% 1,1 a 10,5; p = 0,048). El riesgo de edema macular incidente (p = 0,041) y de progresión a retinopatía diabética proliferativa (p = 0,028) también fue mayor cuando todos los tipos de lípidos fueron anormales.