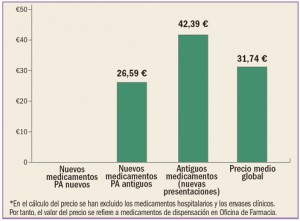
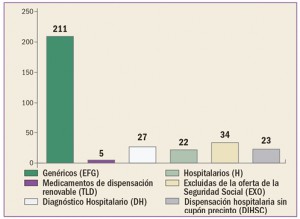
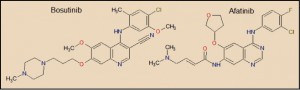
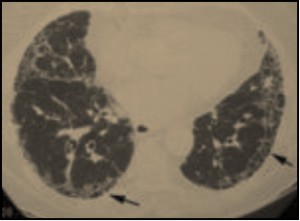
|
CAMBIO DE PRECIO Y CóDIGO NACIONAl |
|||
|
CN Nuevo |
PVPiva |
NOMBRE Y PRESENTACIÓN |
CN Antiguo |
|
700671 |
4.4 |
Lomper 20 mg/ml suspensión 30 ml |
654270 |
|
700672 |
3.75 |
Sueroroal Casen 5 sobres |
818211 |
|
700673 |
3.11 |
Sueroral Hiposódico 5 sobres |
803692 |
|
CAMBIO EN LAS CONDICIONES DE DISPENSACIÓN/OFERTA AL SNS (Acumulado desde enero 2017) |
|
|
MEDICAMENTO |
ACTUAL |
|
960294 Apiretal niños 250 mg 5 supositorios |
Exclusión SNS. No facturable marzo 2017 |
|
745695 Bactil 10 mg 20 comprimidos |
Exclusión SNS. No facturable febrero 2017 |
|
914879 Bactil Forte 20 mg 20 comprimidos |
Exclusión SNS. No facturable febrero 2017 |
|
651132 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
651135 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
651136 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
664292 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
664326 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
700627 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
700628 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
700629 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
700630 Extraneal Icodextrina 7.5 % |
Paso a Hospital. No facturable agosto 2017 |
|
701705 Junifen 20 mg/ml suspensión 200 ml |
Exclusión SNS. No facturable septiembre 2017 |
|
701703 Junifen 20 mg/ml suspensión 100 ml |
Exclusión SNS. No facturable septiembre 2017 |
|
855429 Junipro 20 mg/ml 150 ml |
Exclusión SNS. No facturable febrero 2017 |
|
654768 Lixacol 400 mg 100 comprimidos |
Exclusión SNS. No facturable julio 2017 |
|
688499 Locetar 50 mg/ml barniz uñas |
Exclusión SNS. No facturable septiembre 2017 |
|
729061 Nolotil 5 ampollas |
Exclusión SNS. No facturable julio 2017 |
|
691352 Nutrineal PD4 1.1% Aminoacidos |
Paso a Hospital. No facturable agosto 2017 |
|
691360 Nutrineal PD4 1.1% Aminoacidos |
Paso a Hospital. No facturable agosto 2017 |
|
691386 Nutrineal PD4 1.1% Aminoacidos |
Paso a Hospital. No facturable agosto 2017 |
|
700632 Nutrineal PD4 1.1% Aminoacidos |
Paso a Hospital. No facturable agosto 2017 |
|
650993 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
650996 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
650997 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
651295 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
691311 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
700631 Nutrineal PD4 1.1% Aminoacidos con S/D |
Paso a Hospital. No facturable agosto 2017 |
|
700639 Oestraclin 0.6 mg gel 80 g |
Exclusión SNS. No facturable octubre 2017 |
|
705051 Omeprazol Abdrug 20 mg 28 cápsulas Fco |
Exclusión SNS. No facturable abril 2017 |
|
705050 Omeprazol Abdrug 20 mg 14 cápsulas Fco |
Exclusión SNS. No facturable abril 2017 |
|
705052 Omeprazol Abdrug 20 mg 14 capsulas Blis |
Exclusión SNS. No facturable abril 2017 |
|
705055 Omeprazol Abdrug 20 mg 28 cápsulas Blis |
Exclusión SNS. No facturable abril 2017 |
|
683193 Pentasa 1000 mg 7 envases rectales |
Exclusión SNS. No facturable abril 2017 |
|
650738 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
650741 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
650742 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
779462 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858696 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858811 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858829 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858852 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
858878 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
872226 Physioneal 40 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
650732 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
650733 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
650734 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
779579 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858886 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858894 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858902 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858910 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858928 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
858944 Physioneal 40 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
650735 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
650736 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
650737 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
779587 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
858951 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859249 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859298 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859447 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859470 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
859404 Physioneal 40 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
651137 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
651138 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
651139 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
765230 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
765867 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
766352 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
766360 Physioneal 35 glucosa 1.36% |
Paso a Hospital. No facturable agosto 2017 |
|
651140 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
651143 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
651144 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
766519 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
766576 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
766741 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
766774 Physioneal 35 glucosa 2.27% |
Paso a Hospital. No facturable agosto 2017 |
|
651145 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
651146 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
651147Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
766782 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
766808 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
766972 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
766972 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
767889 Physioneal 35 glucosa 3.86% |
Paso a Hospital. No facturable agosto 2017 |
|
654443 Prevenar 13 1 jer prec |
Sin cupón precinto. No facturable enero 2017 |
|
823799 Silarine 80 mg 30 cápsulas |
Exclusión SNS. No facturable julio 2017. |
|
759936 Tracleer 125 mg 56 comprimidos |
Exclusión SNS. No financiado enero 2017 |
|
759928 Tracleer 62.55 mg 56 comprimidos |
Exclusión SNS. No financiado enero 2017 |
|
698670 Ursitan 3 mg/ml 20 monodosis |
Exclusión SNS. No facturable septiembre 2017 |
|
801605 Viaflo Hartman Ringer Lactada 500 ml |
Paso a Hospital. No facturable abril 2017 |
|
703582 Voltaren 1 mg/ml 10 unidosis |
Exclusión SNS. No facturable noviembre 2017 |
|
cambio DE NOMBRE (Acumulado desde enero 2017) |
|
|
ACTUAL |
ANTERIOR |
|
Aristine |
Famylette |
|
Atenolol Placasod |
Atenolol Sandoz |
|
Clopidogrel Viso Farmacéutica (Aurovitas) |
Clopidogrel Pharmathen (Glenmark) |
|
Dorzolamida/Timolol Aurovitas |
Dorzolamida/Timolol Actavis |
|
Fosinopril Aurovitas Spain |
Fosinopril Actavis |
|
Memantina Aurovitas Spain |
Memantina Actavis |
|
Micofenolato de mofetilo Aurovitas |
Micofenolato de mofetilo Actavis |
|
Montelukast Aurovitas Spain |
Montelukast Actavis |
|
Rupatadina Kern Pharma (Kern Plarma) |
Rupatadina Binomil (Uriach) |
|
Virelbina Aurovitas |
Vinorelbina Actavis |