|
EVENTO |
FECHA |
INFORMACIÓN |
LOCALIDAD |
DIRECCIÓN TELEMÁTICA |
|
INFARMA |
21-23 de marzo de 2017 |
Barcelona |
http://www.portalferias.com/infarma-2017-barcelona_31180.htm |
|
|
2ND EUROPEAN CONFERENCE ON PHARMACEUTICS “NOVEL DOSAGE FORMS, INNOVATIVE TECHNOLOGIES” |
2-4 de abril de 2017 |
Cracovia Polonia |
||
|
37 SYMPOSIUM DE LA ASOCIACIÓN ESPAÑOLA DE FARMACÉUTICOS DE LA INDUSTRIA (AEFI) |
7-8 de mayo de 2017 |
AEFI |
L’Hospitalet de Llobregat Barcelona |
|
|
6TH FIP PHARMACEUTICAL SCIENCES WORLD CONGRESS |
21-24 de mayo de 2017 |
FIP |
Estocolmo Suecia |
|
|
4-6 de julio de 2017 |
Instituto de Farmacia y Alimentos de la Universidad de La Habana |
La Habana Cuba |
||
|
CONGRESO LATINOAMERICANO DE FARMACIA Y BIOQUÍMICA INDUSTRIAL BUENOS AIRES 2017 |
8-11 de agosto de 2017 |
EXPOFYBI |
Buenos Aires Argentina |
|
|
77TH FIP WORLD CONGRESS OF PHARMACY AND PHARMACEUTICAL SCIENCES |
10-14 de septiembre de 2017 |
FIP |
Seúl Corea |
http://www.fip.org/seoul2017/FIP_2ndAnnouncement_Seoul_WEB.pdf |
|
21ST INTERNATIONAL SYMPOSIUM ON MICROENCAPSULATION “GREAT ACHIEVEMENTS THAT INSPIRE NEW CHALLENGES” |
27-29 de septiembre de 2017 |
International Microencapsulation Society |
Faro Portugal |
|
|
CPHI WORLDWIDE 2017 FRANKFURT: FERIA INTERNACIONAL DE INGREDIENTES FARMACÉUTICOS |
24-26 de octubre de 1017 |
Frankfurt, Alemania |
Archive
Revista PAM: 401
Número 401, Marzo 2017
Farmacología de los antifúngicos
Algunos hongos son capaces de invadir tejidos ocasionando lo que denominamos micosis.
Debido al aumento de los pacientes inmunodeprimidos, con procesos cancerosos o sometidos a trasplantes de médula ósea y de órganos sólidos, la epidemia de sida y la utilización de antimicrobianos de amplio espectro y de fármacos que alteran los mecanismos naturales de defensa, se ha producido un cambio en el perfil de la patología producida por los hongos. Esta circunstancia ha encontrado respuesta en el desarrollo de los modernos antifúngicos, con espectros más amplios y una mayor selectividad y margen de seguridad, amén de la disponibilidad de nuevas formulaciones galénicas que reducen los efectos secundarios de los antifúngicos utilizados desde hace décadas, como es el caso de la anfotericina.
Los antifúngicos pueden ejercer su acción actuando a diferentes niveles sobre la célula fúngica:
- Sobre la pared celular, impidiendo su síntesis.
- Sobre la membrana, alterando su permeabilidad o impidiendo su síntesis, o la de componentes esenciales como el ergosterol.
- Sobre los mecanismos implicados en la división celular.
La mayoría de los antifúngicos actúan sobre la síntesis de la membrana celular, puesto que en ella estriban gran parte de las diferencias que existen entre las células fúngicas y las de los mamíferos. Quizá la más relevante sea la presencia en la membrana del hongo de ergosterol en vez de colesterol. Los antifúngicos que actúan sobre la membrana celular son los compuestos azólicos, los polienos, las alilaminas y las morfolinas (amorolfina).
Otro elemento diferencial de los hongos es la disposición sobre la membrana citoplasmática de la pared celular, ausente en las células de los mamíferos. Está constituida por proteínas y polisacáridos, fundamentalmente quitina, glucanos y mananos. Además, la membrana citoplasmática puede tener residuos de cisteína, lípidos fosforilados y nitrogenados. Cada uno de estos componentes es una diana potencial para la actuación de los agentes antifúngicos. Un ejemplo de antifúngicos que interfieren la síntesis de la pared fúngica son las equinocandinas que inhiben la β-1,3-glucano sintasa, situada en la membrana plasmática.
Entre los antifúngicos que actúan alterando la división celular encontramos, por ejemplo, el ciclopirox, que da lugar a una depleción de electrolitos celulares que conduce a una reducción de la síntesis de ácidos nucleicos y proteínas.
- Antifúngicos azólicos: Se dividen en dos grupos, imidazólicos y triazólicos. Los derivados imidazólicos se emplean exclusivamente de forma tópica en dermatomicosis y/o candidiasis vulvovaginal. Están indicados en casos de tinea corporis, tinea pedis, tinea cruris y otras dermatofitosis. Cuando la infección afecta al pelo suele ser necesario recurrir al tratamiento sistémico. También están indicados en candidiasis cutáneas y mucosas (excepto en pacientes inmunodeprimidos), pitiriasis versicolor y dermatitis seborreica. La mayoría son también activos frente a Trichomonas. Los derivados triazólicos se emplean en el tratamiento de micosis sistémicas.
- El mecanismo de acción de los derivados azólicos consiste en la inhibición de la síntesis de ergosterol por bloqueo de la enzima lanosterol desmetilasa mediante la unión del fármaco con el grupo hemo del citocromo P450. La formación de un complejo entre el derivado azólico y el citocromo, impide el proceso oxidativo inicial del lanosterol. Con ello se inhibe la síntesis del ergosterol y se acumula lanosterol, que facilita la construcción defectuosa de la membrana fúngica. Algunos derivados azólicos parece que son capaces de bloquear a otras enzimas de la cadena biosintética del ergosterol, provocando la acumulación de metabolitos intermediarios que pueden colaborar en la desestabilización de la membrana citoplasmática.
- Los mecanismos de resistencia adquirida no afectan por igual a todos los derivados azólicos, y en algunos casos es posible encontrar más de un mecanismo de resistencia en la misma cepa. Los principales son:
- Menor acumulación del compuesto azólico por alteración de la entrada en la célula o por mecanismos de expulsión.
- Mutaciones del gen ER11, que codifica la enzima 14-α-desmetilasa
- Hiperproducción de la diana enzimática (14-α-desmetilasa).
- Incremento en la actividad del citocromo P450.
- La mayoría de las interacciones relevantes de los antifúngicos azólicos están relacionadas con su capacidad de inhibir el citocromo P450. Todos inhiben la isoenzima CYP3A4. Fluconazol y voriconazol inhiben, además, la isoenzima CYP2C9, mientras que el isavuconazol inhibe la CYP3A4 y la CYP3A5, lo que va a condicionar la interacción o no con otros medicamentos dependiendo de si son sustratos de una u otra isoenzima.
- Las reacciones adversas más comunes de fluconazol e itraconazol son fundamentalmente de tipo gastrointestinal. También son frecuentes las dermatológicas y hepáticas. El daño hepático es mayor con ketoconazol, por lo que la EMA consideró, en 2013, suspender su administración sistémica.
- El tratamiento con itraconazol debe ser suspendido en el caso de aparición de algún episodio de cefalea intenso o signos de insuficiencia cardiaca.
- Si aparece toxicidad hematológica intensa, exantema o elevaciones marcadas en las pruebas analíticas funcionales hepáticas, deberá suspenderse el tratamiento con fluconazol.
- Las reacciones adversas más frecuentes con voriconazol son alteraciones de la visión, fiebre, erupción cutánea, vómitos, náuseas, diarrea, cefalea, edema periférico y dolor abdominal.
- Para posaconazol se describen náuseas y cefalea como acontecimientos adversos más frecuentes.
- La incidencia de efectos adversos de los antifúngicos imidazólicos es escasa, y no suelen presentar problemas en el caso de la administración tópica.
- Alilaminas: Actualmente la terbinafina es el único compuesto de este grupo comercializado en España, estando disponible tanto para uso tópico como sistémico.
- Tras su absorción oral se concentra en el estrato córneo lipofílico. También se excreta en la grasa, alcanzándose concentraciones elevadas en los folículos pilosos, pelo y pieles ricas en grasa. Se metaboliza rápida y extensamente por un mínimo de siete isoenzimas CYP y los metabolitos carecen de actividad antifúngica. Se excreta fundamentalmente con la orina.
- Administrada de forma tópica, tiende a ligarse o a ser absorbida por los componentes lipídicos del estrato córneo, lo que puede influir en la larga semivida de eliminación del fármaco de dicho estrato.
- En cuanto a su farmacocinética, tras su absorción oral, la terbinafina difunde rápidamente a través de la dermis y se concentra en el estrato córneo lipofílico. También se excreta en la grasa. Se metaboliza rápida y extensamente por un mínimo de siete isoenzimas CYP y los metabolitos carecen de actividad antifúngica. Se excreta fundamentalmente con la orina y la vida media de eliminación es de 17 horas. Administrada de forma tópica, tiende a ligarse o a ser absorbida por los componentes lipídicos del estrato córneo, lo que puede influir en la larga semivida de eliminación del fármaco de dicho estrato donde permanece hasta 13 días.
- Las reacciones adversas más frecuentes (1-10%) con terbinafina sistémica son cefalea, distensión abdominal, dispepsia, náuseas y dolor osteomuscular. Su biodisponibilidad sistémica en la administración tópica es muy baja, por lo que sus efectos adversos son leves y transitorios, localizados en el lugar de aplicación, apareciendo raramente reacciones alérgicas.
- Morfolinas: La amorolfina es un antifúngico tópico con acción fungicida. Se emplea en crema o barniz de uñas para tratar la onicomicosis.
- Antifúngicos poliénicos: La nistatina y la anfotericina son los dos fármacos representantes de este grupo. La anfotericina se utiliza por vía sistémica (iv), mientras que la nistatina sólo se emplea en formulaciones tópicas y está cayendo en desuso clínico.
- La farmacocinética de la formulación básica de anfotericina B (anfotericina desoxicolato) indica que el fármaco circulante en plasma se une en un 90% a las proteínas plasmáticas y se dializa escasamente. Se excreta muy lentamente por los riñones, eliminándose por esta vía un 2-5% de la dosis administrada en la forma biológicamente activa. La excreción biliar es una vía importante de eliminación. Su t1/2 es de 15 días. La introducción de nuevas formulaciones ha permitido reducir sus efectos nefrotóxicos e incrementar su actividad al mejorar el acceso a la pared del hongo.
- Con la formulación en dispersión coloidal (Amphocil®) se consiguió una mejor distribución del fármaco en el organismo, así como menor toxicidad. La t1/2 es más larga debido a la acumulación de anfotericina B en el hígado y a su lenta liberación posterior.
- Con la formulación liposomal (Ambisome®), las Cmáx fueron entre seis y diez veces superiores a las obtenidas con anfotericina B convencional. El aclaramiento total orgánico es menor y su t1/2 es de 26 horas.
- La formulación lipídica de anfotericina B (Abelcet®) se distribuye rápidamente por los tejidos tras su administración y alcanza concentraciones tisulares mayores que la anfotericina convencional, excepto en el riñón.
- En cuanto a las reacciones adversas de anfotericina B las más comunes son la aparición de fiebre y escalofríos, anorexia, náuseas y los vómitos, que tienden a desaparecer con el tiempo. La infusión se asocia frecuentemente con flebitis/tromboflebitis, y la extravasación puede provocar necrosis tisular. El efecto adverso más relevante de la anfotericina es la nefrotoxicidad, que justifica la indicación de formulaciones lipídicas, menos tóxicas a este nivel. En general, los efectos de la anfotericina son frecuentes e importantes y algunos pueden evitarse con la administración de analgésicos, heparina, antihistamínicos y/o antieméticos, y su incidencia puede reducirse administrándolos cada 2 días.
- Equinocandinas: Este grupo, constituido por la caspofungina (Cancidas®), anidulafungina (Ecalta®) y micafungina (Mycamine®), es el de elección en la candidiasis invasora en el paciente crítico. El uso de anidulafungina está autorizado únicamente en adultos, mientras que caspofungina y micafungina están autorizadas también para uso pediátrico.
- Actúan inhibiendo selectiva e irreversiblemente la enzima 1,3-β-D-glucano sintasa, indispensable para la síntesis del 1,3-β-D-glucano que provee de estabilidad osmótica a la pared celular, y su presencia es determinante para el crecimiento y la división celular.
- Las equinocandinas ejercen un efecto fungicida que es activo sobre diversas especies de Aspergillus y Candida, incluyendo cepas resistentes a anfotericina y fluconazol. También han demostrado cierta actividad frente a Pneumocystis jirovecii. La aparición de cepas resistentes se relaciona con la mutación de genes codificadores de la 1,3-β-D-glucano sintasa. Actualmente, se considera que las equinocandinas son al menos tan eficaces como los antifúngicos triazólicos en la profilaxis y el tratamiento de las micosis sistémicas, pero con una incidencia notablemente inferior de efectos adversos.
- Las interacciones de las equinocandinas se producen principalmente con fármacos administrados a pacientes inmunodeprimidos. Caspofungina puede inducir el metabolismo de la ciclosporina o del tacrolimús y ciclosporina puede dificultar la absorción de caspofungina por el hígado. La anidulafungina no es sustrato del citocromo P450, por lo que no parece probable que pudiera presentar interacciones a este nivel. Sin embargo, la administración conjunta con ciclosporina podría dar lugar a una disminución de los niveles del antifúngico. En estudios en voluntarios sanos, no se han detectado interacciones entre la micafungina y fármacos inmunomoduladores o con otros antifúngicos aunque debe vigilarse la toxicidad en la administración concomitante con itraconazol, sirolimús y nifedipino.
- En general, las equinocandinas son fármacos bien tolerados. Las reacciones adversas más frecuentes son fiebre y escalofríos, cefalea, náuseas/vómitos, diarrea o erupción cutánea, y con menor frecuencia puede observarse hipotensión, taquicardia, flebitis/tromboflebitis y reacciones exantemáticas. También pueden observarse alteraciones en parámetros analíticos (incremento en los valores de transaminasas, de fosfatasa alcalina y bilirrubina, hipopotasemia y leucopenia). Con caspofungina se ha observado además aumento de los niveles de creatinina, disminución del hematrocrito y trombocitopenia. Estas reacciones rara vez son graves.
- Ciclopirox: El ciclopirox es un antifúngico de uso tópico y de acción fungistática. Actúa provocando una depleción de electrolitos celulares fúngicos, que conduce a la reducción de la síntesis de ácidos nucleicos y proteínas.
Sus efectos adversos son, en general, leves y transitorios, siendo los más característicos la sensación de irritación local, sensación de quemazón y picor. Raramente pueden aparecer alteraciones alérgicas/dermatológicas o neurológicas. Debe suspenderse inmediatamente el tratamiento en caso de cefalea intensa, irritación y/o hipersensibilidad.
|
INFORMACIÓN DE INTERÉS |
||
|
Información e inscripciones (Centro de atención telefónica) |
||
|
cac@redfarma.org |
902 460 902 / |
L-J: 9:00-14:00 / 16:00-17:30 h / V: 9:00-14:30
|
|
Línea Directa del PNFC(1): |
||
|
pnfc@redfarma.org / tutoriafc@redfarma.org |
91 432 81 02 |
9:00 a 14:30 h, de lunes a viernes |
|
Secretaría Técnica Administrativa(2): |
||
|
secretariatecnicacgcof@redfarma.org |
91 432 41 00 / |
L-J: 9:00-14:00 / 16:00-17:30 h / V: 9:00-14:30
|
(1) Consultas sobre contenidos técnico-científicos.
(2) Consultas sobre corrección de exámenes y certificados.
|
Direcciones DE INTERÉS |
|
|
Cuestionarios / Sugerencias |
CGCOF / PNFC: C/ Villanueva, 11, 7.º – 28001 Madrid |
|
Sección de Formación en Portalfarma |
http://www.portalfarma.com/inicio/formacioncontinuada |
|
Plataforma de formación on line |
http://formacion.portalfarma.com |
|
CURSOS |
|||
|
CALENDARIO PREVISTO DEL PLAN NACIONAL DE FORMACIÓN CONTINUADA CONSEJO GENERAL DE COLEGIOS OFICIALES DE FARMACÉUTICOS |
|||
|
Curso |
Plazos de |
Inicio |
Cierre |
|
Trastornos infecciosos y parasitarios (2ª ed.) |
Cerrado |
13/3/17 |
18/9/17 |
|
Trastornos oncológicos |
Hasta 17/5/17 |
24/5/17 |
23/11/17 |
|
Buenas Prácticas de Distribución de Medicamentos y Principios Activos (3ª ed.) |
Hasta 17/4/17 |
24/4/17 |
19/6/17 |
|
Farmacia Asistencial a Pacientes con Diabetes tipo 2 y síndrome metabólico (2ª ed.) |
Cerrado |
13/3/17 |
10/5/17 |
|
Farmacia Asistencial y Salud Ocular |
Hasta 17/4/2017 |
24/4/17 |
26/6/17 |
|
ACREDITACIÓN DE LOS CURSOS DEL PLAN NACIONAL DE FORMACIÓN CONTINUADA |
Créditos asignados (*) |
|
Trastornos infecciosos y parasitarios |
12,5 |
|
Buenas Prácticas de Distribución de Medicamentos y Principios Activos (3ª Ed) |
Pendiente |
|
Farmacia Asistencial a Pacientes con Diabetes tipo 2 y síndrome metabólico |
Pendiente |
|
Trastornos oncológicos |
Pendiente |
|
Farmacia Asistencial y Salud Ocular |
Pendiente |
(*) Acreditados por la Comisión de Formación Continuada de las Profesiones Sanitarias de la Comunidad de Madrid.
Plantas medicinales con actividad expectorante: hojas de hiedra
Resumen
Este artículo y los siguientes estarán dedicados a la descripción de las principales plantas medicinales con actividad expectorante, ampliamente utilizadas en el tratamiento de afecciones del árbol respiratorio. Hay que tener en cuenta que muchas especies vegetales no tienen solo esta actividad si no que pueden ser además antitusígenas, antisépticas, antiasmáticas, etc. Este primer artículo se dedica a la hiedra.
Según la Real Academia de la Lengua Española, expectorante es cualquier sustancia o medicamento capaz de hacer expectorar (del latín expectorāre; de ex- ‘fuera de’ y pectus, –ŏris ‘pecho’), acción consistente en “arrancar y arrojar por la boca las flemas y secreciones que se depositan en la faringe, la laringe, la tráquea o los bronquios”, como consecuencia de diferentes estados patológicos o estados irritativos.
En condiciones normales las células submucosas y calciformes de las vías respiratorias producen moco cuya función es lubricar y mantener húmedo el epitelio de las vías aéreas, así como contribuir a la eliminación de partículas extrañas que acceden a través de la respiración. Este moco está constituido por mucinas, péptidos glicosilados de elevado peso molecular que una vez excretados por las células calciformes se hidratan incrementando considerablemente su volumen (600 veces).
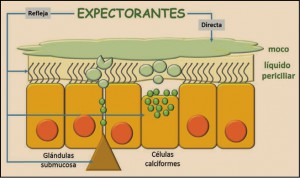
Figura 1. Mecanismo de acción expectorante (modificado de Pérez et al., 2014).
La estructura ciliar del epitelio respiratorio, a través del batido ciliar, promueve la propulsión del moco flotante hacia el exterior, para lo cual es necesario que exista un fino equilibrio entre el volumen y composición del moco situado en forma de capa en la luz de la vía área y el volumen de líquido periciliar, capa acuosa de baja resistencia donde se baten los cilios, sobre la que se dispone la capa de moco. El conjunto constituido por el moco y la capa de líquido periciliar constituye la capa de líquido superficial de la vía aérea.
Procesos irritativos o inflamatorios ya sean de tipo agudo (debidos a sustancias irritantes, alergias o infecciones de vías respiratorias) o de tipo crónico (enfisema, tuberculosis, bronquiectasia, cáncer), inducen un incremento excesivo en la producción de moco provocando su acumulación y el incremento de su viscosidad y, por ello, dificultando su eliminación normal lo que facilita la colonización bacteriana. Este proceso conduce a la obstrucción de las vías aéreas impidiendo la respiración normal y generando tos productiva.
En estas ocasiones se hace necesario recurrir a sustancias mucoactivas capaces de fluidificar el moco acumulado disminuyendo su viscosidad (mucolíticos); incrementar el volumen secretado y favorecer su hidratación (expectorantes); acelerar los movimientos ciliares, facilitando la expulsión de las flemas hacia la faringe y por ello su expulsión por la boca o reduciendo la adherencia (mucocinéticos); y de disminuir la hipersecreción de moco (antiinflamatorios y broncodilatadores anticolinérgicos). No obstante, los mecanismos de acción de estos fármacos no están perfectamente clarificados.
Los expectorantes naturales facilitan la eliminación del moco por vía directa al incrementar su volumen e hidratación y por ello su fluidez; y por vía refleja debido a sus propiedades irritantes que activan el movimiento ciliar y promueven una tos productiva de mayor eficiencia.
No obstante, junto a la recomendación de la toma de preparados con acción expectorante ya sean de origen natural o de síntesis, conviene recomendar la aplicación de medidas higiénicas como por ejemplo la ingestión de gran cantidad de líquidos que favorezca también la hidratación del moco, evitar cambios bruscos de temperatura para prevenir procesos infecciosos o no utilizar antitusígenos que eliminarían la tos productiva.
HIEDRA
Las hiedras, pertenecientes al género Helix de la familia Araliaceae, son plantas trepadoras, vigorosas, perennes, leñosas, que pueden alcanzar los 30 m de longitud. Se encuentran por lo general en lugares de ambiente húmedo, en zonas boscosas, en barrancos, sobre troncos de árboles, rocas o muros y en ocasiones tapizando el suelo. La hiedra común (Hedera helix L.) es originaria de Europa, África del norte y Asia, pero está distribuida en diferentes partes del mundo. Ha formado parte de la iconografía vegetal a lo largo de los siglos (griegos, romanos, etc.). En el Cristianismo se consideró símbolo de la inmortalidad y regeneración del alma.
En la Península Ibérica se encuentran dos especies originarias de Marruecos (Hedera maroccana McAllister) y de Argelia (H. algeriensis Hibberd) que son ampliamente utilizadas con fines ornamentales. En algunas zonas es considerada especie invasiva.
Se han descrito 14 taxones diferentes, no obstante, debido a la escasez de elementos diagnósticos y a la gran variabilidad inter- e intraespecífica, en zonas geográficas de contacto aparecen individuos con características intermedias. Parece ser que la especie que se emplea como fuente de la droga, Hedera helix, se subdivide en tres variedades botánicas: var. baltica, var. helix y var. hibernica.
Flora Ibérica incluye: Hedera helix L. con dos subespecies H. helix subsp. helix L. y Hedera helix subsp. rhizomatifera McAllister; Hedera hibernica (G. Kirchn.) Bean; y Hedera maderensis con una subespecie H. maderensis subsp. iberica McAllister.
La Real Farmacopea Española (5ªed.) define la hiedra como las “hojas desecadas, enteras o cortadas, de Hedera helix L., recolectadas en primavera” indicando que debe contener al menos un “3,0 por ciento de hederacósido C (C59H96O26; Mr 1221)” respecto a la droga desecada.
Las hiedras por lo general poseen tallos ramificados, a veces rizomatosos, con dos tipos de ramas: estériles y fértiles. Las ramas jóvenes estériles son las encargadas de la función trepadora para lo cual disponen de raíces adventicias. Las fértiles o ramas adultas se encargan de cubrir la superficie escalada.

En la mayoría de los taxones se observa un indumento de densidad variable dependiendo de la especie, tipo de rama y edad de la planta. Son abundantes en ramas estériles y caedizos en ramas fértiles adultas. Se trata de tricomas pluricelulares, estrellados (multidireccionales), en ocasiones soldados en la base y coloreados.
Atendiendo a la descripción incluida en Flora Ibérica, la especie oficinal Hedera helix L. se caracteriza por presentar ramas jóvenes estériles rectas o serpenteantes, de color verde-pardo a rojizo, en ocasiones rizomatosas. Con hojas anchas (4 cm de largo y 10 cm de ancho) separadas por entrenudos, lobuladas (3 a 7 lóbulos triangulares), cordiformes, palmeadas o hastadas, con margen revoluto, a veces ondulado, de color verde intenso oscuro en el haz, más claro y grisáceo en el envés, con nerviación de color verde o blanquecino, a veces prominente presentando forma de quilla. El peciolo también es de color verde parduzco a rojizo. Las ramas fértiles presentan hojas enteras, elípticas u ovadas, a veces lanceoladas y raramente obovadas u oblongas, también separadas por entrenudos algo más cortos que en el caso de las ramas estériles. El limbo es igualmente de color verde oscuro, pero en este caso las nerviaciones son verdosas y poco prominentes. Las flores se disponen en umbelas. Poseen pétalos deltoideos de color verde amarillento, sépalos triangulares castaños, estambres con filamentos de color amarillo verdoso y anteras de igual color. Los frutos son bacciformes, subglobosos, de color verde oscuro a negros. Las semillas, en número de 2 a 5 son reniformes de color castaño. En esta especie los pelos, ausentes en hojas viejas, son estrellados, multidireccionales, rara vez rotados, estipitados (pediculados) o en ocasiones sésiles, con 4 a 8 radios irregulares soldados en su parte inferior (10 a 40%), de color blanquecino y brillantes. Las hojas de las ramas estériles son las que constituyen la droga.
Las hojas de hiedra contienen saponósidos triterpénicos pentacíclicos (2,5-8%), la mayor parte bidesmosídicos, es decir con dos cadenas osídicas unidas a la genina. Estos compuestos se conocen como hederasaponinas B a I, siendo mayoritaria la hederasaponina C o hederacósido C, derivada de la hederagenina, que puede llegar a alcanzar un contenido de hasta un 7% dependiendo de la época del año. En menor concentración se encuentra la alfa-hederina y el glucósido en 3 de la hederagenina, monodesmósidos que pueden formarse durante el proceso de desecado a partir del hederacósido C. Contiene también flavonoides (quercetina y kenferol, y sus derivados), ácidos fenólicos, fitosteroles, poliacetilenos (falcarinol, didehidrofalcarinol, falcarinona, etc.), cumarinas y una pequeña proporción de aceite esencial.
La hiedra se ha utilizado tradicionalmente desde la antigüedad, ya Dioscórides e Hipócrates mencionaron sus propiedades. En diversos países se ha empleado como antiparasitaria, antihelmíntica, antidepresiva, antidiabética, depurativa, localmente en forúnculos, etc. Las decocciones de sus hojas se emplearon durante el siglo XIX para tratar los resfriados.
Mediante diversos estudios se ha comprobado su actividad antioxidante, antiespasmódica, antiinflamatoria, secretolítica, broncodilatadora, antiasmática, antimicrobiana, antihelmíntica y antitumoral. Los ensayos in vitro, en animal y clínicos se han llevado a cabo con extractos de las hojas.
La actividad antiespasmódica y broncodilatadora de los extractos de hiedra y de algunos de sus componentes aislados, se ha comprobado en numerosos ensayos in vitro. Uno de los primeros se realizó sobre íleon aislado de cobaya efectuándose un fraccionamiento biodirigido del extracto, resultando una actividad antiespasmódica significativa tanto para las saponinas como para los compuestos fenólicos, aunque teniendo en cuenta que las primeras se encuentran en mayor concentración en el extracto, serán en mayor medida responsables de la actividad de la droga. En este ensayo las saponinas más activas fueron alfa-hederina y hederagenina.
El efecto broncodilatador se ha estudiado en diversos modelos experimentales y se responsabiliza del mismo a la alfa-hederina. Este compuesto previene la internalización de receptores beta2-adrenérgicos en la superficie de las células musculares lisas bronquiales y alveolares tipo II, por tanto se favorece la activación de los receptores beta2-adrenérgicos y con ello un aumento de la broncodilatación y la secretolisis.
Mediante estudios de imágenes en células vivas y espectroscopía de correlación de fluorescencia, se comprobó que la internalización del receptor beta2 por estimulación con terbutalina, agonista específico beta2, era inhibida por pre-incubación de las células (HEK293 transfectadas) con alfa-hederina (1 µM) durante 24 horas, lo que no ocurrió con hederacósido C ni con hederagenina. Por otra parte, el pre-tratamiento de células HASM (human airway smooth muscle) con alfa-hederina (1 µM) durante 24 horas, originó un incremento de los niveles intracelulares de AMPc de un 13,5±7,0% en condiciones de estimulación con forscolina/terbutalina; hederacósido C y hederagenina no influyeron en dichos niveles. El hederacósido C se puede considerar, por tanto, como un pro-fármaco ya que se transforma, por acción de las esterasas, en alfa-hederina.
Un ensayo in vivo demostró que el extracto etanólico de hiedra (50 mg/kg), es capaz de inhibir significativamente la broncoconstricción inducida en cobayas por inhalación de ovoalbúmina o de factor de activación plaquetario, de manera dosis-dependiente.
Las propiedades expectorantes, reconocidas desde siempre, han sido sin embargo poco estudiadas, encontrándose muy escasa investigación sobre dicha actividad. Una de las publicaciones evalúa la actividad expectorante junto con la antitusígena, pero de una mezcla de extractos de hoja de H. helix (percolación con etanol al 30% durante 6 horas) y Coptis chinensis Franch (Rhizoma coptidis) (butanol saturado de agua a 80 ºC, durante 5 y 3 horas, sucesivamente). El efecto expectorante se evaluó mediante el método de secreción traqueal de rojo fenol en ratones y el antitusígeno, mediante la técnica de inhibición de la tos inducida por aerosol de ácido cítrico en cobayas. El efecto de la mezcla, en ambas actividades, fue superior al conseguido por cada uno de los extractos aislados y siempre, dosis-dependiente. La mayor eficacia se consiguió con la relación 3:1 de los extractos de hiedra y rhizoma coptidis, respectivamente. El extracto de hiedra contiene alrededor del 10% de saponinas y tradicionalmente se ha pensado que la actividad expectorante de estos compuestos, era mediada por la mucosa gástrica, por estimulación refleja de las glándulas mucosas de los bronquios a través de la vía parasimpática. Esto para algunos autores es discutible, pero lo que si se conoce, como ya se ha comentado, es que alfa-hederina inhibe la inactivación de receptores beta2 en pulmones y bronquios, por ello es posible que existan más receptores funcionales en la superficie de las células y la adrenalina presente puede tener un efecto mayor.
Respecto a la actividad antiinflamatoria del extracto de las hojas de hiedra y de las saponinas aisladas, se ha estudiado principalmente en modelos experimentales in vivo. En un ensayo in vitro se ha observado que un extracto seco registrado, (EA 575® [5-7,5:1; etanol 30% (m/m)] con el que se han realizado gran parte de los ensayos clínicos), disminuye significativamente la liberación de IL-6 inducida por LPS en macrófagos murinos, de forma dosis-dependiente.
En animal, un extracto bruto de las hojas parece ser más eficaz en un modelo experimental de inflamación aguda que un extracto purificado, enriquecido en saponinas, mientras que este último es más eficaz en inflamación crónica. Sobre la relación estructura química-actividad, parece probable que los azúcares en C3 y el resto ram7-glu1-6glu en C28, son necesarios para el efecto antiinflamatorio agudo.
Algunas saponinas triterpénicas han mostrado actividad antitumoral. En este sentido, alfa-hederina aislada no solo de la hiedra sino también de otras especies vegetales, mostró una potente actividad inhibitoria y efectos pro-apoptóticos sobre células de cáncer de mama. En un ensayo posterior sobre dos líneas celulares monocíticas malignas, se sugiere que la actividad de alfa-hederina depende sobre todo de su interacción con el colesterol de membrana y la consiguiente formación de poros.
Muy recientemente se ha publicado un estudio en el que se ha investigado la actividad citotóxica de 30 triterpenos (tipo oleanano, ursano y lupano) obtenidos de especies vegetales (Hedera helix, Juglans sinensis y Pulsatilla koreana), sobre dos líneas celulares cancerosas: HepG2 (carcinoma hepatocelular humano) y AGS (adenocarcinoma gástrico humano). Uno de los dos compuestos con mayor actividad es alfa-hederina que mostró potente citotoxicidad vía apoptosis (regulación de caspasa-3).
Por otra parte, los extractos acuosos y metanólicos de hoja de hiedra poseen actividad hipoglucemiante comprobada en conejos sanos y con diabetes inducida por aloxano. Estas hojas contienen “elementos traza hipoglucemiantes” como son cromo, manganeso y zinc, que pueden ser los responsables de la actividad.
Un estudio muy reciente en ratón sugiere que una fracción purificada de hiedra que contiene hederagenina y alfa-hederina podría mejorar déficits motores en un modelo experimental de enfermedad de Parkinson. Ambas saponinas promueven la degradación de proteínas mutantes en la enfermedad neurodegenerativa in vitro, por lo que se deduce que la hiedra podría tener un papel en los trastornos neurodegenerativos.
Respecto a los ensayos clínicos, la mayor parte se dedican a evaluar el empleo de los extractos de hojas de hiedra en afecciones respiratorias, tanto agudas como crónicas y tanto en adultos como en niños. Se valora su eficacia pero también la seguridad de su empleo. Muchos de estos ensayos utilizan el extracto registrado ya mencionado EA 575 que se considera eficaz y muy bien tolerado.
En el año 2015 se publicó una revisión de los ensayos clínicos publicados a partir de 1990 en los cuales se administraron preparados comerciales elaborados con dicho extracto para el tratamiento de la tos y de enfermedades bronquiales inflamatorias. En total suponen 18 publicaciones entre ensayos clínicos y estudios no intervencionistas que alcanzan un total de 65.383 pacientes, comprobándose su seguridad y eficacia. La seguridad además queda patente por el hecho de que en alguno de los ensayos se administraron dosis más elevadas o a grupos especiales, como por ejemplo a niños de menos de un año. Posteriormente a esta revisión se han publicado algunos ensayos clínicos más que confirman lo ya expuesto. De algunos estudios clínicos se deduce además, que la eficacia del extracto seco de hiedra no es inferior a la de fármacos de síntesis como el ambroxol para tratar el síntoma de tos en adultos con bronquitis crónica, o a la de acetilcisteína en los síntomas de bronquitis aguda en niños. Igualmente es útil como coadyuvante en enfermedades obstructivas respiratorias como asma bronquial ya que la hiedra es broncoespasmolítico.
Uno de los trabajos posteriores, es un ensayo aleatorizado, doble ciego, sobre 590 pacientes de edades comprendidas entre 2 y 86 años, que compara la eficacia y tolerabilidad de un preparado de un extracto de hojas de hiedra, con otro ya conocido y estudiado. La escala de medida de los síntomas es la Bronchitis Severity Score (BSS). Los dos tratamientos mejoran los síntomas de forma comparable, con un elevado perfil de seguridad, siendo muy bien tolerados especialmente en menores de 10 años.
Otro estudio posterior es un ensayo doble ciego, controlado frente a placebo, aleatorizado, cruzado, que se llevó a cabo con 30 niños asmáticos de entre 6 y 12 años, afectados de asma bronquial moderada persistente, parcial o incontrolada, con severidad de grado II según la “versión 1.3.2011 NVL asthma”, a pesar del tratamiento con un corticosteroide inhalado. Se observó una mejora significativa en los parámetros de la función pulmonar en el grupo de niños que recibió, adicionalmente a su medicación, el extracto de hojas de hiedra frente a los que recibieron placebo. Los autores expresan que es preciso realizar nuevos estudios para asegurar que podría utilizarse en el tratamiento de pacientes asmáticos.
También se ha comparado en otro estudio clínico pediátrico, la eficacia de dos formulaciones distintas de extracto de hoja de hiedra (2,2-2,9:1; etanol 50% / propilen glicol 98/2), jarabe y gotas. Es un estudio no observacional, en 268 niños de 0 a 12 años con catarro agudo o enfermedad bronquial inflamatoria crónica recidivante. El ensayo se efectuó durante un promedio de 10 días con visitas los días 4-7 y una visita final del día 8 al 14. Ambos preparados galénicos son seguros y fáciles de administrar a niños, habiéndose detectado únicamente 5 efectos adversos leves (1,9%).
En un ensayo de farmacovigilancia se valoró la seguridad y tolerabilidad de una especialidad que contiene el extracto seco de hojas de hiedra (Prospan® Cough Tablets). Se incluyeron un total de 330 pacientes comprendidos entre 11 y 85 años, con problemas respiratorios como resfriados con tos o enfermedad inflamatoria bronquial crónica. El tratamiento fue de al menos siete días. La tolerabilidad, valorada mediante una encuesta, fue calificada como muy buena tanto por los facultativos como por los pacientes y esta es una de las causas del elevado cumplimiento (98,8%).
EMA reconoce su uso bien establecido como expectorante en casos de tos productiva. Por su parte la monografía de ESCOP indica el empleo de la hoja de hiedra en el tratamiento de la tos, especialmente cuando va asociada con hipersecreción de moco viscoso y como coadyuvante en afecciones bronquiales inflamatorias.
La posología aprobada por la EMA en uso bien establecido, para administración oral en adolescentes, adultos y ancianos es la siguiente:
- 15-65 mg de extracto seco hidroalcohólico (4-8:1, etanol 24-30%), una a tres veces/día. Dosis diaria 45-105 mg.
- 14-18 mg de extracto seco hidroalcohólico (6-7:1, etanol 40%), 3 veces/día.
- 33 mg de extracto seco hidroalcohólico (3-6:1, etanol 60%), 2 veces/día.
- 100 mg de extracto fluido (1:1, etanol 70%), 3 veces/día.
- 40 mg de extracto blando (2,2-2,9:1, etanol 50%: propilen glicol [98:2]), 3 veces/día.
Para niños entre 6 y 11 años:
- 11-35 mg de extracto seco hidroalcohólico (4-8:1, etanol 24-30%), dos a tres veces/día. Dosis diaria 33-70 mg.
- 9-18 mg de extracto seco hidroalcohólico (6-7:1, etanol 40%), dos a tres veces/día. Dosis diaria 15-40 mg.
- 25 mg de extracto seco hidroalcohólico (3-6:1, etanol 60%), 2 veces/día.
- 75 mg de extracto fluido (1:1, etanol 70%), 3 veces/día.
- 20-26 mg de extracto blando (2,2-2,9:1, etanol 50%: propilen glicol [98:2]), 3-4 veces/día. Dosis diaria máxima 80 mg.
Para niños entre 2 y 5 años:
- 8-18 mg de extracto seco hidroalcohólico (4-8:1, etanol 24-30%), dos a tres veces/día. Dosis diaria 24-36 mg.
- 7-9 mg de extracto seco hidroalcohólico (6-7:1, etanol 40%), dos a tres veces/día. Dosis diaria 17-27 mg.
- 17 mg de extracto seco hidroalcohólico (3-6:1, etanol 60%), 2 veces/día.
- 20 mg de extracto blando (2,2-2,9:1, etanol 50%: propilen glicol [98:2]), tres veces/día.
ESCOP ajusta la posología según los preparados contengan o no etanol y según la edad del paciente. Expresan la dosis diaria a administrar referida a droga desecada. Preparaciones con alcohol: adultos: 250-420 mg; niños de 4 a 12 años: 150-210 mg; niños de 1 a 4 años: 50 a 150 mg; niños de 0 a 1 año: 20-50 mg. Preparaciones sin alcohol: adultos: 300-945 mg; niños de 4 a 12 años: 200-630 mg; niños de 1 a 4 años: 150 a 300 mg; niños de 0 a 1 año: 50-200. Para uso por vía rectal: supositorios en niños de 4 a 10 años, 960 mg. Si al cabo de una semana persisten los síntomas, se debe consultar con un especialista.
Según EMA, está contraindicado el empleo de la droga en niños menores de 2 años ya que podrían agravarse los síntomas respiratorios. Tampoco se debe administrar durante el embarazo ni en periodo de lactancia ya que no hay datos específicos de seguridad.
Se trata de una droga bastante segura. De los ensayos clínicos se puede destacar uno que incluyó más de 52.000 niños entre 0 y 12 años, en el que tan solo se observaron efectos adversos menores en un 0,22%, no obstante puede producir efectos adversos de tipo gastrointestinal como nauseas, vómitos, dolor abdominal o diarreas. Debe observarse precaución en pacientes con gastritis. No debe tampoco administrarse conjuntamente con fármacos antitusivos opiáceos, especialmente en niños.
El contacto continuado con las hojas de hiedra puede originar dermatitis con aparición de eritemas o vesículas en manos y brazos e incluso en la cara, síntomas que remiten mas o menos rápido cuando cesa el contacto. Esta reacción se puede deber a la presencia de un poliino (falcarinol) en dichas hojas.
Se encuentran diversas preparaciones comerciales en Europa del extracto de hojas de hiedra; frecuentemente son administradas por vía oral como jarabes, gotas, comprimidos, tabletas efervescentes, etc., pero también se encuentran preparaciones por vía rectal, supositorios. Se administran para el tratamiento del resfriado común asociado con tos y también en trastornos bronquiales inflamatorios, agudos o crónicos. Es frecuente encontrar preparados fitofarmacéuticos que lleven asociadas las hojas de hiedra con otras drogas vegetales como tomillo o regaliz, por ejemplo.
La hiedra se emplea además bastante en cosmética, formando parte de cremas, champús y de fórmulas anticelulíticas. Aunque no es oficinal, también se utiliza en fitoterapia el leño de esta especie, con propiedades expectorantes y antiasmáticas.
Bibliografía
España: La importancia de la (mala) adherencia a los tratamientos farmacológicos
España
La importancia de la (mala) adherencia a los tratamientos farmacológicos
Un documento publicado por Farmaindustria a finales de 2016 sobre la adherencia terapéutica, elaborado a partir de una encuesta realizada sobre 1.400 pacientes españoles que padecen alguna enfermedad crónica muestra que el 50% de los pacientes crónicos en España no son adherentes a los tratamientos farmacológicos.
El grado de adherencia es mucho mayor en personas jóvenes que en los ancianos; así, las tasas de falta de adherencia entre pacientes con 18 a 51 años oscilan entre el 68% y el 79%, lo que contrasta con el 2-39% en personas mayores de 80 años. Un 56% de los pacientes no adherentes tienen estudios superiores, mientras que no hay diferencias por sexo (51% en los varones y 49% para las mujeres) o por el entorno, siendo homogénea la falta de adherencia en entornos urbanos (51%) y rurales (49%).
No parece existir relación entre la adherencia al tratamiento con el número de medicamentos en forma oral que utilizan, ya que es paradójicamente mayor la falta de adherencia entre los que solo utilizan una forma oral diaria (61%) que los que utilizan 6 o más (42%). Igualmente, el número de patologías que afecta a los pacientes parece ser determinante para la falta de adherencia al tratamiento, fenómeno que se observa en el 54% de los pacientes afectados por una única enfermedad vs. 45% en aquellos afectados por cuatro o más. Existen claras diferencias según el tipo de patología que presente el paciente; por ejemplo, el grado de falta de adherencia es muy elevado entre pacientes afectos por depresión (78%) y EPOC (59%), mientras que en el otro extremo se sitúan los pacientes con VIH (20%) y cáncer (30%); en una posición intermedia están los pacientes hipertensos (48%) y diabéticos (44%).
A pesar de la elevada tasa de falta de adherencia al tratamiento, el 81% de los pacientes califican como buena o muy buena la eficacia de los medicamentos que está tomando para el tratamiento de las enfermedades. Además, el 83% considera suficiente la información que recibe de los tratamientos, valorando como buena o muy buena la comunicación con el médico (88,3%), farmacéutico (83,5%) o enfermero (68,5%).
España: La investigación clínica en oncología es puntera
España
La investigación clínica en oncología es puntera
Según apunta Farmaindustria, España en uno de los países de Europa con mejores condiciones para la investigación de nuevos fármacos contra el cáncer, enfermedad cuyo Día Mundial se celebra el 4 de febrero. De hecho, el 37% de los ensayos clínicos realizados en España, englobando tanto los promovidos a iniciativa de la industria farmacéutica como los impulsados por entidades públicas, pertenecen al ámbito de la oncología, frente al 24% de la media europea, según datos del Registro Europeo de Ensayos Clínicos (EudraPharm) correspondientes a 2015. Considerando específicamente los ensayos clínicos llevados a cabo en España por iniciativa de la industria farmacéutica tienen como sujeto de investigación medicamentos antineoplásicos
Pese a que la incidencia del cáncer sigue creciendo (en 2015 se registraron en España 247.771 nuevos casos), los fondos destinados a la lucha contra él se mantienen estables, en términos relativos, desde hace dos décadas. Un aspecto relevante es que, pese a que el cáncer sea responsable de una de cada cuatro muertes en Europa, su tratamiento no ha superado en los últimos 20 años el 6% del total del gasto sanitario en el continente. Ello es atribuido al desarrollo de nuevos antitumorales cada vez menos tóxicos y que pueden ser utilizados mediante administración oral, lo que ha permitido que muchos pacientes que antes se trataban en el hospital puedan ahora seguir su tratamiento de forma ambulatoria. Asimismo, el coste de los antitumorales sólo supone el 23% del coste del abordaje sanitario del cáncer en los países europeos (datos de 2014).
España: La vacuna antineumocócica: una historia sanitaria de éxito
España
La vacuna antineumocócica: una historia sanitaria de éxito
La presentación de la publicación Quince años de vacunación antineumocócica conjugada 2001-2016 ha dado a conocer los principales éxitos sanitarios obtenidos en España desde la llegada, hace ya 15 años, de la primera vacuna antineumocócica conjugada, cuya principal ventaja es que pueden administrarse desde los dos meses de edad, son mucho más inmunógenas que las convencionales, la duración de la inmunidad es superior y, además, en el caso de la vacuna conjugada trecevalente, se puede administrar en todas las edades de la vida.
La aprobación en 2012 de la vacuna antineumocócica conjugada trecevalente para todas las edades, permitió que muchas comunidades autónomas fuesen desarrollando estrategias vacunales para adultos con determinados perfiles de riesgo. De hecho, desde hace algunos meses, dos regiones han sido pioneras al incluir también esta vacuna para la inmunización del adulto de forma sistemática y financiada: Madrid (a partir de los 60 años) y Castilla y León (a partir de los 65 años).
Esto alcanza un especial relieve sanitario porque la enfermedad neumocócica afecta fundamentalmente en las edades extremas de la vida: primera infancia y adultos mayores. En la primera infancia, aunque tiene una presencia más elevada, las tasas de mortalidad o de complicaciones son inferiores que en las últimas fases de la vida, donde la letalidad es mayor.
La incorporación de la vacunación antineumocócica conjugada en estos 15 años ha permitido reducir de forma importante la incidencia de la enfermedad neumocócica invasiva (meningitis o sepsis). En concreto, desde el comienzo del empleo de la vacuna antineumocócica trecevalente se ha producido un importantísimo descenso, de hasta el 70%, de los casos de enfermedad neumocócica invasiva en menores de 15 años en la Comunidad de Madrid.
España: El mercado farmacéutico español creció un 6,6% en 2016
España
El mercado farmacéutico español creció un 6,6% en 2016
Según reciente informe publicado por Quintiles IMS, el mercado farmacéutico crece en el acumulado de los últimos 12 meses un 6,6% en términos económicos y un 4,2% en volumen. En concreto, el mercado farmacéutico de medicamentos sujetos a prescripción aumento en un 6,4% (económico) y un 3,8% (unidades); en este sentido, los productos antidiabéticos (A10) son la clase terapéutica con mayor facturación en España en el último año, seguido de los medicamentos empleados en asma y EPOC (R03), y los analgésicos (N02); en concreto, los antidiabéticos experimentaron un incremento superior al 10% en 2016. El crecimiento en el área de medicamentos genéricos fue del 3,1% en unidades y del 4,7% en ventas, mientras que en el de medicamentos con marca fueron del 4,2% y 6,8%, respectivamente.
Por lo que se refiere al mercado de medicamentos no sujetos a prescripción y otros productos de distribución farmacéutica (Consumer Health), el crecimiento fue de 7,4% en valor económico y en un 5,0% en unidades. Un 39,2% de este sector correspondió a medicamentos no sujetos a prescripción, y el resto a nutrición, cuidados personales y de pacientes.
Por Comunidades Autónomas, los mayores crecimientos del mercado farmacéutico se registraron en Cantabria (10% en términos económicos y 6% en unidades), Asturias (8/6%), Extremadura (8/6%), Canarias (8/6%) y Aragón (8/5%). En cuanto al mercado de medicamentos, crecieron especialmente Catabria (10/6%), Aragón (8/5%), Comunidad Valenciana (8/5%) y Madrid (8/5%); en cuando al mercado farmacéutico no sujeto a prescripción médica (Consumer Health), las comunidades autónomas que mayor crecimiento experimentaron fueron Asturias (16/10%), Extremadura (12/10%), Galicia (10/8%) y Canarias (10/8%).
Internacional: Coste y tiempo de desarrollo de un medicamento
Internacional
Coste y tiempo de desarrollo de un medicamento
Según datos aportados por Farmaindustria, en 2014 los costes medios asociados a la investigación y desarrollo de un medicamento eran de 2.425 millones €, más del doble que en 2003 (1.031) y 5,4 veces más que en 1991 (451), cifrándose en un 57,6% los costes destinados al diseño, desarrollo y evaluación de ensayos clínicos, mientras que un 24,8% se dedica a investigación básica, un 6,1% a los procedimientos de autorización y registro, y un 9,5% a farmacovigilancia. Según esta misma fuente, la industria farmacéutica tarda entre 12 y 13 años en desarrollar y poner en el mercado un nuevo medicamento, utilizando para ello alrededor de 7 millones de horas de trabajo.
En realidad, en estas cifras tan abultadas se incluye también el ingente número de potenciales medicamentos que no llegan nunca a ver la luz. De hecho, de las 7.262 moléculas en desarrollo en 2015, solo 44 nuevos medicamentos fueron autorizados; a eso cabe agregar de solo uno de cada cinco medicamentos comercializados generan ingresos que superan los costes medios de investigación y desarrollo.
Toros
Resumen
En esta serie que estoy escribiendo sobre nuestra colección de publicidad farmacéutica, llevo dos entregas dedicado a la literatura. Queda alguna otra. Para no cansar voy a cambiar de tercio y nunca mejor dicho. Nuestros antepasados profesionales hicieron publicidad de sus medicamentos con todo o casi todo: con la tauromaquia también. El dedicarle un capítulo me permite hablar del contenido y del continente.
El juego de los toros en España es antiquísimo. Al parecer empezó a desarrollarse desde el siglo XII. Primero fue cosa de nobles, como el de las cañas, mediante los cuales representaban caballerescas escenas de guerra. Ambos se efectuaban a caballo. Los aristócratas demostraban así su valor y habilidad en el combate; sus escuderos y sirvientes realizaban tareas secundarias a pie. A partir del siglo XVI comienzan a construirse plazas de toros de madera. Surgen también las primeras figuras del toreo a peón que pasan a ser, durante el XVII, las preferidas por las clases populares. Poco a poco, éste pasatiempo extemporáneo, celebrado en ocasiones especiales, se convierte en frecuente durante los meses de buen tiempo, favorito de las gentes con menos recursos, hasta llegar a considerarse una teórica fiesta nacional. Con algunas diferencias se celebra en toda la península Ibérica, el sur de Francia y muchos de los países hispanoamericanos.
Si la fiesta fue aplaudida, consentida y celebrada por la mayoría de los monarcas hasta los Austrias menores, los Borbones intentaron su prohibición, en varias ocasiones, a partir de Carlos III. Los ilustrados la consideraban una fiesta bárbara y representativa del retraso español. No lo consiguieron, ni él ni su hijo porque la gente, en masa, ignoraba las disposiciones prohibicionistas.
A lo largo del XIX la cuestión volvió a discutirse en el Parlamento. Durante las Cortes de Cádiz la defensa de la fiesta corrió a cargo del liberal Antonio Capmany, Secretario de la Real Academia de la Historia y diputado catalán, quien ganó la votación. Se celebraron diez festejos en el Cádiz de las libertades. El último intento fue en 1877. Lo protagonizó José María de Quiñones, Marqués de San Carlos (título correspondiente al Reino de las Dos Sicilias), quien propuso su prohibición. No se aceptó por considerarlo demasiado impopular.
La tauromaquia ha tenido un impresionante reflejo artístico. Se han ocupado de ella alguno de nuestros principales pintores como Francisco de Goya o Picasso; una extraordinaria nómina de escritores admiradores del juego de los toros: desde Federico García Lorca o Rafael Alberti, hasta Marcelino Menéndez Pelayo, José Bergamín o José Ortega y Gasset, aunque mi preferido sea el libro de Manuel Chaves Nogales sobre Juan Belmonte.
Entre los antitaurinos podemos encontrarnos desde Lope de Vega, Pío Baroja, Unamuno o José Ferrater Mora, hasta Eugenio Noel, quien hizo de su vida y literatura una cruzada contra la fiesta.
Quien esto escribe en la actualidad – lo he consignado por escrito otras veces – no quiere considerarse antitaurino; simplemente los toros no me gustan.
El antitaurinismo actual tiene una doble vertiente con la cual no puedo mostrarme solidario. En primer lugar están los separatistas que han prohibido la fiesta en los territorios controlados por ellos. Primero los catalanes y luego los vascos filoetarras mientras han estado en los gobiernos locales. No lo han hecho por consideraciones culturales, éticas o pedagógicas; simplemente para oponerse a todo aquello torpemente considerado español, pues sus fiestas taurinas propias las han respetado y protegido.
En segundo lugar están los mal llamados animalistas, personas partidarias de humanizar a los animales e incluso de considerarlos con derechos no sólo idénticos, sino superiores a los de los humanos, lo cual me parece una auténtica aberración, no porque crea que no son merecedores de derechos, sino que estos son otorgados por los únicos animales dotados de inteligencia y una posible libertad: los humanos. Deben hacerlo para respetar su propia dignidad humana y jamás anteponerla a la de sus otros compañeros de la especia humana.
En definitiva, el antitaurinismo se ha visto invadido por una serie de elementos extraños y distorsionadores. Quienes nos consideramos en la estela del humanismo y el liberalismo progresista, nos encontramos a disgusto a su lado y, como no somos políticos, simplemente nos apartamos de ellos. A mí, por tanto, no me gustan los toros. No creo que, en la actualidad, sea la fiesta nacional pues quien goza del favor popular es el fútbol (se imaginan a cualquier político gobernante prohibiendo, no ya el juego en sí mismo, sino la salida al campo de alguno de los futbolistas envueltos en escándalos de evasión de impuestos que con tanta dureza son juzgados en otros casos). Creo que la tauromaquia estaba en recesión en nuestro suelo; en pocas generaciones se habría extinguido el gusto hacia ella y, desde luego, no soy partidario de prohibirla, ni de censurar los gustos de personas perfectamente formadas que encuentran en ella no sólo un pasatiempo, sino una vivencia tradicional, artística y cuasi religiosa, con quienes me gustaría debatir – y he debatido – alejado de esos condicionamientos fanáticos a los que al principio hacía referencia.
En los gustos personales inciden mucho las vivencias. A mí me llevó a los toros, con cierta asiduidad, mi padre. También me llevaba a los conciertos y a cazar y pescar. Cómo intento ser una persona libre, desarrollé un gran gusto hacia la música y la pesca y ninguno hacia la tauromaquia y la caza. Contra ésta última no tengo argumento alguno, salvo la masificación y la ausencia de espíritu deportivo que percibo entre los modernos cazadores.
A la plaza, de muy pequeño, íbamos con un amigo a quien llamaban el General. Que era militar no me cabe duda. Sobre su graduación no estoy tan seguro porque dejé de verlo antes de la adolescencia. Se sentaban ambos sobre las duras gradas de la plaza de la Ventas conmigo en medio y encendían sus tremendos vegueros, similares a los que hoy en día me fumo yo pero que, para un niño pequeño, suponían no sólo el ahumamiento absoluto, sino una cierta sensación de vértigo aumentada por el ruido del gentío, el calor y la excitación propia de un espectáculo tan rotundo. El General era hombre de gruesa constitución; sudaba y resoplaba sin cesar durante toda la corrida. El malestar aumentaba cuando empezaban a trastear a los toros y corría la sangre.
Desde entonces – al escribir esto me doy cuenta – he tenido una cierta fobia a la sangre. Cuando me tocó hacer prácticas de fisiología animal hube de sacarle una gota de sangre del dedo a un compañero árabe. El muchacho, al verla, cayó redondo al suelo desde el taburete de madera de patas altas que abundaban (y abundan) en los laboratorios de la facultad de Farmacia. A mí hubieron de apuntalarme entre varias compañeras, con lo cual no quedé demasiado bien ante ellas. Me consoló, años después, ver a mi capitán de escuadrilla, un caballero legionario de lo más bragado, salir en camilla después de donar sangre y pasar tres o cuatro días de baja, tras los cuales se vengó haciéndonos pasarlas canutas en los ejercicios de instrucción en formación abierta durante mi estancia en Los Alcázares, el anejo a la Academia de San Javier en donde me preparé para ser oficial de complemento del Ejército del Aire, concretamente de su arma de Tierra, lamentablemente no de Farmacia. Todavía, hoy en día, cuando debo hacerme los análisis de sangre, prescritos regularmente por mi médico de cabecera, las extractoras se lo pasan de miedo conmigo porque, aunque me lo tomo a broma, no les doy ventaja alguna y deben cazarme la vena al vuelo. Creo que me quieren porque se ven obligadas a utilizar todas las mañas empleadas con los niños pequeños para extraerme la sangre. Incluso, al acabar, algunas me dan piruletas para evitarme el llanto…
Esas vivencias infantiles son muy importantes para determinar los gustos adultos de las personas. Cuando pude racionalizarlas me di cuenta de que pasaba la corrida en vilo, no tanto por el maltrato al animal o la efusión sanguínea, cuanto por el omnipresente baile con la muerte de los toreros. Los antitaurinos se ceban en los derechos del animal y no mencionan nunca la presencia de una serie de seres humanos – a los que motejan de asesinos – jugándose la vida en el ruedo. Todas las tardes, en muchos puntos de España, una serie de seres humanos danzan con la muerte y obtienen más éxito cuanto más cerca se encuentran de ella. La máxima figura del toreo actual, José Tomás, en sus tardes de mayor gloria salía de los ruedos convertido en un auténtico ecce homo. A mí, esa banalización de la vida – humana y animal – me parece perversa y, desde luego, no me gusta nada.
Sé que la vida es un don provisional. Como sin ninguna prevención carne y no sólo eso: confieso que soy un amante exagerado del lechón, el cabrito y el cochinillo asado, así como de sus vísceras y de la cabecilla de cordero asado – lo cual me convertirá en un auténtico caníbal a ojos de los animalistas –. Tampoco tendría ninguna prevención a salir de codornices o perdices si tuviera, o me dejaran, un perro adiestrado y una escopeta de dos cañones (seguramente los animales se burlarían de mí y los perros me mirarían con pena) pero no me gusta el alarde en la muerte: ni la matanza del cerdo – cuyas delicias consumiría con deleite si me dejara el médico – ni las corridas de toros.
El ver cómo la muerte se pavonea por las tardes en los ruedos, mientras una masa enfervorizada pide animales más peligrosos y mayor peligro en los maestros, me parece bárbaro y anti-pedagógico. Todos hemos de morir y la muerte es imprescindible para la vida, pero no veo porqué ha de exaltarse en público y de manera casi heroica. ¿Se imaginan los hospitales convertidos en espectáculo de moda? ¿Las sangrientas batallas del medio y lejano Oriente televisadas previo pago? Con Marañón, creo que la banalización de la vida ha incidido en nuestras guerras civiles. En la España trágica, la vida no se ha percibido como un valor fundamental. Por una parte los toros exaltando la danza macabra para un público enfervorecido; por otra, la religión prometiendo una vida mejor después de ésta y celebrando la muerte de Cristo, cotidianamente, como algo purificador para los pecadores… no se me puede escapar de la retina la represión efectuada en Badajoz en una plaza de toros y la horrorosa muerte – lidiados – que se dio a algunos maestros republicanos; tampoco los asesinatos masivos de curas – algunos jovencísimos – llevados a cabo por otros muchachos jovencísimos que hablaban de ellos como si de la matanza del cerdo se tratara. En nuestra historia hay demasiados casos de crueldad extrema como para pasar por alto de ellos. Los españoles tenemos, quiero pensar que teníamos, un gusto extremo por la crueldad y las danzas macabras no son un elemento educador de esa sensibilidad. Sé – como Shakespeare – que lo feo es bello y lo bello es feo, pero prefiero dejarlo en la literatura como Los cantos de Maldoror de Isidore Ducasse.
En definitiva, por esa y otras muchas cuestiones no me gustan los toros. Por eso no acudo a ellos y por eso, también, no juzgo a quienes tienen una sensibilidad diferente, ni mucho menos los considero inferiores moralmente, pues si hiciera tal cosa no podría tener una profunda amistad, respeto y admiración hacia nuestro compañero Luis Gómez Rodríguez, cuyo libro La corrida de toros, cuya lectura les aconsejo, prologué orgulloso después de haber mantenido con él diversas y amistosas disputas por escrito; ni podría mantener mi amistad con Rosa Basante, ni comer amistosamente con José Luis Blanco o con Carlos González Bosch, excelentes y cultas personas que disfrutan de la fiesta de los toros y tienen una sensibilidad opuesta a la mía, aunque en otras muchas cosas tengamos ideas comunes o con mi muy admirado colega Carlos Martínez Shaw. Desde luego, no hacemos de ésta, ni de ninguna otra diferencia, baluarte para el desencuentro. Los españoles somos demasiado dados a las trincheras; a considerar enemigo al diferente. En eso, como en todo, se debe relativizar, dialogar, intercambiar opiniones y, jamás, hacer prevalecer la tuya mediante las prohibiciones.

Figura 1.
Sin meterse en estas honduras, nuestros antecesores publicitaron sus establecimientos y fármacos mediante impresos relacionados con la fiesta. Una de las piezas más curiosas de nuestra colección es una serie de 96 cromitos (6 x 4 cm) con unas magníficas litografías de las caras de los más famosos toreros de finales del siglo XIX y principios del XX. Los empleó la farmacia y droguería de los hijos de Carlos Ulzurrun para publicitar su establecimiento y en el dorso el bálsamo Perichler para quemaduras del que eran el único depósito (Figura 1). Ese bálsamo era una de las diez sustancias principales importadas de América y se empleaba de forma obligatoria en la Marina Española. Su composición aparece en el número 27 de La Farmacia Española: hiel de toro; aceite de oliva; espigas de la planta conocida como rabo de zorra, corteza de cedro; copal de la isla; raíz de Almácigo sacada en menguante de luna; alcohol rectificado; espíritu de trementina; brea prieta y pez rubia.
Si tenemos en cuenta estos datos, que la citada farmacia cambió de ubicación en 1898, desde la madrileña calle Imperial, 1 y 8, a la calle Esparteros nº 9, conservando el mismo número de teléfono (893), junto a los nombres de algunas de las figuras celebradas: Francisco Arjona, Cúchares (1818-1868); Salvador Sánchez, Frascuelo (1842-1898); su hermano Francisco Sánchez, apodado de la misma manera (1843-1924); Manuel García, Espartero (1865-1894); Juan Ruiz, Lagartija (1855-1926); Rafael Molina Sánchez, Lagartijo (1841-1900); Rafael Guerra, Guerrita (1862-1941); Francisco Romero (1700-1763); Pedro Romero (1754-1839); Antonio Sánchez, El Tato (1831-1895); Francisco Montes, Paquiro (1805-1851); Luis Mazzantini (1856-1926) o Miguel Báez, Litri (1869-1932) entre otros muchos, no cabe duda de que el anuncio fue impreso a finales del siglo XIX o principios del XX, lo cual, unido al interés de la serie para los amantes de la tauromaquia, hizo que nos costara un auténtico potosí. Lo adquirimos, hace muchos años, pensando que sería una auténtica excepción en nuestra colección de propaganda farmacéutica: nos equivocamos en la previsión.

Figura 2.
Mientras estaba escribiendo este artículo me ofrecieron – a precio de caviar Beluga – otra colección idéntica que, en éste caso, anuncia las pastillas del famoso Doctor Andreu para la tos y en el reverso los papeles azoados y los cigarrillos del mismo fabricante contra el asma, amén de la Mentholina, un dentífrico del mismo laboratorio catalán (Figura 2).
La coincidencia sirve para explicar cómo hay algunos reclamos preparados de manera expresa para un determinado fármaco o empresario y otros, simplemente, imprimían su propaganda sobre un soporte popular y en muchas ocasiones coleccionable; en éste caso, los cromos con representaciones de toreros fueron igualmente válidos para un fabricante catalán con implantación en todo el estado y para unos boticarios madrileños.
El resolutivo Rojo Mata, un específico veterinario que puede encontrarse en la web del Museo de la Farmacia catalana y en la del Museo Aramburu, editó una serie de cromos (5 x 8 cm) de mucha menor calidad que la anterior, dedicada a la corrida de toros, en donde también publicitaban su anticólico Mata para ganados. Dado que estuvo en el mercado entre 1920 y 1952, más o menos, entre esas dos fechas puede situarse su publicación (Figura 3).
El Ceregumil de Fernández y Canivell SA, de Málaga, también editó otra serie de cromos (6,5 x 10 cm) de baja calidad, dedicados a las suertes interpretadas por Manolete, explicadas en el dorso de los mismos. Teniendo en cuenta que murió en 1947, se publicaría poco después de la guerra civil, lo que justifica en parte su poca nitidez (Figura 4).
De muchísima mayor calidad y tamaño (21 x 30 cm) son unas plumillas de Antonio Casero dedicadas a las suertes del toreo y editadas en 1965 por los laboratorios Amor Gil SA para publicitar algunas de sus especialidades (Figura 5).
Antonio Casero Sanz (1897-1973) fue un pintor madrileño, educado en la Escuela de Bellas Artes y funcionario del Museo Municipal de Madrid, colaborador del ABC y Blanco y Negro, especializado en temas taurinos. Su presencia en la publicidad farmacéutica indica que los laboratorios elegían a los mejores para dar a conocer sus productos.
Los laboratorios farmacéuticos Made empezaron su actividad en Madrid hacia 1961 en una edificación cuyo arquitecto fue Miguel Fisac; fueron absorbidos por la firma alemana Knoll AG en 1984 y hoy están extinguidos. Entre esas fechas – probablemente hacia 1971, en que hicieron una publicación sobre el medicamento de acción neurorreguladora – lanzaron al mercado la Conductasa piriglutina, sintetizada y patentada por ellos. Para su campaña utilizaron una serie de plumillas (15 x 21,5 cm) también de buena calidad, aunque algo menor que la de Antonio Casero, del dibujante madrileño Cándido Bernardo Masides, conocido como Bernardo Olabarría (1921-1994), sobre las suertes del toreo. Bernardo Olabarria fue un pintor autodidacta dedicado a la publicidad y el diseño que colaboró en numerosas publicaciones, entre ellas el citado periódico ABC. También fue muy popular en su tiempo.
El Vigoron fue un remedio de principios del siglo, reflejado en la web del Museo del Objeto de México. Prometía proporcionar magnetismo, puesto que será la causa de su vitalidad… colmando de salud y vigor a todos los tejidos del cuerpo por medio de su acción vivificante sobre la sangre. Sus promotores enviaban unas tarjetas postales (8,5 x 13,5 cm) sobre la ovación y oreja, de mala calidad.
En 1970, el Diazepan Prodes, un medicamento utilizado en depresiones y situaciones de angustia, publicó una serie de fotografías en color – de poca calidad – sobre las diversas suertes de la fiesta. Las explicaban someramente en el dorso y la relacionaban con la angustia. Para ellos, parece, asistir a una corrida de toros merecía tomarse un Diazepan. Dos años más tarde, en 1972, otra vez los laboratorios Made acudieron a los toros y la poesía para publicitar la Trezida, un conjunto de coenzimas B. Empleaban un díptico en donde se reproducía un magnífico cuadro clásico (Figura 6) junto a un poema de Manuel Martínez Remis (Madrid, 1911-1989).
Entre los laboratorios extranjeros, Bayer editó uno de esos cuentecitos a que hemos hecho referencia en entregas anteriores, redactado por J. Pérez de Zúñiga e ilustrado por J. Xaudaró, especialmente bueno, en donde se nos habla de una corrida salvada, evidentemente gracias a la aspirina (Figura 7).
La Piperazine Midy fue un medicamento francés dedicado a prevenir y curar los cólicos renales. Tuvo una difusión muy amplia por Europa y América y se publicitó, entre otras cosas, mediante un sistema de tarjetas postales (8,5 x 13,5 cm). Muy acertadamente, en la serie dedicada a los deportes incluyó la corrida de toros. Nada de cultura o Bellas Artes, para ellos simple deporte (Figura 8).
Los franceses, también a principios del siglo XX, se atrevieron a decorar muy hermosamente, el envase del Elixir Sangart, un tónico poderoso, que encontramos en el mismísimo marché aux pouces de París, con un hermoso y fiero toro en medio de un coso modernista (Figura 9).
También los portugueses, pese a su lidia sin muerte, publicitaron el Vinho tónico Toureiro, un poderoso reconstituyente a base de carne, mediante un banderillero (Figura 10).
Todo lo cual indica que la publicidad farmacéutica se valió extensamente de la fiesta de los toros, cuando era más popular, para cumplir con su finalidad de llegar a la mayor cantidad posible de personas, como cualquier otro objeto de consumo.
Coste-efectividad de pemetrexed en cáncer de pulmón
El cáncer de pulmón es el tercer tipo de cáncer más prevalente en España (13% del total y 27.000 casos nuevos anualmente); el subtipo principal se corresponde con el no microcítico, el cual se diagnostica principalmente en estadios avanzados. El tratamiento del cáncer de pulmón no microcítico (CPNM) se ha basado en platino; más recientemente, se han incorporado pemetrexed (P) o bevacizumab (B) que se asocian a la quimioterapia – con cisplatino (C), carboplatino (CP), paclitaxel (PT) o gemcitabina (G) – en una primera fase de inducción, seguido de la administración de de P o de B en una fase posterior de mantenimiento, hasta la progresión de la enfermedad o presencia de toxicidad intolerable. Ello se ha traducido en una mejora del resultado clínico y de la supervivencia libre de progresión (SLP), similar con P o B (rango: 6,2-6,9 meses); igualmente se asocia a un incremento del coste farmacológico. Por ello, los autores3 analizan el ratio coste-efectividad incremental de las nuevas combinaciones de fármacos en el tratamiento del CPNM, para ofrecer resultados que apoyen las decisiones terapéuticas.
Se diseñó un modelo farmacoeconómico en donde se evaluaron 3 alternativas terapéuticas: (P+C), (G+C+B) y (PT+C+B), tomando los valores clínicos de los correspondientes ensayos de fase III PARAMOUNT, AVAIL y SAIL, respectivamente. Dada la perspectiva adoptada, del servicio de farmacia del hospital, se incluyeron únicamente los costes farmacológicos (€, 2015). A éstos se les restó la deducción obligatoria establecida por el RD 8/2010 del 7,5%. La dosis de los fármacos se estimaron en base al peso (70,15 kg) y altura media (1,78 m), así como a un nivel medio de creatinina plasmática (0,6 mg/dL). Dada la supervivencia de los pacientes, cuyo tratamiento no superaba el año, se estimó un horizonte temporal de 12 meses.
Se estimó para cada alternativa el porcentaje de pacientes que entraron en la fase de mantenimiento: (G+C+B) 42%; (C+P) 57%; y (CP+P+B) 53%; a partir de ello se estimó el coste medio por paciente, resultando la alternativa (G+C+B) ser menos costosa; por su parte, la combinación (P+C) fue la más eficaz (Tabla 2).
|
Tabla 2 |
|||
|
|
SLP (meses) / ciclos en inducción |
Coste (€) |
RCUI (€/mes libre de progresión |
|
(C+P) |
6,9 meses/ 4 ciclos |
19.442 € |
19.304 €/mes |
|
(G+C+B) |
6,7 meses/ 6 ciclos |
15.595 € |
|
|
(CP+P+B) |
6,2 meses/ 6 ciclos |
36.096 € |
Dominado |
La mayoría de los análisis de sensibilidad mostraron la robustez de los resultados. Sin embargo, la reducción del 30% en el coste de pemetrexed, suponiendo que se incorporase un genérico del mismo, haría que esa opción menos costosa fuera la de (C+P), pasando a ser opción dominante al mostrar una eficacia superior y un coste inferior.
Los autores concluyen que, en el momento actual, la combinación (C+P) (cisplatino + pemetrexed) es la más eficiente, sin embargo, en el momento que se incorporara un genérico de pemetrexed, dicha combinación pasaría a ser dominante en base a su menor coste y mayor eficacia.








