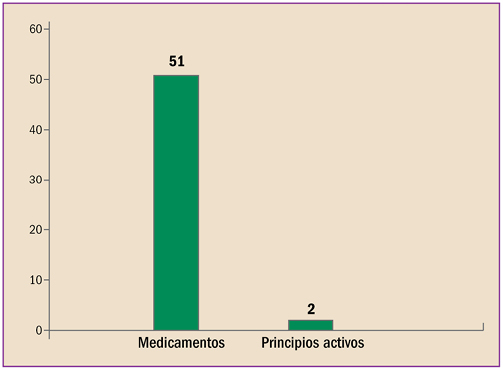
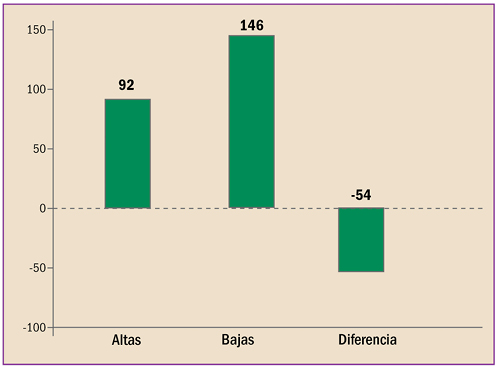
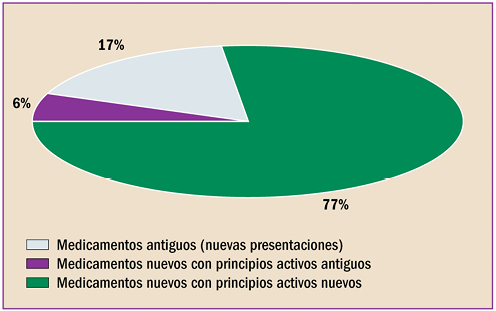
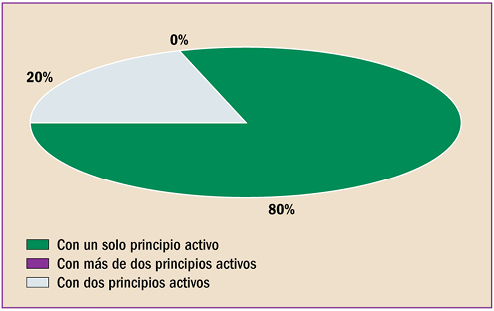
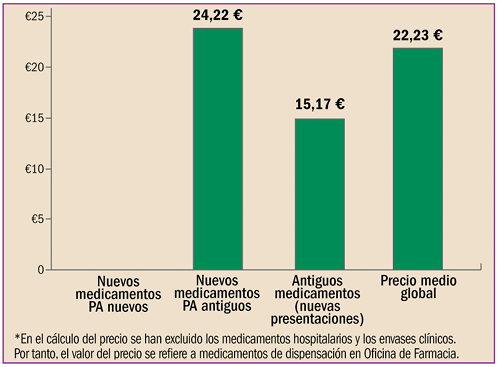
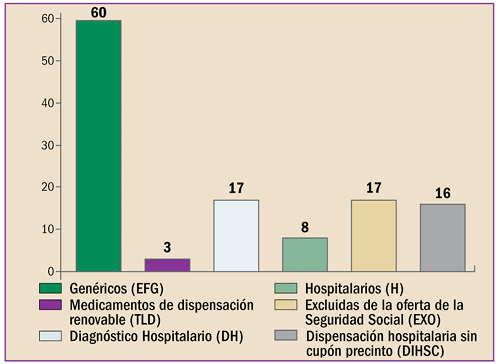
La farmacovigilancia se ha desarrollado en España durante estos últimos 40 años, en paralelo al periplo de la revista “Panorama Actual del Medicamento”. Con sus primero pasos desde 1974, ha alcanzado desde abril de 1997 un trayecto firme y continuado, durante sus 400 números. Hoy está consolidada como una fuente terciaria de información básica sobre medicamentos, dirigida a todos los profesionales sanitarios. Así mismo, la farmacovigilancia en España, desde sus primeros pasos en 1973, ha crecido, se ha desarrollado y se ha establecido como Sistema Español de Farmacovigilancia de medicamentos de uso Humano (SEFV-H), alcanzando una estructura y funcionamiento ejemplar, en el entorno europeo y global.
Desde 2012, con un nuevo marco normativo europeo, la farmacovigilancia española mantiene una actividad dinámica y con proyección de futuro. Y no solo con avances en España. Recientemente, desde hace 4 años se ha puesto en marcha un proyecto de traslación tecnológica para adaptar el modelo del SEFV-H a la región de Centroamérica formada por 8 países.
Vidas paralelas, del “Panorama…” y del SEFV-H, siempre orientadas a la Seguridad del medicamento, para sustentar la Seguridad del paciente.
¡¡Larga vida para la revista “Panorama…” y larga vida para el SEFV-H!!

Figura 1.Número 1 de Panorama Actual del Medicamento ym modelo actual de tarjeta amarilla del SEFV-H.
En estos 40 años últimos, la farmacovigilancia en España, ha nacido, se ha desarrollado e implantado en toda la geografía española, está dando frutos y presenta un futuro estable. Todo ello de manera paralela a como ha transcurrido la andadura de esta revista “Panorama Actual del Medicamento” desde los años setenta. En particular, desde 1974 la publicación mensual titulada “Nuevas Especialidades, Consideraciones Farmacológicas” editada desde el Consejo General de Farmacéuticos durante 2 años, fue el germen y sentó las bases del primer número del “Panorama…”, publicado en abril de 1977. Y en ese primer número del “Panorama…” ya se incluía una reseña sobre el problema de la fenformina por el riesgo de acidosis láctica, que motivó su retirada paulatina desde esos años setenta (ver figura 1). Un ejemplo de la amplia cobertura temática del mundo del medicamento que contemplaba el “Panorama…”, la seguridad del medicamento.
Primeros pasos en farmacovigilancia
De manera similar, es en los años setenta cuando la farmacovigilancia hace acto de presencia en España. Todo como respuesta mundial al episodio gravísimo de focomelia (meromelia) asociado al uso de talidomida, identificado en 1960. Así, en noviembre de 1973 se publica una Orden del Ministerio de la Gobernación, en la que se establece por primera vez el marco de la farmacovigilancia en España. En ella se estableció la obligación de notificar las sospechas de reacciones adversas a medicamentos (RAM) para los laboratorios farmacéuticos titulares de los medicamentos. Igualmente, se obligaba a notificar las sospechas de RAM a todos los profesionales sanitarios. Durante casi diez años solo hubo algunas decenas de notificaciones y poca actividad en el Centro Nacional de Farmacobiología, entonces, centro de referencia establecido en esa orden ministerial.
No es hasta 1983 cuando se relanza en España la actividad en farmacovigilancia, a la vista de los buenos resultados de un proyecto de investigación sanitaria (FIS). Estaba dirigido por el profesor Joan Ramón Laporte, para implantar en Barcelona la “notificación espontánea” de RAM, mediante la tarjeta amarilla. De la mano de la Dirección General de Farmacia, del entonces Ministerio de Sanidad, es cuando la farmacovigilancia inicia sus pasos seguros y sin retorno: se van creando centros regionales en cada una de las Comunidades Autónomas, por acuerdo en el Consejo Interterritorial del Sistema Nacional de Salud en 1989; se crea el primer órgano colegiado asesor del Ministerio de Sanidad, la Comisión Nacional de Farmacovigilancia; y se asignan los trabajos de coordinación al Centro Catalán, ubicado en el Servicio de Farmacología Clínica del Hospital Universitario de la Vall d’Hebrón, dirigido por el profesor Laporte. Y es en 1984, cuando España se incorpora al Programa Internacional de FV de la OMS.
A partir de la Ley General de Sanidad de 1986 y de la Ley del Medicamento de 1990, se decide asignar la coordinación del SEFV-H al Centro Nacional de Farmacobiología, del Instituto de Salud Carlos III creado en 1986. Y es entonces cuando se pone en marcha la primera versión de la base de datos FEDRA (Farmacovigilancia Española Datos de Reacciones Adversas) con todos los datos acumulados desde 1983, con una red formada por los Centros Autonómicos existentes. No es hasta 1999 cuando se concluye la puesta en funcionamiento de los dos últimos centros regionales1. En ese año coincide con la creación de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Situación actual
Desde 1999 hasta la actualidad, la red del SEFV-H se integra por 17 Centros Autonómicos y un Centro Coordinador en la AEMPS, en la División de Farmacoepidemiología y Farmacovigilancia. España participa como estado miembro de la Unión Europea, en la actividad reguladora de nuevos medicamentos, de su control, y en actividades de farmacovigilancia a través de la AEMPS con sus representantes en el Comité europeo para la Evaluación de Riesgos en Farmacovigilancia (PRAC) con reuniones mensuales en la EMA.
El sistema europeo de farmacovigilancia, a su vez, se coordina por la Agencia Europea de Medicamentos (EMA). La AEMPS colabora en materia de farmacovigilancia con la Red de Agencia de Medicamentos de uso Humano (HMA) a través de su Comité de Coordinación para Medicamentos de Reconocimiento Mutuo y Descentralizado de uso humano (CMD-h), para el resto de medicamentos.
En el momento actual, el SEFV-H representa2 un sistema nacional ejemplar de farmacovigilancia en el entorno de los 28 Estados miembros de la Unión Europea. En el SEFV-H se integran las competencias de las autoridades sanitarias de las 17 Comunidades Autónomas, responsables de sus respectivos centros. Esta red se coordina a través del Comité Técnico del SEFV-H, órgano colegiado de la AEMPS, que permite programar y armonizar actuaciones, criterios de evaluación de notificaciones, y validar “señales” de nuevos riesgos de medicamentos identificadas por los centros. Todo ello con reuniones mensuales, unas presenciales y otras virtuales mediante plataforma para conferencias web.
Novedades y futuro de la farmacovigilancia
En los 4 últimos años se han ido incorporando nuevos aspectos de la nueva regulación europea en materia de farmacovigilancia: desde enero de 2013 se dispone de una página web www.notificaRAM.es, para notificar electrónicamente las sospechas de RAM, tanto por parte de los profesionales sanitarios como de los ciudadanos directamente, como vía complementaria para notificar las RAM que ellos mismos detecten.
Durante este siglo XXI podemos decir que los pacientes como ciudadanos alcanzarán la “mayoría de edad”, como participantes en el sistema sanitario y como responsables de su propia salud. Es el conocido “empoderamiento” del paciente, en todas las decisiones que afecten a su salud. Es por ello que todas estas nuevas reglas europeas se dirigen hacia una mayor participación de los ciudadanos. Como ejemplo, se incluyen medidas dirigidas a los pacientes al incorporar en las nuevas normativas3 europeas la actividad del “seguimiento adicional” de los medicamentos con nuevas moléculas y de todos los biosimilares. Así, en las cabeceras de los prospectos de los medicamentos con moléculas nuevas, junto al nombre del medicamento se antepone un triángulo negro invertido (▼), que indica a los pacientes que al ser medicamentos nuevos, con menos de 5 años en el mercado, se les invita a leer el párrafo sobre RAM, en el que se recomienda notificar toda reacción adversa que se detecte. Esta sugerencia de notificación se dirige a los pacientes para que comuniquen sus RAM a los profesionales sanitarios, o bien lo hagan directamente a través de la página web www.notificaRAM.es. Se ofrece así un método sencillo de notificación, que además facilita su gestión, pues cada notificación llega electrónicamente al centro autonómico correspondiente. En las bandejas de entrada de cada centro se ordenan los casos por orden de llegada. A continuación, cada centro revisa, valida y, si es necesario, codifica y completa la información para cargar cada caso en la base de datos FEDRA. En ese momento está disponible para todos los centros del SEFV-H. Y como paso final se envía electrónicamente a la EMA, a su base de datos EudraVigilance, si el caso es “grave”. Por otra parte se envían todos los casos nuevos, sean graves o no, al Centro Colaborador de la OMS para FV en Uppsala, el Uppsala Monitoring Centre.
El futuro inmediato ofrecerá herramientas para identificar nueva información, incluso a través de las redes sociales, para reunir datos sobre posibles nuevos riesgos de medicamentos. El conocido “Big Data” y el “Real World Evidence” ofrecerán datos para la “Farmacovigilancia del Futuro”.
Actualmente la información de FEDRA es accesible para todos los profesionales sanitarios, a través de los centros autonómicos correspondientes a su ámbito geográfico. Ésta es otra de las ventajas que presenta el SEFV-H: la proximidad y cercanía de los centros de farmacovigilancia a los profesionales de la salud, como centro de referencia en materia de seguridad de medicamentos y de consulta terapéutica. Al igual que otras agencias, la AEMPS programa ofrecer en su página web datos agregados de FEDRA.
El SEFV-H como modelo de referencia
El SEFV-H sirve de modelo, junto con su experiencia de más de 30 años de existencia, para que otras regiones lo elijan como solución. Así desde 2013, la AEMPS trabaja en un proyecto4,5 de traslación tecnológica para adaptar la red de FEDRA a la región de Centroamérica y República Dominicana, en la que los 8 centros nacionales compartirán la información reunida en una sola base de datos, FACEDRA. Un paso más de colaboración entre autoridades reguladoras, en particular en materia de farmacovigilancia. Esto representa una solución original y única en la historia, mediante una colaboración regional de varios países para trabajar en farmacovigilancia con una misma base de datos.
Por último, solo nos resta desear “Larga Vida al SEFV-H”, de la misma forma que deseamos “Larga Vida para la revista “Panorama…”. La ‘seguridad de los medicamentos’ lo requiere, y nuestra sociedad lo necesita, para alcanzar una óptima “seguridad del paciente” en el uso de los medicamentos.
Referencias
- Manso G, Hidalgo A, Carvajal AQ, De Abajo FJ (coord.). Los primeros 25 años del Sistema Español de Farmacovigilancia. Ediciones Universidad de Oviedo, 2010. Disponible en la página web: http://www.unioviedo.es/gaife/index.php?option=com_content&view=article&id=96: libro25anios (citado 01 febrero 2017).
- Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano. BOE núm. 179, de 27 de julio de 2013. Disponible en la web: http://www.boe.es/diario_boe/txt.php?id=BOE-A-2013-8191 (citado 02 febrero 2017)
- AEMPS. Medicamentos sujetos a “Seguimiento adicional”. Lista europea de medicamentos sujetos a seguimiento adicional, con triángulo negro invertido (▼). Disponible en la web de la AEMPS: https://www.aemps.gob.es/vigilancia/medicamentosUsoHumano/seguimiento_adicional.htm (citado 02 febrero 2017)
- AEMPS. Implementación de un Sistema de Farmacovigilancia en la Región de Centroamérica y República Dominicana. 16 de octubre de 2013. Referencia: AEMPS 15/2013. Disponible en la página web de la AEMPS: https://www.aemps.gob.es/informa/notasInformativas/laAEMPS/2013/docs/NI-AEMPS_15-2013-sistema-FV-centroamerica.pdf (citado 02 febrer4o 2017)
- AEMPS. Celebración del taller sobre el Sistema de Farmacovigilancia Centroamericana de reacciones adversas a medicamentos (FACEDRA) Disponible en la página web de la AEMPS: https://www.aemps.gob.es/informa/notasInformativas/laAEMPS/2015/NI-AEMPS_09-2015-facedra.htm (citado 02 febrero 2017)
IMPORTANTEEl Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) se basa en el programa de notificación espontánea de un profesional sanitario (médico, odontólogo, farmacéutico, enfermero, otros) de una sospecha de relación entre un medicamento (incluidos vacunas, sueros, gases medicinales, fórmulas magistrales, plantas medicinales) y un síntoma o signo adverso (reacción adversa, RAM) que manifieste el paciente (programa de tarjeta amarilla). El Real Decreto 577/2013 de Farmacovigilancia de medicamentos de uso humano (BOE núm. 179, de 27 de julio de 2013) entró en vigor el 28 de julio de 2013. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) coordina el SEFV-H. |
| ¿DÓNDE CONSULTAR LAS FICHAS TÉCNICAS Y PROSPECTOS DE LOS MEDICAMENTOS?En la página web de la AEMPS http://www.aemps.gob.es >> seleccionando >> ”CIMA: Centro de Información on-line de Medicamentos de la AEMPS, Humanos”, se pueden consultar por nombre comercial o por sus principios activos. También están disponibles en la base de datos BOT Plus.
NOTA: la mención de marcas comerciales en el texto solo tiene fines de identificación, y en absoluto se les debe asignar directamente lo descrito en el texto. |