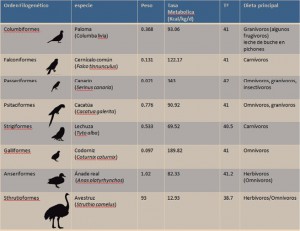
El cáncer de próstata presenta una gran incidencia y mortalidad en los países desarrollados. Un 10-20% de los casos se corresponde con la forma de cáncer de próstata resistente a castración (CPRC), estando la mayoría en estadio avanzado, con metástasis (CPRCm). El tratamiento en esta fase se realiza mediante una deprivación androgénica o castración para suprimir la producción de andrógenos, los cuales contribuyen a estimular el crecimiento de las células de la próstata. Los estudios realizados con enzalutamida (ENZ) y abiraterona más prednisona (ABI-P) ha mostrado un aumento de la supervivencia del paciente (mediana de supervivencia: 35,3 y 34,7 meses, respectivamente).
El coste de un tratamiento no es únicamente el de los fármacos utilizados, sino que otros tipos de costes se hallan totalmente asociados, por lo que es imprescindible su evaluación total, a fin de comprender cuál es el verdadero coste de una alternativa terapéutica. El tratamiento del CPRCm presenta una gran utilización de recursos adicionales al de los fármacos administrados (ENZ o ABI-P), tales como el manejo de los efectos adversos, la monitorización del paciente, terapias posteriores, el manejo del paciente en progresión y los cuidados paliativos previos a la muerte. Por ello, los autores1 estiman el número necesario a tratar (NNT) –definido como el inverso del beneficio incremental entre ambas opciones, que representa el número de pacientes que es necesario tratar con una alternativa para obtener una unidad adicional de respuesta– y el coste incremental en la obtención de varias respuestas: paciente libre de progresión o muerte, retraso en la administración de la quimioterapia o aumento de la supervivencia. La perspectiva adoptada en el estudio fue la del pagador en EE. UU., incluyendo por tanto los costes de los fármacos, la monitorización, los eventos adversos, los tratamientos tras la progresión y los cuidados paliativos. El horizonte temporal fue de un año a partir de la administración de los fármacos.
Los datos clínicos incorporados al estudio se tomaron de los ensayos clínicos (PREVAIL para ENZ y COU-AA-302 para ABI-P). Ambos estudios evaluaron los tratamientos oncológicos en pacientes con CPRCm, asintomáticos o con sintomatología leve, que no habían sido tratados previamente con quimioterapia. Los resultados de estos estudios incluyeron la supervivencia libre de progresión radiográfica, tiempo hasta el inicio de la quimioterapia y supervivencia general como variables primarias.
Los datos de costes y uso de los medicamentos (ENZ y ABI-P) se extrajeron de los precios públicos, utilizando las dosis indicadas en las fichas técnicas y los tiempos de tratamiento de los datos de los ensayos clínicos, para el cálculo de la utilización de los mismos. Los costes de la monitorización se estimaron a partir de la información de las fichas técnicas y de los precios públicos utilizados para aquellos. Los efectos adversos de grado 3 y 4, con frecuencia ≥1%, se estimaron a través de la información ofrecida en los estudios realizados con ambos fármacos, así como los incluidos en sus fichas técnicas; los costes correspondientes al manejo de los mismos se tomaron de la literatura. El coste del paciente en progresión se estimó mediante el coste de la hospitalización por dicho motivo y el del tratamiento administrado con posterioridad a la progresión se estimó con el coste de los fármacos aplicados (sipuleucel-T, docetaxel, cabazitaxel o retratamiento con el fármaco alternativo: ENZ en tratados con ABI-P y viceversa). El coste de los tratamientos previos a la muerte se correspondió con el de los cuidados paliativos administrados.
Los resultados mostraron un coste incremental favorable a ENZ, al mostrar un coste por paciente tratado inferior al estimado con ABI-P (diferencia: 2.666 $), dado que, aunque el coste farmacológico fue superior con ENZ, los costes del manejo de los efectos adversos y de los tratamientos posteriores a la progresión fueron inferiores, revirtiendo entonces el resultado final (Tabla 1). El NNT para la supervivencia libre de progresión radiográfica fue de 14 cuando se comparó ENZ versus ABI-P –esto es, se necesita tratar sólo 14 pacientes con ENZ para obtener una unidad adicional de beneficio respecto del tratamiento con ABI-P. El valor del NNT respecto de retraso de la quimioterapia fue de 26 con ENZ; finalmente, respecto de la supervivencia general, el NNT estimado fue de 91 respecto de ENZ. En definitiva, el tratamiento con ENZ se mostró dominante respecto de la combinación ABI-P al presentar un menor coste y un mayor beneficio. Los análisis de sensibilidad determinísticos de tipo univariante confirmaron la robustez de los resultados obtenidos en el estudio; sólo la diferencia de costes entre las opciones evaluadas mostró una mayor sensibilidad respecto del tratamiento post progresión.
|
Tabla 1 |
|||
|
Coste |
ENZ ($) |
ABI-P ($) |
Diferencia ($) |
|
Fármacos |
77.791 |
70.911 |
6.880 |
|
Monitorización |
697 |
933 |
-236 |
|
Efectos adversos |
1.361 |
4.011 |
2.650 |
|
Cuidados paliativos |
1.449 |
1.643 |
-194 |
|
Coste total |
94.440 |
97.105 |
-2.666 |
Los autores concluyen que el resultado obtenido sugiere que enzalutamida es una alternativa dominante respecto de abiraterona más prednisona en el tratamiento de pacientes con cáncer de próstata metastásico resistente a castración que no han sido tratados previamente con quimioterapia. Ello se debe a la estimación de un menor coste total, así como de la consecución de un mejor resultado clínico (progresión radiográfica, supervivencia general y retraso en la quimioterapia).