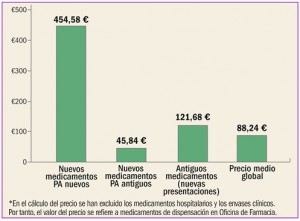
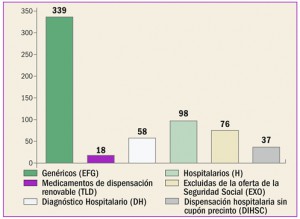
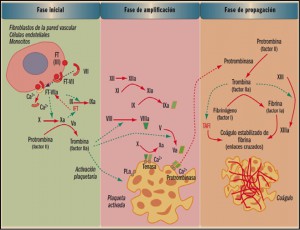
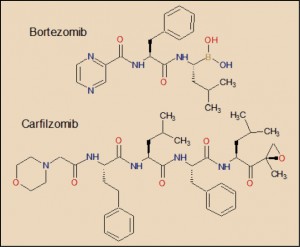
La agencia reguladora japonesa ha informado del riesgo de reactivación de hepatitis vírica B identificado en pacientes tratados con los nuevos antivirales frente a la hepatitis C. Estos datos se incluirán en la información de los medicamentos correspondientes.
La Agencia Japonesa de Medicamentos (Pharmaceutical and Medical Devices Agency, PMDA) ha informado1 en el pasado mes de mayo de 2016 sobre el riesgo de reactivación de hepatitis B en pacientes tratados de hepatitis C con los nuevos antivirales de acción directa.
La autoridad japonesa ha anunciado que se actualizarán la ficha técnica y el prospecto de varios antivirales frente a la hepatitis C (telaprevir, simeprevir sódico, daclatasvir, asunaprevir, vaniprevir, sofosbuvir, acetonato de ledipasvir/ sofosbuvir y ombitasvir) para incluir precauciones en su utilización en pacientes actualmente infectados, o con antecedentes en su historia clínica, de infección por el virus de la hepatitis B.
Los antivirales de la hepatitis C se utilizan para mejorar la viremia en pacientes con infecciones crónicas por hepatitis C. Se utilizan diferentes medicamentos para serogrupos y genotipo específicos, por ejemplo, el sofosbuvir (Sovaldi®) se utiliza en pacientes con serogrupo 2 (genotipo 2) y asunaprevir se utiliza en el serogrupo 1 (genotipo 1).
Los casos de reactivación de la hepatitis B notificados con simeprevir (Olysio®), daclatasvir, asunaprevir, sofosbuvir (Sovaldi®) y ledipasvir acetonate/sofosbuvir (Harvoni®) han sucedido en Japón, así como otros casos fuera de Japón.
Se cree que el aumento de la carga viral de la hepatitis B se asocia con una disminución de la carga viral de la hepatitis C, después de iniciar el tratamiento con antivirales de acción directa de la hepatitis C. Los antivirales de acción directa de la hepatitis C, para los cuales no hubo informes de reactivación del virus de la hepatitis B en todo el mundo y en Japón, pueden tener el mismo riesgo. Sería el caso de los antivirales boceprevir (Victrelis®), grazoprevir (Zepatier®), ombitasvir/paritaprevir (Viekirax®), telaprevir (Incivo®) y vaniprevir.
Recomendaciones
La autoridad de medicamentos del Japón, concluyó que era necesario revisar el prospecto e incluir esta información sobre reactivación de hepatitis B, tras una investigación de las pruebas disponibles y con el asesoramiento de expertos.
Referencias
- Pharmaceutical and Medical Devices Agency, PMDA (MHLW&PMDA). Revision of Precautions, 18 May 2016. Disponible en: http://www.pmda.go.jp/english (citado 25 noviembre 2016)
IMPORTANTEEl Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) se basa en el programa de notificación espontánea de un profesional sanitario (médico, odontólogo, farmacéutico, enfermero, otros) de una sospecha de relación entre un medicamento (incluidos vacunas, sueros, gases medicinales, fórmulas magistrales, plantas medicinales) y un síntoma o signo adverso (reacción adversa, RAM) que manifieste el paciente (programa de tarjeta amarilla). El Real Decreto 577/2013 de Farmacovigilancia de medicamentos de uso humano (BOE núm. 179, de 27 de julio de 2013) entró en vigor el 28 de julio de 2013. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) coordina el SEFV-H. |
| ¿DÓNDE CONSULTAR LAS FICHAS TÉCNICAS Y PROSPECTOS DE LOS MEDICAMENTOS?En la página web de la AEMPS http://www.aemps.gob.es >> seleccionando >> ”CIMA: Centro de Información on-line de Medicamentos de la AEMPS, Humanos”, se pueden consultar por nombre comercial o por sus principios activos. También están disponibles en la base de datos BOT Plus.
NOTA: la mención de marcas comerciales en el texto solo tiene fines de identificación, y en absoluto se les debe asignar directamente lo descrito en el texto. |