ENFERMEDADES PARASITARIAS
ASCARIOSIS
Ascaris suum, es un parásito del cerdo que se localiza en el intestino delgado. Su ciclo de vida hace que alcance el hígado y los pulmones. En infestaciones grandes el daño pulmonar suele causar una gran mortalidad y genera grandes pérdidas económicas. Afecta especialmente a cerdas y cerdos en las fases de transición y cebo, alcanzando la tasa más alta en lechones de 2 a 5 meses y declinando con el aumento de la edad. Como los cerdos mantienen el mismo contacto con el suelo a cualquier edad se considera que la diferencia puede deberse a cierto grado de inmunidad adquirida contra la infestación. Hay evidencias de una respuesta inmune frente a larvas L2 y L3. La respuesta inmune es bifásica es decir, una respuesta inmune contra las larvas y otras contra los adultos. Los adultos son expulsados del intestino por una reacción de autocuración
La infestación se realiza por la ingestión de huevos larvados e infestantes, que se encuentran en el agua, alimentos, adheridos a la piel de las mamas, en las camas, pastos, etc. Los escarabajos y anélidos como la lombriz de tierra, pueden albergar fases infestantes. Las prácticas de manejo influyen de manera determinante en los niveles de contaminación y el riesgo de adquirir la enfermedad. También el desarrollo de una inmunidad protectora es un factor importante que influye en la epidemiología y niveles de helmintosis, pudiendo ser modificado con las prácticas de manejo tanto en explotaciones intensivas como extensivas.
Diagnóstico: tras la observación de vermes que han sido eliminadas en las heces, mediante técnicas coprológicas, visualización de huevos o técnicas de flotación. Algunos autores consideran que 5.000 H. P. G. representa ya una parasitosis grave. El diagnóstico inmunológico se realiza mediante antígenos excretores-secretores (ES) de L3 que han demostrado ser los de mayor especificidad, comparando con los antígenos ES de L3/L4 y el antígeno del fluido pseudocelómico. Se debe hacer diagnóstico diferencial con estrongiloidosis, metastrongilosis, neumonia eosinofilica y otras enfermedades bronquiales o pulmonares de origen bacteriano.
Control y tratamiento: imidazoles y benzimidazoles por vía oral o inyectados como levamisol, fenbendazol (con efecto ovicida), cambendazol o tartrato de morantel. La ivermectina y la doramectina, han demostrado gran efectividad sobre todos los géneros de helmintos en sus formas maduras e inmaduras.
|
Tabla 1. Definiciones según RD 1135/2002 |
||||
|
Programa |
Lechones |
Engorde |
Cerdas |
Padrillos |
|
1 |
A los 30 y 60 días |
A los 90 y 120 días |
Antes del parto |
4 veces al año |
|
2 |
Al destete |
A los 120 días |
Antes del parto |
2 veces por año |
|
3 |
Continuo en ración |
Continuo en ración |
En ración |
En ración |
COCCIDIOSIS
Las coccidiosis son causadas por parásitos protozoarios intracelulares producida por diversas especies pertenecientes a los géneros Eimeria, Isospora, Neospora, Cryptosporidium y Toxoplasma que invaden el intestino delgado preferentemente de animales jóvenes, produciendo la destrucción de los enterocitos y provocando diarrea entre los 7 y 14 días de vida. Isospora Suis es el de mayor prevalencia en lechones. Ocasionalmente también se observa en cerdos en crecimiento y acabado y en verracos cuando se trasladan o alojan en corrales infectados de uso continuo.
Tras un periodo de prepatencia de 3-4 días, los lechones de más de 5 a 7 días de vida y hasta la 3 semana de vida, eliminan heces sueltas o pastosas que huelen a leche ácida, son acuosas, blanquecinas, blanco amarillentas o grisáceas; desciende el apetito, hay retraso en el crecimiento por deshidratación, ligera palidez de las mucosas y erizamiento piloso.
Como resultado de la infección por coccidios la incidencia de infecciones bacterianas secundarias aumenta. La mortalidad es moderada (menos del 20%) pero la morbilidad es muy alta. Las camadas con coccidiosis ven afectado su crecimiento antes y después del destete.
Diagnóstico: es mejor tomar muestras fecales para su examen en el laboratorio de cerdos en vías de recuperación que de animales con diarrea. El diagnóstico es más fácil aún si se envía un cerdo vivo al laboratorio para el examen histológico de la pared intestinal. Es preciso tener en cuenta que la eliminación de los ooquistes tiene lugar en dos o tres ciclos correspondientes a los ritmos de reproducción sexuada, separados por períodos de 5 días, lo cual complica encontrar ooquistes en las muestras mediante flotación de los mismos en soluciones densas (NaCI o sulfato de zinc al 33%). Es aconsejable realizar un análisis cuantitativo en cámara de McMaster. También se utilizan técnicas inmunológicas de inmonoflourescencia ya que tienen mayor sensibilidad y especificad.
Control/prevención: se utilizan diferentes coccidiostáticos y coccidicidas como toltrazuril via oral entre los días 3 a 5 de vida d forma preventiva. Monensina, diclazurilo, metronidazol, amprolium, furazolidona y sulfamidas actúan frente a todas los estadios del parasito e impiden su reproducción, demostrando que aunque no siempre disminuyen la eliminación de ooquistes al menos, mejoran sustancialmente el estatus clínico.
CRIPTOSPORIDIOSIS
Cryptosporidium es un parásito intracelular parecido a los coccidios (ver up supra) y que también puede causar diarrea a edades ligeramente superiores (8 a 21 días). Afecta a lechones lactantes y de transición. Cryptosporidium suis, Cryptosporidium porcino genotipo II y Cryptosporidium parva en cerdos son las especies más comunes. Pueden infectar al hombre y también se encuentran en otras especies como las ratas y ratones. No es una patología frecuente.
Diagnóstico: para determinar algunas o todas las especies/genotipos o subtipos de Cryptosporidium se puede utilizar sistemas de tipificación y subtipificación (tanto en veterinaria como en humana) como la reacción en cadena de la polimerasa (PCR) y el análisis del polimorfismo de fragmentos de restricción (RFLP) y/o la secuenciación. También se utiliza identificación en heces por flotación, sedimentación (centrífuga formol/éter), tinción, ELISA…
Prevención y control: no hay un tratamiento establecido ni vacunación.
TOXOPLASMOSIS
La infección por Toxoplasma gondii es subclínica habitualmente pero tiene gran importancia por su potencial zoonótico. Toxoplasma es un protozoo que se puede encontrar en el alimento o agua contaminada (ver coccidiosis). Dado el carácter omnívoro del porcino, estos animales tienen grandes posibilidades de adquirir ooquistes esporulados al consumir quistes tisulares de otras especies como roedores, aves. La transmisión puede ocurrir en el útero (figura 1).
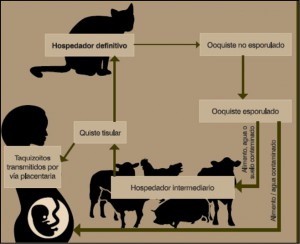
Afecta a cerdas y lechones. Los gatos pueden transmitir el parásito mediante sus heces, contaminando el pienso e infectando a los cerdos. La seroprevalencia en España es muy variable según regiones y tipo de explotación (2,9-92,8%) pero la media es del 16,6% similar a otros países europeos, siendo la edad el factor principal seguido de la ausencia/presencia de programas específicos para el control de roedores y la presencia/ausencia de gatos en la explotación. Si bien la toxoplasmosis no es un problema serio para las explotaciones de porcino, su repercusión en la salud pública es importante debido al riesgo de consumir carnes no cocinadas adecuadamente que puedan contener quistes tisulares.
Prevención y control: no hay tratamiento establecido.
HYOSTRONGILOSIS
Hyostrongylus rubidus o gusano rojo de estómago, afecta al estómago de los cerdos pudiendo causar gastritis. Afecta a cerdas y cerdos en las fases de transición y cebo. Las larvas producen nódulos en la mucosa gástrica que llevan a la destrucción parcial del tejido glandular. Los adultos producen gastritis, a veces ulcerosa o catarral, con abundante producción de mucus. Las infecciones son a menudo mixtas con otros helmintos. Los síntomas típicos son apetito variable, anemia, gastritis, diarrea, pérdida de peso. En casos extremos de hemorragias por ulceración pueden provocar la muerte.
Diagnóstico: los huevos de Hyostrongylus rubidus se parecen a los de Oesophagostomum y a los de Trichostrongylus axei. En caso necesario se puede llevar a cabo una identificación directa mediante el cultivo de los huevos de las heces hasta que aparezcan las larvas o mediante el examen post-mortem de la mucosa del estómago.
Prevención y control: hay que eliminar el estiércol y procurar que los establos estén secos disminuyendo así el riesgo de infección. Como el paso de los huevos a larvas infectivas dura al menos 5 días, hay que eliminar regularmente el estiércol con intervalos menores puede romper el ciclo, lo que disminuirá la infectividad del entorno. La mayoría de los benzimidazoles de amplio espectro (albendazol, fenbendazol, oxfendazol) son eficaces incluso frente a larvas inhibidas, al igual que ciertos endectocidas como abamectina, doramectina, ivermectina y moxidectina. El levamisol y el pirantel controlan sólo a los adultos.
METASTRONGILOSIS
Metastrongylus spp o gusano de pulmón causa neumonía en cerdos. Se localiza en bronquios y bronquiolos. Diversas especies de lombrices terrestres (Lombricus, Eisenia, Helodrilus, etc.) actúan como hospedadores intermediarios. La infección pulmonar con Metastrongylus spp. afecta a cerdas y cerdos en transición y cebo. Los lechones y cerdos jóvenes presentan disminución del aumento de peso y alteraciones respiratorios debido a infecciones secundarias. Se sospecha que pueden transmitir el virus de la gripe porcina y de la fiebre porcina (cólera porcino).
Control y prevención: el mejor modo de prevenir la enfermedad es evitar que entren en contacto y consuman lombrices de tierra, especialmente los lechones y cerdos jóvenes. Los endectocidas y benzimidazoles de amplio espectro (albendazol, fenbendazol, oxfendazol…) y el levamisol aplicado repetidamente vía oral son eficaces contra este nematodo.
TRICHUROSIS
Trichuris suis o gusano látigo parasita principalmente el intestino grueso en cerdos en crecimiento causando diarreas. Tienen un ciclo vital directo: tras salir del hospedador a través de las heces, las larvas infectivas se desarrollan dentro de los huevos (3 o más semanas en el exterior). Estos huevos infectivos son muy resistentes al frío y a la sequía y pueden sobrevivir en el entorno durante años. Los huevos con las larvas infectivas infectan al hospedador final a través de pastos, aguas u otros alimentos contaminadas con huevos. También pueden afectar a cerdas y cerdos en transición y cebo donde las larvas irritan la mucosa y los adultos penetran en la pared del ciego. El daño es relativamente leve y sin síntomas, salvo en caso de infecciones masivas (pueden causar diarrea acuosa o sangrienta, colitis, pérdida progresiva de peso, anemia y a veces edema)
Prevención y control: se utilizan benzimidazoles (albendazol, fenbendazol, febantel) y endectocidas (abamectina, doramectina, ivermectina, moxidectina).
TRIQUINOSIS
En Europa, la triquinelosis está causada principalmente por Trichinella spiralis. En los cerdos no se presenta con síntomas clínicos pero tiene gran importancia zoonótica. Las larvas se concentran especialmente en el diafragma y en los músculos de las mandíbulas. Estos quistes son infecciosos y, si son ingeridos por otros animales, incluyendo al hombre, pueden causar diarrea y dolores abdominales. La enfermedad en humanos puede progresar y ser muy dolorosa y causar síntomas del sistema nervioso central.
Diagnóstico: en porcinos se suele realizar tras el sacrificio, examinando la carne al microscopio en el matadero o mediante exámenes inmunológicos (ELISA). También se puede utilizar esta técnica para detectar infecciones en el animal vivo o en seres humanos.
Prevención y control: la transmisión a los seres humanos se evita cociendo o congelando la carne de cerdo o de animales salvajes (jabalíes) antes de consumirla. La carne cocida debe alcanzar al menos 80°C. y la congelación debe hacerse al menos a -25°C durante 20 días en trozos de no más de 15 cm de espesor. Normalmente no se trata a los cerdos con antihelmínticos; la carne infectada debe ser decomisada.
PEDICULOSIS o PIOJOS
Pediculosis porcina o piojo del cerdo, es producido por Haematopinus suis, que permanecen toda su vida sobre el hospedador. Las hembras adultas ponen huevos (liendres) uno a uno sobre los pelos, cerca de la piel. Las ninfas también chupan sangre y mudan 3 veces antes de completar su desarrollo en unas 2 semanas. Puede producir anemia además de ser la principal vía de transmisión de la viruela porcina. Puede afectar a todas las edades.
Prevención y control: los animales en buenas condiciones sanitarias son menos propensos a ser atacados por los piojos. Por lo tanto, una medida importante para reducir el riesgo de infestaciones, es mantener los animales sanos y bien alimentados. Es importante que toda la población porcina sea tratada al mismo tiempo, incluso si sólo se detectan síntomas en algunos animales. El tratamiento debe repetirse al menos, a la semana del primero, para provocar la muerte de los piojos que eclosionan de los huevos, ya que estos no se ven afectados por los insecticidas de contacto. Se realizan baños de aspersión o inmersión con organofosforados, piretroides o amidinas. Es muy importante que el tratamiento alcance el interior de las orejas y que cubra toda la superficie del cuerpo. El uso de insecticidas requiere una segunda aplicación en 10-20 días para romper el ciclo de producción. Los endectocidas sistémicos son muy eficaces contra los piojos, tanto inyectables como aditivos para los piensos y no requieren de una segunda aplicación.
SARNA o ROÑA
La sarna es una enfermedad de la piel causada por un ácaro, Sarcoptes scabiei. Las hembras adultas excavan túneles de hasta 3 cm en la piel del hospedador. Ahí depositan los huevos que eclosionan en unos 5 días. Las larvas y las ninfas permanecen en los folículos pilosos o sobre la piel. Los ácaros se encuentran sobre todo en el interior de las orejas y en torno a los ojos y la nariz. La infestación se extiende después al cuello, los hombros, el lomo, etc. La sarna sarcóptica produce importantes pérdidas económicas en la producción porcina por disminuir drásticamente las tasas de crecimiento y los índices de conversión. Afecta tanto a lechones destetados como al ganado adulto
Diagnóstico: la muestra se toma de un rascado de la piel del interior de las orejas y se examina al microscopio.
Prevención y control: al igual que para los piojos, las poblaciones porcinas en malas condiciones sanitarias son más propensas a desarrollar la enfermedad. Por lo tanto, un modo de reducir el riesgo es mantener los animales sanos y bien alimentados. Es crucial tratar a todos los animales de una población, sin olvidar a las cerdas madres, a los lechones o a los verracos, incluso si no muestran síntomas. Se debe repetir el tratamiento al menos una vez, 10 días tras el primero, para matar a los ácaros que han eclosionado de los huevos. Se pueden usar baños de aspersión pero a presión con organofosforados (foxima), piretroides o amidinas. Es muy importante que el tratamiento alcance al interior de las orejas y que cubra toda la superficie del cuerpo. Se requiere una segunda aplicación a los 10-20 días. Los endectocidas inyectables o como aditivos en los piensos no requieren de una segunda aplicación.
OTRAS PARASITOSIS
Cysticercus cellulosae es el estadio inmaduro (cistocercoide, metacestodo) de la Taenia solium en el ganado porcino. Los cisticercos forman quistes sobre todo en la carne (músculo esquelético) y en el músculo cardíaco de los cerdos. El ganado no sufre de ordinario alteraciones fisiológicas graves. El daño económico proviene del decomiso de la canal en matadero. Los tratamientos curativos no están indicados en el ganado.
Echinococcus granulosus es la tenia del perro y otros cánidos (zorros, lobos, coyotes, etc.) que son sus hospedadores finales, produciendo los llamados quistes hidatídicos en el resto de especies que actúan como hospedadores intermediarios. Los quistes hidatídicos aparecen sobre todo en el hígado y los pulmones de los hospedadores intermediarios, pero pueden afectar a otros órganos. El ganado no suele verse afectado negativamente por los quistes hidatídicos, pero los órganos contaminados acaban decomisados en matadero. No obstante es importante prevenir las infecciones para evitar la transmisión accidental a los seres humanos.
Prevención y control: la mejor prevención consiste en impedir que los perros y otros cánidos (lobos, coyotes, etc.) se infecten al consumir órganos contaminados y en evitar el contacto de estos animales con los cerdos. La utilización de cestocidas como praziquantel o epsiprantel son eficaces para el tratamiento de perros o gatos infectados
Dicrocoelium dendriticum: trematodos parásitos de las vías biliares. Los hospedadores intermedios son un caracol y una hormiga. Dicrocoelium puede causar graves daños en el hígado al irritar los conductos biliares y provocar su dilatación e inflamación crónica, que a menudo termina en cirrosis. También puede aparecer edema y anemia por pérdida de sangre. Esta parasitosis puede no provocar síntomas clínicos. El diagnóstico se confirma con la detección de huevos en las heces.
Prevención y control: en cerdos criados en extensivo hay que controlar la presencia de caracoles y hormigas. El tratamiento con benzimidazoles (albendazol, triclabendazol) o probenzimidazoles (netobimín) es eficaz contra los parásitos adultos También el praziquantel parece ser eficaz contra estos trematodos pero si se utiliza a dosis altas.
Fasciola hepatica (Distomum hepaticum) o duela del hígado es muy común en rumiantes y muy poco frecuente en cerdos, aunque los animales de cría en exterior pueden verse afectados. Los órganos predilectos de la fasciola son los conductos biliares del hígado y vesícula biliar. El hospedador intermedio es un caracol (género Lymnaea). Hay varios compuestos eficaces contra fasciolas adultas e inmaduras, como brotianida, closantel, nitroinil, triclabendazol y rafoxanida. El control de los caracoles requiere molusquicidas (p.ej. sulfato de cobre, pentaclorofenato de sodio, niclosamida, etc).
ENFERMEDADES VÍRICAS
DIARREA EPIDÉMICA PORCINA
La diarrea epidémica porcina (DEP) está causada por un coronavirus parecido al que causa la Gastroenteritis Transmisible (GET) y está extendida por Europa y las Américas. El virus daña las vellosidades del intestino y por lo tanto reduce la superficie capaz de absorber; cursa con pérdida de fluidos y deshidratación.
La enfermedad afecta a cerdos de todas las edades (cerdas, lechones lactantes en transición y cebo), pero de forma más severa a los lechones neonatos, alcanzando una morbilidad y mortalidad de hasta el 100%, aunque la mortalidad que disminuye a medida que aumenta la edad. Se trata de una enfermedad contagiosa que se transmite principalmente vía fecal y oral. La transmisión indirecta se efectúa por medio de vehículos que pueden estar contaminados, entre ellos, camiones de transporte de alimentos, vehículos de servicio, personal, equipos y otro tipo de objetos contaminados por heces incluyendo piensos. Se sospecha que los productos de sangre de cerdo contaminada, tales como el plasma secado por aerosol y que se incorporan a las raciones alimentarias de los lechones, constituyen posibles medios de propagación del virus. Sin embargo, múltiples estudios experimentales sugieren que el plasma porcino secado por aerosol no constituye una posible fuente de infección, siempre y cuando se sigan prácticas correctas de producción y normas de bioseguridad.En términos clínicos, se asemeja a otras formas de gastroenteritis porcina con signos como anorexia, vómito, diarrea y deshidratación. La prevención y el control se centran en una bioseguridad estricta y en la detección temprana. No existe tratamiento específico para la enfermedad.
Diagnóstico: se sospecha por los signos clínicos, pero no puede ser diferenciada de GET. Se usan ELISA y tests de fluorescencia de anticuerpos (FAT) para examinar muestras de diarrea o paredes intestinales y sus contenidos. Se confirma la presencia del organismo por medio de PCR. Las lesiones histológicas son características de DEP y GET, por lo tanto se requiere de immunohistoquímica o PCR para confirmar.
Control y prevención: no hay un tratamiento específico. La bioseguridad de la granja debe mantenerse en un nivel muy alto, en especial la introducción de cerdos con un estatus sanitario desconocido; hay que controlar los desplazamientos de cerdos, material y personal, dentro de la explotación; desinfección de los vehículos, equipos y adecuada eliminación de los cerdos muertos y del estiércol.. Se ha demostrado la eficacia de la práctica de ‘todo dentro, todo fuera’ para romper el ciclo de transmisión dentro de la granja. Los anticuerpos maternos a través del calostro de cerdas inmunes pueden proteger a los neonatos de la infección. En muchos países, se dispone y se aplican vacunas contra la DEP. El virus se puede eliminar con desinfectantes fenólicos, con cloro, peróxidos, aldehídos o iodóforos.
GASTROENTERITIS TRANSMISIBLE (GET)
La gastroenteritis transmisible es una enfermedad muy importante y altamente infectiva en cerdos causada producida por un coronavirus. Su presentación clínica es idéntica a la diarrea epidémica porcina. Afecta a cerdas, lechones lactantes en transición y cebo.
Diagnóstico: el cuadro clínico de la enfermedad aguda es casi patognomónico. Con excepción de la diarrea epidémica porcina, no hay otras enfermedades entéricas que se contagien tan rápido y causen la mortalidad tan alta en lechones lactantes. El diagnóstico final de la gastroenteritis transmisible debe realizarse en el laboratorio a partir del intestino de un cerdo muerto recientemente usando el test de anticuerpos fluorescentes. También puede realizarse una PCR en heces. La interpretación de serología es complicada debido a la reactividad cruzada con anticuerpos del coronavirus respiratorio, que es una enfermedad común que sólo afecta el sistema respiratorio.
Control y prevención: no hay un tratamiento específico para la gastroenteritis transmisible. Hay que proporcionar electrolitos y fácil acceso al agua para prevenir la deshidratación y utilizar antibióticos (neomicina) para evitar infecciones secundarias. La bioseguridad es crítica especialmente durante el invierno.
INFLUENZA PORCINA (Gripe)
La influenza porcina es una enfermedad respiratoria de gran importancia por su rápida transmisión y potencial zoonótico. Está causada por numerosos virus Influenza tipo A estrechamente relacionados que se caracterizan por tener la habilidad de cambiar su estructura antigénica y crear nuevas cepas. Cada serotipo es identificado mediante proteínas de superficie llamadas “H” y “N”. Los tres serotipos más comunes que afectan al cerdo son H1 N1, H1 N2 y H3 N2. Existen 16 tipos de hemaglutininas y 9 de neuraminidasas. Hay además diferentes cepas dentro de los serotipos anteriores con diferente patogenicidad y sin protección cruzada. Afecta a cerdas, lechones lactantes en transición y cebo. La vía de transmisión más común de la enfermedad es la nasofaríngea. Tras la entrada, el virus se adhiere a los cilios y se replica en el epitelio del tracto respiratorio anterior; desde ahí se extiende hacia los bronquios y bronquiolos, provocando daños en el aparato mucociliar:
Diagnóstico: en caso de enfermedad aguda se puede realizar un diagnóstico fiable basándose en los signos clínicos, puesto que no hay otras enfermedades que sean tan dramáticas en su transmisión rápida y efectos clínicos. Las muestras de sangre de las cerdas afectadas, tomadas al principio de la enfermedad y 2-3 semanas después, muestran un aumento del título de anticuerpos. El virus de la gripe se puede identificar a partir de hisopos nasales por medio de PCR o ELISA y Kits de captura de antígenos para diagnóstico rápido (muestras nasales o bronquiales) También se pueden utilizar fluidos orales con buenos resultados. Sin embargo, en el caso de enfermedad endémica, puede resultar difícil diferenciarla de otras enfermedades virales (PRRS y Aujeszky).
Control y prevención: se aconseja vacunar de forma periódica a todos los animales, principalmente en otoño y principios de invierno. Hay que evitar someter a los animales a factores estresantes, evitar las variaciones de temperatura y hacer cuarentena de lotes nuevos. También evitar los cambios en la dieta, asegurar una adecuada ingesta de calostro, administrar alimento y agua de calidad y en cantidad suficiente. Las instalaciones deben estar suficientemente aisladas de vías públicas, evitando el paso de animales sensibles a la influenza (caballos y aves).
No existe tratamiento eficaz, solamente tratamiento paliativo (provisión de agua para mantener la hidratación, antipiréticos para la reducción de fiebre y administración de antibacterianos para controlar las infecciones bacterianas concomitantes). Las vacunas del virus de la influenza porcina son la única medida eficaz para el control de la infección y se recomienda en zonas o épocas de alta prevalencia. Las hembras reproductoras individuales o verracos que muestren enfermedad aguda, aumento de la temperatura y velocidad de la respiración, deben ser tratados con antibióticos de amplio espectro para controlar las infecciones bacterianas concomitantes.
SÍNDROME REPRODUCTIVO Y RESPIRATORIO PORCINO (PRRS)
El síndrome reproductivo y respiratorio porcino (PRRS) está causado por un Arterivirus (dos tipos: norteamericano y europeo o Lelystad). El virus es muy susceptible al ambiente y a los desinfectantes y se caracteriza por su gran capacidad para mutar. Afecta a cerdas, verracos, lechones lactantes en transición y cebo. Se transmite fácilmente a través del contacto directo con cerdos susceptibles y vía vertical a los fetos. Se caracteriza por defectos reproductivos de las cerdas y crisis respiratorias de los lechones y cerdos en crecimiento, lo que unido a su rápido potencial de propagación, puede causar significativas pérdidas económicas y productivas.
Diagnóstico: basado en los signos clínicos. El fallo reproductivo se caracteriza por infertilidad, momificación fetal, abortos, agalaxia y nacimiento de lechones muertos o tan débiles, que a menudo mueren poco después de nacer debido a trastornos respiratorios e infecciones secundarias por Salmonella choleraesuis, Haemophilus parasuis, Streptococcus suis, Mycoplasma hyopneumoniae y virus de la influenza porcina. En los lechones las tasas de mortalidad son elevadas.
Se debe realizar la necropsia y detectar la presencia del virus por PCR. Hay varios test disponibles, pero el más usado es el ELISA de anticuerpos estándar. Hoy en día se usan fluidos orales para la monitorización de granjas. La secuenciación del virus sólo puede utilizarse de manera epidemiológica para investigar si hay una cepa nueva y posiblemente, su origen.
Control y prevención: no hay todavía disponible ningún tratamiento efectivo contra el virus. Los elementos clave de un programa de control y erradicación del PRRS son la detección temprana de la enfermedad y su confirmación rápida en laboratorio, así como la inmediata identificación de las explotaciones afectadas y el control de la infección mediante distintas estrategias de sacrificio sanitario. La bioseguridad continúa siendo crítica en la prevención de introducciones nuevas de virus. Dado que el PRRS se transmite por contacto directo es aconsejable, pero no imprescindible, adoptar medidas de control en los mataderos, las plantas de elaboración de productos cárnicos y las zonas de venta. Las animales de reposición deben provenir de explotaciones negativas al PRRSV.
VACUNAS
La prevención de la salud animal se consigue con la utilización de productos biológicos (vacunas). El sistema inmune puede prepararse frente a un determinado microorganismo de manera preventiva, para que si en algún momento apareciera el mismo microorganismo en forma virulenta, sea reconocido de forma rápida y pueda combatirse eficazmente. Esta preparación preventiva, basada en la memoria del sistema inmune, en la que se consigue una respuesta adquirida tanto humoral como celular, se denomina inmunización activa o vacunación. Otra forma de inducir inmunidad a un animal, en un momento determinado y con fines curativos más que preventivos ya que es una inmunidad no duradera, es la denominada inmunización pasiva o sueroterapia.
La sueroterapia, consiste en transferir inmunoglobulinas específicas frente a un determinado antígeno de un animal a otro (generalmente de la misma especie para evitar reacciones adversas de rechazo). Estos anticuerpos se producen en el animal donante tras una respuesta activa mediante diferentes vacunaciones o estimulaciones antigénicas. En la especie porcina, la sueroterapia no se utiliza en la actualidad.
Desde un punto de vista tecnológico, se podrían clasificar los diferentes tipos de vacunas actuales en:
- Convencionales: vivas atenuadas y muertas inactivadas (Tabla 2).
|
Tabla 2. Vacunas porcinas convencionales |
|
|
vacunas vivas/atenuada |
|
|
enfermedad |
programa vacunal |
|
Enfermedad de Aujeszky |
Nulíparas, cerdas y verracos, cerdos |
|
Síndrome respiratorio y reproductor porcino (PRRS) |
Nulíparas, multíparas, lechones |
|
vacunas muertas/inactivadas |
|
|
enfermedad |
programa vacunal |
|
Síndrome respiratorio y reproductor porcino (PRRS) |
Nulíparas, cerdas en gestación y lactación |
|
Pleuroneumonía porcina |
Cerdas, verracos, cerdos de engorde |
|
Enfermedad de Glässer |
Cerdas y lechones |
|
Linfluenza o gripe porcina |
Cerdas gestantes o lactantes, verracos, lechones 30-40 días |
|
Rinitis atrófica progresiva y no prograsiva |
Cerdas gestantes |
|
Enterotoxemia colibacilar, de la enteritis necrótica en lechones y de la enterotoxemia en cerdas |
Cerdas gestantes |
|
Neumonía enzoótica |
Lechón a partir de los 7 días |
|
Mal rojo |
Cerdos de 6 meses, cerdas 2-3 semanas antes de la cubrición |
|
Parvovirosis porcina |
Cerdas a los 6 meses de edad |
|
Parvovirosis porcina/mal rojo/Enfermedad de Aujeszky |
Nulíparas y verracos jóvenes |
|
Parvovirosis porcina/Mal rojo |
Cerdos a los 6 meses de edad, cerdas 2-3 semanas antes de la cubrición |
- De nueva generación (Tabla 3)
|
Tabla 3. Vacunas porcinas de nueva generación |
||
|
Vacunas de nueva generación porcinas |
||
|
proteínas inactivadas |
De subunidades
De proteínas sintéticas |
Fiebre aftosa Peste porcina clásica Parvovirus porcino (experimental)
Fiebre aftosa |
|
vacunas vivas deleccionadas |
|
Enfermedad de Aujeszky |
|
recombinantes vivos |
|
Solo experimental |
|
vacunas de adn |
|
Solo experimental |
PROBIÓTICOS, PREBIÓTICOS, ACIDIFICANTES, ENZIMAS
Debido al incremento de resistencias a los antibióticos y el problema de los tiempos de espera tras la utilización de los mismos, y unidos a otra serie de factores de diversa índole, se han desarrollado una serie de alternativas al uso de antimicrobianos, existiendo en el mercado actual una serie de productos que complementan o sustituyen su utilización.
Los probióticos se definen como microorganismos viables que, tras ser suministrados por vía oral al animal, en cantidad y tiempo suficientes, son capaces de colonizar alguna parte del tracto gastrointestinal (TGI), preferentemente el intestino grueso desequilibrando la composición de la microbiota a favor de las especies simbióticas, reemplazando o suplementando la misma, dando lugar a efectos beneficiosos en la salud del animal. Los más usados son Lactobacillus y Bifidobacterium pero también se conocen cepas prebióticas de Saccharomyces cerevisie, Escherichia coli, Bacillus, Clostridium y Enterococcus entre otras.
Según la (FAO/WHO, 2002) la condición crítica que una cepa microbiana debe superar para considerarse probiótica es la de colonizar el colon y el lumen intestinal durante un tiempo indefinido. Idealmente, debe presentar otras características como ser originaria del hospedador, resistente a la digestión gástrica y del intestino delgado, potenciar la respuesta inmune, fijarse a las células epiteliales, no ser patógena en ningún caso, soportar los procesos tecnológicos de fabricación y almacenamiento, producir sustancias antimicrobianas (bacteriocinas) con efectos beneficiosos para la salud como modular el tránsito intestinal, incrementar la tasa de mitosis de los enterocitos o provocar cambios favorables en la cantidad y calidad de la microbiota.
Los prebióticos son aquellas sustancias no digestibles que alcanzan el intestino grueso y allí son fermentadas total o parcialmente, favoreciendo el crecimiento selectivo de especies microbianas favorables para el animal, de acuerdo con la definición inicial de Gibson y Roberfroid (1995). Los oligosacáridos, los polisacáridos no amiláceos (PNA) solubles principalmente y el almidón resistente tienen, todos ellos, capacidad prebiótica y de entre ellos, la oligofructosa y la inulina son los más estudiados y disponibles comercialmente. Los prebióticos están incluidos en la conocida “fibra dietética” y por ello, también favorecen mecánicamente el tránsito intestinal, por lo que se recomienda su inclusión en las dietas de los cerdos.
La fermentación de los prebióticos en el intestino grueso de los animales a cargo de lactobacilos y otras bacterias simbióticas estimula el crecimiento de las mismas y deriva en la producción de ácidos grasos de cadena corta (acético, propiónico y butírico, éste último, nutriente inmediato de los enterocitos) y gases. Estos ácidos, producto de la fermentación microbiana, tienen dos efectos inmediatos; por un lado, disminuyen el pH intestinal, lo que perjudica a las bacterias patógenas, y por otro, pueden ser absorbidos a través de la mucosa, con lo que el animal los aprovecha como fuente de energía.
El hecho de que los prebióticos sean fermentados por la flora endógena del animal se traduce en que los animales más viejos presentan una mayor capacidad de aprovechamiento que los jóvenes, con lo que a efectos de la formulación de raciones, deben contemplarse distintas recomendaciones de uso y distintos valores energéticos en función de la edad y peso del animal.
Dado que existen afinidades entre algunos sustratos prebióticos y ciertas cepas probióticas se ha propuesto la utilización de combinaciones de estos aditivos zootécnicos en simbiontes que buscan sinergias que incrementen su efectividad, o mediante tecnologías de encapsulación, que protejan dichos simbiontes, de tal manera que se garantice la resistencia de los mismos a los procesos tecnológicos o digestivos previos al punto concreto del intestino en que deben ejercer su acción.
Los optimizadores del tránsito intestinal buscan enlentecer el mismo, consiguiendo con esto un mayor aprovechamiento de los nutrientes existentes en el pienso; Saccharomyces boulardii o las pectinas son un claro ejemplo.
Los captadores de micotoxinas son compuestos químicos con una estructura capaz de retener las micotoxinas, evitando que sean absorbidas por el tracto intestinal. No las eliminan, sino que las adsorben para ser posteriormente eliminadas en heces junto con el compuesto formado. Las micotoxinas enlazadas con el secuestrante pasan por el tracto intestinal de los cerdos sin causar irritaciones en la pared intestinal y sin ser absorbidas. Un ejemplo de captadores son los silicatos.
Los acidificantes se usan mucho en producción porcina y probablemente son el tipo de productos que mayor éxito han tenido. Se incorporan tanto en la comida como en la bebida. La acción de los acidificantes se basa principalmente en su actividad antibacteriana al generar un medio de bajo pH en el que se hace prácticamente imposible el crecimiento bacteriano. Pero además tienen otro elemento que los hace especialmente interesantes y es el aporte energético y de minerales para los enterocitos, que suelen estar dañados en procesos patológicos.
Las enzimas actúan como catalizadores constituidos por proteínas u otras sustancias químicas que acaban mejorando los procesos metabólicos aumentando la digestibilidad de nutrientes como el fósforo, calcio, aminoácidos, energía, etc. que pueden proceder de materias primas vegetales. Existe en Europa un marco regulador del uso de los mismos que se especifica en el Reglamento 1831/2003, y que viene determinado por la aprobación de la EFSA, que mantiene que para su autorización, los aditivos deben ser seguros para los animales, personas (manipuladores y consumidores) y medio ambiente, así como eficaces con efectos beneficiosos a nivel tecnológico, sensorial, nutricional, zootécnico o coccidiostático/histomonostático. Ejemplos de enzimas son las fitasas, xilanasas y proteasas.
Tal y como venimos comentando en el desarrollo de las diferentes enfermedades que afectan a esta especie, debemos destacar la importancia que tiene en la producción porcina, el cumplimiento de todas las medidas tanto de manejo como en las normas de bioseguridad para poder prevenir la transmisión y el desarrollo de distintas enfermedades y patologías.
Adicionalmente a los requisitos generales existe una normativa específica que afecta a las explotaciones de producción de cerdos confinados para la cría y el engorde (Real Decreto 1135/2002, Real Decreto 1392/2012) y al porcino criado en extensivo (Real Decreto 1221/2009). En la normativa de protección de los cerdos confinados, aplicable en su totalidad desde el 1 de enero de 2013, se hace especial hincapié en:
- Disponibilidad de espacio para los animales, estableciendo la obligación de que se mantengan en grupos.
- Puesta a disposición de materiales que permitan expresar sus necesidades comportamentales, especialmente de investigación y manipulación.
- Limitar y regular cuidadosamente las actuaciones sobre los animales que puedan afectar a su bienestar, en especial las mutilaciones (castración, raboteo…).
La aplicación de las normas no solamente ha exigido una adaptación, a veces muy costosa, de las instalaciones sino que también exige una modificación de los sistemas de manejo y cuidados.
Medidas de bioseguridad:
- Libro de visitas
- Los vehículos no deben entrar en la explotación, salvo si están limpios y desinfectados
- Limpiar con productos desengrasantes
- Enjuagar bien con agua fría
- Desinfectar
- Poner vados de desinfección a la entrada de la explotación
- Disponer de monos, botas y bolsas para los pies para los conductores
- No permitir las visitas de personas
- No dar restos de alimentación humana a los cerdos
- Colocar dispositivos antipájaros
- Desratización
- Controlar al máximo las moscas
- No compartir materiales o utensilios entre granjas
- Hacer cuarentena para los animales de reposición
- Inseminación Artificial (I. A.) utilizando semen de la propia granja
- Fosas de cadáveres hechas en la misma explotación y cubrir con cal
- Sosa al 2% en todas las entradas
- Lejía para manos; ducha aconsejable
- Amontonar los excrementos y camas de paja (de forma que con la fermentación aumente su temperatura), fumigarlos con desinfectante y cubrirlos con una capa de paja y encima de ésta, otra capa de 10 cm de tierra. Se mantendrán en esta forma durante 3 semanas. Se adicionarán desinfectantes a los purines y se mantendrán de esta manera 3 semanas
- Limpieza y desinfección de: suelos, paredes, herramientas y equipos de trabajo
- Eliminar suciedad y grasa con productos desengrasantes
Desde el año 2006 se viene desarrollando el Plan de Vigilancia Sanitaria Serológica del ganado porcino, tal y como se detalla en el Real Decreto 1186/2006, de 13 de octubre que fue modificado en el año 2011 por el Real Decreto 599/2011, por el que se fijan las bases técnicas en las que se apoya la vigilancia de estas enfermedades, que vienen desarrolladas y adaptadas mediante el correspondiente Programa Nacional de Vigilancia Sanitaria Porcina.
El RD 526/2014, de 20 de junio tiene por objeto la determinación de las enfermedades de los animales sujetas a declaración obligatoria en el ámbito de España, de la Unión Europea y de la Organización Mundial de Sanidad Animal, así como los requisitos para su notificación.
El sector porcino español es el principal sector ganadero en nuestro país, además de posicionarse entre los principales productores a nivel europeo y mundial. Su estabilidad depende, en gran medida, del nivel de exportaciones de animales vivos y sus productos tanto a otros Estados Miembros como a terceros países; esta dependencia es mayor cada año que pasa. En la actualidad, España tiene un estatus de país libre frente a la Peste Porcina Clásica (PPC), Peste Porcina Africana (PPA) y Enfermedad Vesicular Porcina (EVP) estatus sanitario que debe mantenerse basándose en los criterios establecidos por el Código Sanitario para los Animales Terrestres de la OIE (Organización Mundial de Sanidad Animal).
El mantenimiento de la cabaña porcina nacional como libre de enfermedades de declaración obligatoria es crucial para el correcto funcionamiento del este flujo comercial y, por consiguiente, para la rentabilidad de las explotaciones porcinas y del sector en su conjunto.
referencias bibliográficas
