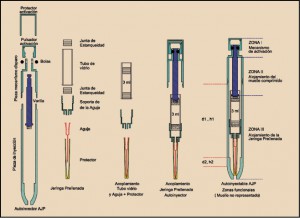
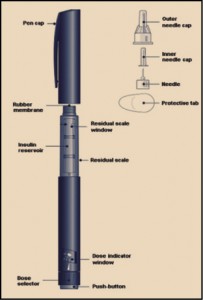
El riesgo cardiovascular es un reconocido factor patológico de excepcional relevancia. Sin embargo, no siempre los modelos epidemiológicos son lo suficientemente claros y precisos como para servir de referencia clínica real. Por este motivo y para proporcionar una visión general de los modelos de predicción de riesgo de enfermedad cardiovascular en la población general, se ha llevado a cabo una revisión sistemática de estudios que describen el desarrollo o la validación externa de modelos multivariables para predecir el riesgo de enfermedades cardiovasculares en la población general. De las cerca de 10.000 referencias seleccionadas en las bases de datos bibliográficas, se incluyeron en el análisis un total de 212 artículos que describían el desarrollo de 363 modelos de predicción y 473 validaciones externas. La mayoría de los modelos fueron desarrollados en Europa (46%), prediciendo el riesgo de enfermedad coronaria, tanto fatal como no fatal (33%) sobre un periodo de 10 años (58%). Los factores predictivos más habituales fueron el tabaquismo (90%) y la edad (88%), y la mayoría de los modelos fueron específicos para cada sexo (69%). Globalmente, se apreció una notable heterogeneidad entre los modelos en la definición de los predictores y de las variables; es más, el horizonte de predicción no fue especificado en 49 modelos (13%) y en 92 (25%) no se incluía información esencial capaz de permitir el uso del modelo en la predicción personal de riesgos. Asimismo, solo 132 modelos desarrollados (36%) fueron validados externamente y 70 (19%) lo fueron por investigadores independientes.
En definitiva, parece que hay un exceso de modelos de predicción de la incidencia de enfermedades cardiovasculares en la población general. Por otro lado, la utilidad de la mayoría de los modelos diseñados hasta ahora aún no está clara debido a las deficiencias metodológicas, a la presentación incompleta y a la falta de estudios de validación y del impacto. Como concluyen los autores de esta revisión, en lugar de desarrollar más y más nuevos modelos de predicción de riesgo de cardiovasculares, que en realidad son similares a los anteriores, las investigaciones futuras deberían centrarse en la validación externa y la comparación de los modelos validados de riesgo cardiovascular que ya existen, así como en la adaptación o incluso la combinación de estos modelos a las condiciones locales, e investigar si estos modelos se pueden ampliar mediante la adición de nuevos predictores.