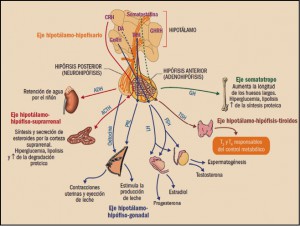
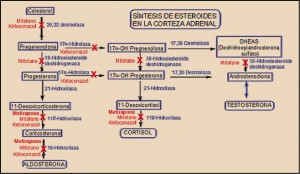
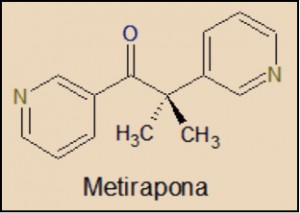
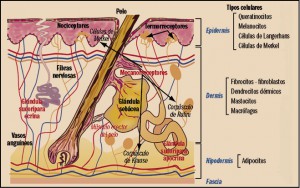
NUEVoS MEDICAMENTOS en el mundo, durante el año 2016
|
Fármacos |
Laboratorio |
Comentarios |
|
Baricitinib INCB28050, LY3009104 |
Lilly |
Baricitinib es un inhibidor de JAK1 y JAK2 que se encuentra en estudio de fase III como potencial tratamiento para la psoriasis y la neuropatía diabética. |
|
Dalantercept |
Acceleron Pharma |
Dalantercept es una proteína que inhibe que inhibe la angiogénesis y la activación de los receptores tumorales ALK-1 |
|
Demcizumab (OMP-21M18) |
OncoMed Pharmaceuticals |
Demcizumab es un anticuerpo monoclonal anti-DLL4 indicado para el tratamiento del cáncer de pulmón de células no pequeñas |
|
Depatuxizumab |
AbbVie |
Depatuxizumab es un anticuerpo anti EGFR indicado para el tratamiento del glioblastoma multiforme. |
|
Etrolizumab |
Genentech |
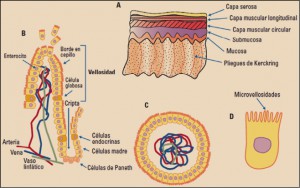
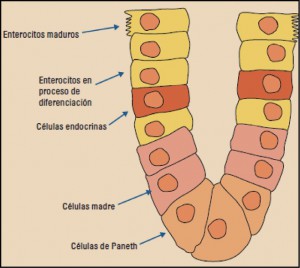
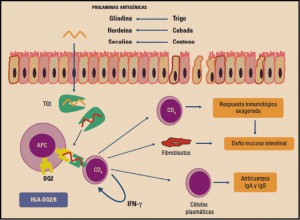
Etrolizumab es un anticuerpo monoclonal Anti-αEβ7/α4β7, indicado para el tratamiento de la inflamación intestinal |
|
Finerenona |
Bayer |
Finerenona es un antagonista del receptor mineral corticoide (MR) indicado para el tratamiento de la enfermedad crónica renal y neuropatía diabética. |
|
GeneTex |
Inebilizumab es un anti-CD19 Mab, indicado para el tratamiento de la neuromielitis óptica y tratamiento de los tumores de células B |
|
|
Lefamulin |
Nabriva |
Lefamulin es un agente antimicrobiano semisintético indicado para el tratamiento de las infecciones de la piel y de la neumonía bacteriana. |
|
Mavrilimumab (CAM-3001) |
Cambridge Antibody Technology |
Mavrilimumab es un anticuerpo monoclonal IgG4 estimulador de las colonias de granulocitos-macrófagos indicado para el tratamiento de la artritis reumatoide |
|
Oprozomib |
Amgen |
Oprozomib es un inhibidor de proteosoma que se está investigando para el tratamiento de enfermedades malignas hematológicas. |
|
Pemafibrato (K-877) |
Kowa Pharmaceuticals |
Pemafibrato es un modulador selectivo de PPARalpha indicado para el tratamiento de la dislipidemia. |
|
Pradigastat |
Novartis |
Pradigastat es un inhibidor de diacilglicerol O-aciltransferasa 1 (DGAT1), indicado para el tratamiento de las alteraciones de lipoproteínas. |
|
Tarextumab |
OncoMed |
Tarextumab es un anti-notch 2/3 MAb, destinado al tratamiento del cáncer de pulmón y de páncreas. |
|
TEV-48125 |
Teva |
El TEV-48125 es un anticuerpo monoclonal humanizado anti-CGRP indicado para el tratamiento de las migrañas |