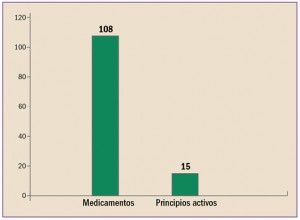
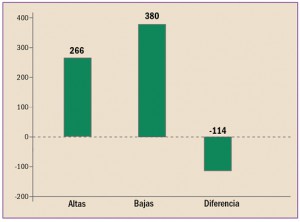
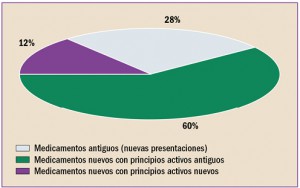
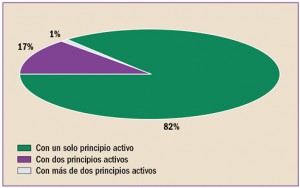
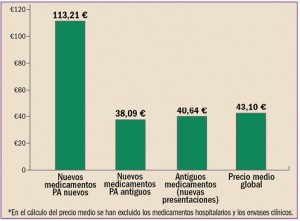
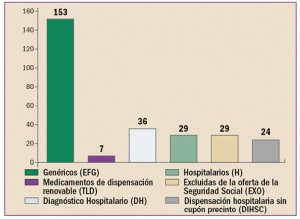
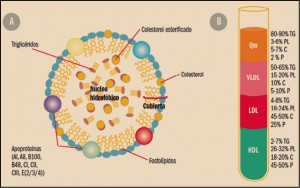
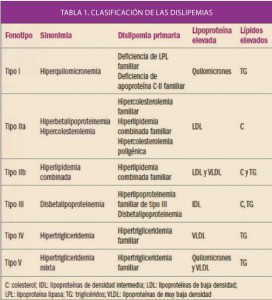
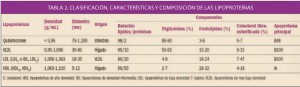
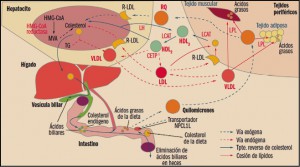
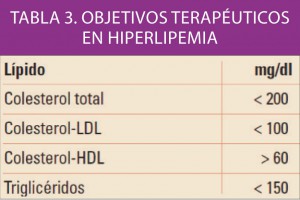
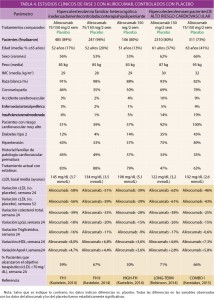
Uno de los objetivos de la Administración, y en concreto de instituciones como la Comisión Europea, es la lucha contra la distribución y venta de medicamentos falsificados.
Ante la proliferación de este tipo de práctica sobre todo a través de Internet, las autoridades dieron la voz de alarma hace más de dos años y, tras realizar algunas consultas públicas a los ciudadanos, pusieron en marcha la Directiva sobre medicamentos (2011/62/UE), que establecía el diseño de un logotipo común para las farmacias online y los requisitos técnicos a tener en cuenta para garantizar su autenticidad. Dicho logotipo, disponible desde julio de 2015, facilita la identificación de las farmacias acreditadas para la venta online de medicamentos de uso humano no sujetos a prescripción médica por parte del cliente/paciente. No obstante, lo que parecía un capítulo cerrado en torno a la venta online, sólo susceptible de ir introduciendo mejoras y añadidos, vuelve a resurgir debido a la proliferación de canales web y aplicaciones de compraventa a través del móvil, dedicadas a la venta de medicamentos entre particulares.
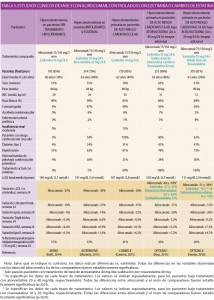
La Agencia Española de Medicamentos y Productos Sanitarios ha advertido de ello y del riesgo que supone este tipo de prácticas para la salud pública. Dichos anuncios ofertan medicamentos que no se ajustan a la legislación vigente, su origen es ilegítimo y no proporcionan garantías de que se hayan estado conservando de manera adecuada, tal y como reza la nota oficial de la AEMPS. Una de las claves: los medicamentos que requieren receta médica no pueden venderse de forma telemática.
Por otra parte, desde Asefarma se insiste recalcar la importancia que tienen Internet, las Nuevas Tecnologías y el buen uso que debe hacerse de ellas para colocar a la farmacia en un mercado global. Sin embargo, no es menos importante que por encima de todo ello debe primar el respeto a la legislación vigente y la garantía sanitaria del medicamento que debe dispensar únicamente un farmacéutico y que queda acreditada por el respeto a las leyes. Los medicamentos no son un producto cualquiera. Están estrechamente ligados al cuidado de la salud y sobre ésta actúan, por ello es vital su control; es fundamental que se cuide todo el ciclo y se respete lo que marca la ley en cuanto a su custodia, su conservación y su dispensación. Estas funciones corresponden en exclusiva a las oficinas de farmacia, a los servicios de farmacia a de los hospitales, a los de los centros de salud y a las de las estructuras de atención primaria del Servicio Nacional de Salud, no pudiendo ni debiendo realizarse por personas que no cuenten con la preceptiva autorización. Por nuestra parte, sí a la innovación, sí a que las farmacias vendan online (aquellas a las que sí les beneficie, quieran y puedan) y sí al avance tecnológico y la comunicación global. Pero ojo, siempre bajo el paraguas del respeto a la ley y la garantía sanitaria que sólo las farmacias y los farmacéuticos pueden ofrecer al ciudadano.