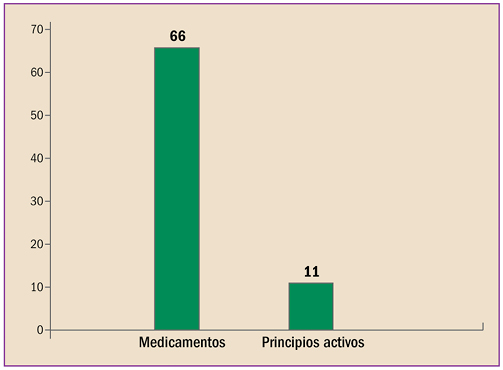
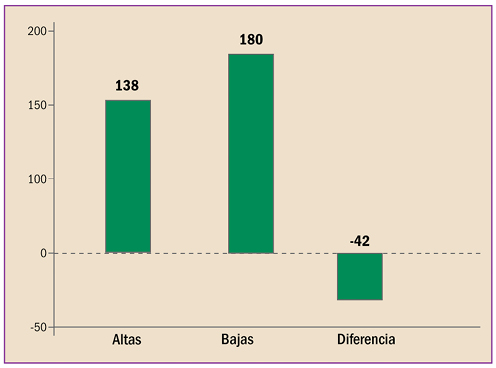
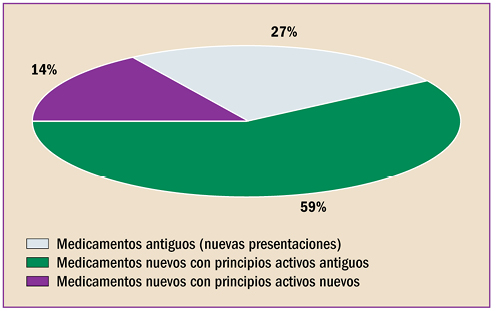
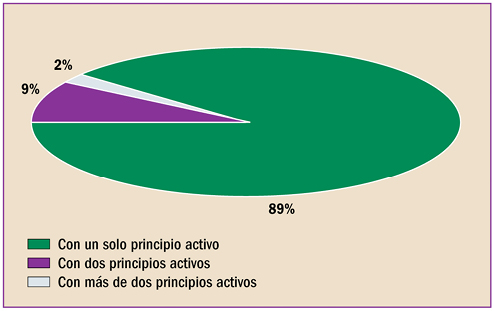
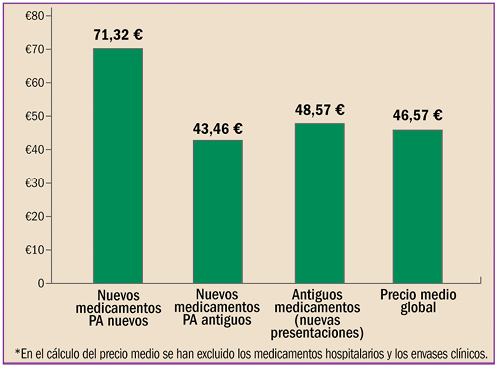
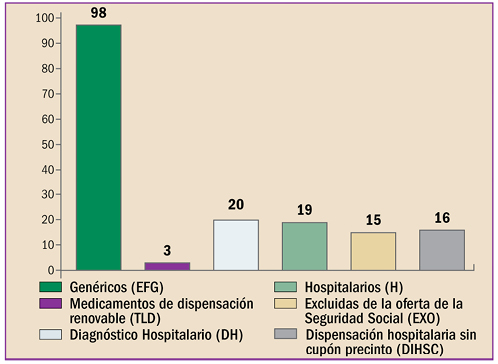
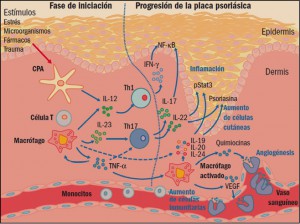
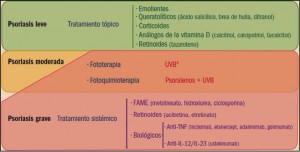
|
FECHA |
REF. |
TÍTULO ALERTA |
MEDICAMENTO |
PRINCIPIO ACTIVO |
MEDIDAS A TOMAR |
MOTIVOS |
ALERTA RELACIONADA |
|
12 Febrero |
1/2016 |
Natalizumab (▼Tysabri): nuevas recomendaciones para minimizar el riesgo de leucoencefalopatía multifocal progresiva |
▼Tysabri |
Natalizumab |
Antes del inicio del tratamiento: informar al paciente y cuidadores del riesgo y síntomas sugestivos de LMP; determinar el título de anticuerpos anti virus JC y disponer de RNM cerebral. Durante el tratamiento: vigilar la aparición de signos y síntomas de disfunción neurológica; RNM al menos anual; determinación de anticuerpos cada 6 meses. Una vez terminado tratamiento: monitorizar 6 meses más. |
Evaluación de los datos disponibles sobre el riesgo de LMP indica que es determinante el diagnóstico precoz de la LMP, pues el tratamiento temprano limita el grado de daño cerebral |
— |
|
12 Febrero |
2/2016 |
Recomendaciones sobre el riesgo de cetoacidosis diabética asociada al uso de canagliflozina, dapagliflozina y empagliflozina |
Invokana Vokanamet Forxiga Xigduo Jardiance |
Canagliflozina Dapagliflozina Empagliflozina |
Ante síntomas sugestivos aun sin hiperglucemias elevadas, considerar el diagnóstico; informar a pacientes para que acudan al médico si aparecen estos. Interrumpir tratamiento en caso de sospecha de cetoacidosis y de hospitalización por cirugía mayor o enfermedad médica grave. |
Revisión europea del riesgo de cetoacidosis diabética |
7/2015 |
|
12 Febrero |
3/2016 |
Fusafungina (Fusaloyos): recomendación de suspensión de comercialización |
Fusaloyos |
Fusafungina |
Se ha recomendado la suspensión de comercialización en la Unión Europea, pero aun no es una decisión final. Mientras, no prescribir ni dispensar; pacientes han de acudir al médico si necesitan tratamiento. |
Riesgo de reacciones alérgicas y de hipersensibilidad, junto a una limitada eficacia clínica |
— |