Resumen
El ospemifeno es un modulador selectivo de los receptores estrogénicos que ha sido autorizado para el tratamiento de la atrofia vulvovaginal sintomática de moderada a grave en mujeres postmenopáusicas que no cumplen los requisitos para recibir un tratamiento vaginal con estrógenos locales. Se trata del primer medicamento autorizado para esta indicación por vía oral, aunque actualmente se dispone de diversos preparados de naturaleza estrogénica de aplicación tópica. Precisamente por ello, se echa de menos la utilización de algún comparador activo en los estudios clínicos pivotales; no obstante, una comparación bibliográfica de la superioridad sobre el placebo con dichos preparados tópicos arroja valores de la misma magnitud que los encontrados con el ospemifeno. Por todo ello y teniendo en cuenta que farmacológicamente tampoco aporta nada nuevo innovación, no parece que este nuevo fármaco pueda ser considerado como innovador.
VULVOVAGINITIS ATRÓFICA POSMENOPÁUSICA
La vulvovaginitis atrófica o atrofia vulvovaginal posmenopáusica es una patología que se asocia típicamente con la disminución de los niveles generales de estrógenos; por consiguiente, se trata de una condición que suele manifestarse entre los tres a cinco años de sobrevenir la menopausia. En términos clínicamente relevantes, afecta al 30-50% de las mujeres posmenopáusicas, porcentaje que prácticamente se duplican en el caso de las posmenopáusicas supervivientes de un cáncer de mama (Monterosa, 2013).
El déficit estrogénico típico de la menopausia es responsable de la atrofia vulvovaginal debido a una menor maduración de las células epiteliales de la vagina, un descenso progresivo en la vascularización de los tejidos vaginales y una reducción de la lubricación; asimismo, el contenido de glucógeno de las células epiteliales vaginales se reduce, dando lugar a una menor colonización de los lactobacilos y a un aumento del pH de la vagina. Es importante tener en cuenta que los estrógenos juegan un papel importante en la fisiología vaginal, ya que la pared vaginal contiene un buen número de receptores estrogénicos, no solo en las capas basales del epitelio sino también en las células estromales y en las fibras musculares lisas. Los estrógenos afectan al epitelio, al tejido conectivo y a la elasticidad de la pared vaginal y, de hecho, las concentraciones estrogénicas se relacionan con el grosor y la madurez de la pared vaginal, con un incremento del flujo sanguíneo, de la lubricación y de la sensibilidad mecánica vaginal. Asimismo, la estimulación estrogénica produce glucógeno en las células epiteliales vaginales, el cual es metabolizado por los lactobacilos (Lactobacillus spp.), formando ácido láctico como producto final. Este ácido láctico mantiene el interior de la vagina en un entorno químico ácido (pH 3,5-4,5), lo que constituye una barrera fisiológica frente a la contaminación bacteriana y las infecciones del tracto urogenital.
En definitiva, el déficit estrogénico asociado a la menopausia conduce a la aparición de diversos síntomas y signos clínicos que incluyen sequedad vaginal, enrojecimiento, petequias, leucorrea, prurito vulvar, palidez y friabilidad de la mucosa. El cuadro se corresponde con una inflamación de la vagina debido a un adelgazamiento del tejido de sus paredes y una disminución de la secreción de fluidos lubricantes. Se manifiesta típicamente como sensación de quemazón al orinar, dolor durante las relaciones sexuales (dispareunia), generalmente acompañado de un sangrado leve y flujo vaginal ligero.
El estudio CLOSER (Clarifying Vaginal Atrophy’s Impact on Sex and Relationships; Nappi, 2013) evaluó 1000 mujeres y sus parejas, con edades entre 55-65 años, para establecer el impacto emocional y psicológico de la vulvovaginitis atrófica posmenopáusica. Las molestias vaginales provocaron una limitación para la intimidad sexual en el 58%, pérdida de la libido en el 64% y dolor coital en el 64%. El 30% de las parejas consideraron que estas molestias vaginales fueron la principal razón que les llevó a la abstinencia sexual.
Las molestias originadas durante el coito son determinantes para que muchas de las mujeres que padecen vulvovaginitis atrófica eviten las relaciones sexuales o, al menos, pierdan su interés por las mismas. Asimismo, la vulvovaginitis atrófica se asocia con síntomas urológicos, entre los que cabe mencionar a un incremento de la frecuencia de las micciones, hematuria, infecciones del tracto urinaria, disuria e incontinencia de estrés.
Además de la caída brusca de los niveles estrogénicos, existen otros factores adicionales que pueden incrementar la prevalencia de este problema. Uno de ellos es el tabaquismo, que podría incrementar la tasa metabólica de los estrógenos; sin embargo, los datos epidemiológicos distan mucho de ser homogéneos. Otro factor es el sobrepeso y la obesidad, considerándose que un índice de masa corporal (IMC) superior a 27 kg/m2 incrementa significativamente este riesgo; aunque, como en el caso del tabaquismo, tampoco en esto hay unanimidad epidemiológica. La evidencia es más robusta para la asociación entre la vulvovaginitis atrófica posmenopáusica con la inactividad física, hasta el punto de que las mujeres que realizan habitualmente ejercicio físico vigoroso tienen un 50% menos de riesgo de padecer este problema al llegar la menopausia. También puede ser un factor preventivo el mantenimiento de una actividad sexual regular y frecuente, habiéndose sugerido que el motivo de ello pudiera ser que tal comportamiento tiende a incrementar la vascularización hacia los órganos pélvicos debido al estímulo mecánico, lo cual mejora la elasticidad tisular y la flexibilidad vaginal.
Las medidas para prevenir y tratar de la vulvovaginitis atrófica posmenopáusica son muy diversas. Van desde el uso de preparados hidratantes y lubricantes, particularmente cuando se mantienen relaciones sexuales, al empleo de fármacos cuyo objetivo esencial es paliar los efectos locales debidos al déficit estrogénico.
Existe una amplia base científica para considerar que los hidratantes y lubricantes vaginales son la primera línea terapéutica para aliviar los síntomas de la vulvovaginitis atrófica posmenopáusica; ambos son efectivos para el alivio de síntomas y no requieren prescripción médica. También se han utilizado complementos dietéticos, incluyendo diversas vitaminas e isoflavonas. En este sentido, un reciente estudio (Tranche, 2016) ha mostrado en un conjunto de 90 mujeres voluntarias que el consumo regular de una bebida a base de semillas de soja conteniendo 50 mg de isoflavonas (entre otros componentes) redujo los síntomas climatéricos en un 20%, los de dominio urogenital en un 21% y los relacionados con la merma de la calidad de vida en un 18%.
En los casos más intensos se suele recurrir a la terapia estrogénica, por vía tópica (cremas, parches transdérmicos, anillos vaginales) o incluso por vía oral. Se utilizan para ello, promestrieno, estrógenos conjugados, estradiol, etc. La incorporación de los llamados moduladores selectivos de receptores estrogénicos (SERM; selective entrogenic receptor modulators), puede apuntar algunas ventajas, al actuar sobre los receptores estrogénicos situados en determinadas localizaciones orgánicas pero no en otras, limitando con ello la incidencia de efectos adversos e, incluso, el riesgo de neoplasias estrógeno-dependientes. En esta línea se mueve el ospemifeno.
Se están investigando otras líneas como los denominados complejos de estrógenos selectivos del tejido (TSEC), que consisten en la combinación de estrógenos con SERM, evitando con ello la complementación de progestágenos. En este sentido, se está estudiando la combinación de bazedoxifeno (un SERM) con estrógenos conjugados, con buenos resultados de eficacia y de seguridad por el momento (Palacios, 2015). Otras vías terapéuticas experimentales van en la línea de la deshidroepiandrostenodiona (DHEA), que parece favorecer la formación de colágeno en la lámina propia, muscular y epitelial de la vagina y disminuye el pH sin aumentar los niveles estrogénicos por encima del rango postmenopáusico.
ACCIÓN Y MECANISMO
El ospemifeno es un modulador selectivo de los receptores estrogénicos. Ha sido autorizado para el tratamiento de la atrofia vulvovaginal sintomática de moderada a grave en mujeres postmenopáusicas que no cumplen los requisitos para recibir un tratamiento vaginal con estrógenos locales. Las acciones biológicas del fármaco están mediadas tanto por el propio ospemifeno como de su metabolito principal (al que se debe un 40% de la acción global del medicamento) a los receptores de estrógenos. Esta unión provoca la activación de algunas rutas estrogénicas y el bloqueo de otras. La concentración inhibitoria para el 50% (IC50%) para los receptores estrogénicos α es de 476 nM y para los β de 513 nM, mientras que la afinidad de unión del inhibidor (Ki) son de 380 y 410 nM, respectivamente. Estos parámetros son similares para el principal metabolitos del ospemifeno, así como para el toremifeno y tamoxifeno.
El ospemifeno y su metabolito principal ejercen un efecto estrogénico en la vagina, aumentando la maduración celular y la mucificación del epitelio vaginal; asimismo, en los huesos tiene una actividad de tipo agonista, favoreciendo la actividad osteoblástica. Por el contrario, en la glándula mamaria produce un efecto antagonista, mientras que en el útero los efectos son parciales débiles, con una mezcla de efectos agonistas y antagonistas.
El ospemifeno ha mostrado mejorar la sequedad vaginal y el dolor asociado con la actividad sexual, facilitando la regeneración del entorno vaginal, incluyendo su acidez (pH) y el grosor de los tejidos de la pared.
ASPECTOS MOLECULARES
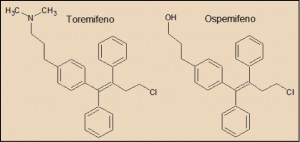
El ospemifeno es un modulador selectivo de receptores estrogénicos y, en este sentido, está farmacológicamente relacionado con otros fármacos como el raloxifeno y el bazedoxifeno. Sin embargo, estructuralmente, el ospemifeno está químicamente mucho más próximo al toremifeno, un derivado no esteroideo del trifeniletileno, a su vez relacionado el tamoxifeno y el clomifeno. El toremifeno actúa sobre los receptores estrógeno, pudiendo ejercer actividad estrogénica, antiestrogénica o ambas a la vez, dependiendo de la duración del tratamiento y del tejido considerado; no obstante, en general, los derivados no esteroideos del trifeniletileno son predominantemente antiestrogénicos en el hombre. El toremifeno se une específicamente a los receptores estrógenos, en competencia con el estradiol e inhibe la estimulación inducida por los estrógenos de la síntesis del ADN y la replicación celular.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del ospemifeno han sido adecuadamente contrastadas en la indicación autorizada mediante tres ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos, doblemente ciegos y controlados con placebo.
Las co-variables primarias utilizadas en estos estudios correspondieron a la variación experimentada a las 12 semanas de tratamiento (desde su inicio) en el frotis vaginal (porcentajes de células parabasales y superficiales), en pH vaginal y en la intensidad de los síntomas más molestos1 (sequedad vaginal y dispareunia). Como co-variables secundarias se determinaron estas mismas variables clínicas a las 4 y (en uno de los estudios) 26 y 52 semanas, así como la gravedad de los síntomas vulvovaginales, evaluación visual dela vagina, niveles hormonales séricos, test de distrés urinario (UDI-6), índice de función sexual femenina (Female Sexual Function Index, FSFI) y frecuencia de uso lubricantes vaginales, entre otras variables.
Dos de los estudios tuvieron una duración de 12 semanas y en el caso del tercero fueron 52 semanas, totalizando entre ellos 2.171 mujeres menopáusicas con edades comprendidas entre los 40 y los 80 años y con útero intacto, ≤5% de células superficiales en la vagina, pH vaginal ≥5 y al menos un síntoma moderado o grave de atrofia vulvovaginal. La dosis utilizada en todos ellos fue de 60 mg/24 h (oral); en uno de los estudios también se utilizó la dosis de 30 mg/24 h. Las características y resultados de los ensayos clínicos controlados con placebo están recogidos en la tabla 1.
|
Tabla 1. Estudios clínicos de fase 3 con ospemifeno controlados con placebo |
||||
|
Parámetros |
Tratamientos comparados |
|||
|
Tratamientos comparados |
Ospemifeno 30 mg/24 h Ospemifeno 60 mg/24 h Placebo |
Ospemifeno 60 mg/24 h Placebo |
Ospemifeno 60 mg/24 h Placebo |
Ospemifeno 60 mg/24 h Placebo |
|
Pacientes aleatorizados |
826 |
314 |
605 |
426 |
|
Duración del estudio |
12 semanas |
12 semanas |
12 semanas |
52 semanas |
|
Determinación de las co-variables primarias |
12 semanas |
12 semanas |
12 semanas |
12 semanas |
|
Variación (media) en el pH vaginal |
Ospemifeno (30): -0,67 Ospemifeno (60): -1,00 Placebo: -0,10 |
Ospemifeno (60): -0,95 Placebo: -0,25 |
Ospemifeno (60): -0,94 Placebo: -0,07 |
Ospemifeno (60): -1,22 Placebo: -0,16 |
|
Variación % células parabasales |
Ospemifeno (30): -21,9 Ospemifeno (60): -30,1 Placebo: +4,0 |
Ospemifeno (60): -31,7 Placebo: -3,9 |
Ospemifeno (60): -40,3 Placebo: -0,4 |
Ospemifeno (60): -40,0 Placebo: 0,0 |
|
Variación % células superficiales |
Ospemifeno (30): +7,8 Ospemifeno (60): +10,8 Placebo: +2,2 |
Ospemifeno (60): +7,0 Placebo: 0,0 |
Ospemifeno (60): +7,0 Placebo: 0,0 |
Ospemifeno (60): +5,0 Placebo: 0,0 |
|
Variación en el síntoma más molesto (sequedad vaginal) |
Ospemifeno (30): -1,22 Ospemifeno (60): -1,26 Placebo: -0,84 |
– |
– |
– |
|
Variación en el síntoma más molesto (dispareunia) |
Ospemifeno (30): -1,02 (ns) Ospemifeno (60): -1,19 Placebo: -0,89 |
– |
– |
– |
|
Variación en el síntoma más molesto (sequedad vaginal): % pacientes con reducción ≥1 punto |
– |
Ospemifeno (60): 70.7% (ns) Placebo: 68,2% |
– |
– |
|
Variación en el síntoma más molesto (dispareunia): % pacientes con reducción ≥1 punto |
– |
– |
Ospemifeno (60): 79.9% Placebo: 64,0% |
– |
|
% Respondedoras* |
Ospemifeno (30): 20,6% Ospemifeno (60): 33,7% Placebo: 3,4% |
Ospemifeno (60): 39,7% Placebo: 5,5% |
– |
|
|
% Mujeres con mejoría sustancial en sequedad vaginal** |
Ospemifeno (60): 42,4% Placebo: 26,9% |
Ospemifeno (60): 46,3% Placebo: 34,4% |
– |
|
|
% Mujeres con mejoría sustancial en dispareunia |
Ospemifeno (60): 40,8% Placebo: 29,5% |
Ospemifeno (60): 52,8% Placebo: 38,7% |
– |
|
|
Determinación de las co-variables secundarias |
4 semanas |
4 semanas |
4 semanas |
52 semanas |
|
Variación en el pH vaginal |
Ospemifeno (30): -0,60 Ospemifeno (60): -0,89 Placebo: -0,18 |
Ospemifeno (60): -0,86 Placebo: -0,23 |
Ospemifeno (60): -0,84 Placebo: -0,19 |
Ospemifeno (60): -1,30 Placebo: -0,07 |
|
Variación % células parabasales |
Ospemifeno (30): -18,6 Ospemifeno (60): -25,1 Placebo: +2,8 |
Ospemifeno (60): -31,2 Placebo: -2,8 |
Ospemifeno (60): -37,8 Placebo: -0,8 |
Ospemifeno (60): -45,0 Placebo: -4,0 |
|
Variación % células superficiales |
Ospemifeno (30): +7,6 Ospemifeno (60): +9,7 Placebo: +1,3 |
Ospemifeno (60): +12,7 Placebo: +3,6 |
Ospemifeno (60): +13,0 Placebo: +1,9 |
Ospemifeno (60): +2,0 Placebo: 0,0 |
|
Variación en el síntoma más molesto (sequedad vaginal) |
Ospemifeno (30): -1,02 (ns) Ospemifeno (60): -1,03 (ns) Placebo: -0,80 |
– |
– |
– |
|
Variación en el síntoma más molesto (dispareunia) |
Ospemifeno (30): -0,99 (ns) Ospemifeno (60): -1,09 (ns) Placebo: -0,99 |
– |
– |
– |
|
Referencia |
15-50310 (Bachmann, 2010) |
15-50821 (Portman, 2014)*** |
15-50821 (Constantine, 2015) |
15-50718 (Goldstein, 2014) |
Nota: Todas las diferencias de las variables observadas con ospemifeno y placebo fueron estadísticamente significativas (p<0,05), salvo aquellasnotadas con (ns).
* Se consideró como respondedora a aquellas mujeres que experimentaron un incremento del índice de maduración (células superficiales) de al menos 10, una reducción del pH vaginal de al menos 0,5 puntos y una mejora del síntoma más molesto de al menos 1 punto.
** Mejoría sustancial: aumento de ≥2 puntos en el índice de síntomas más molestos.
*** Los estudios de Portman y Constantine son, en realidad, dos brazos del mismo estudio (15-50821).
Desde el punto de vista de la seguridad, el ospemifeno presenta un perfil toxicológico aceptable, con efectos secundarios leves y transitorios. Son frecuentes (>10%) la candidiasis vaginal y otras infecciones fúngicas, así como sofocos, espasmos musculares, secreción vaginal y erupciones cutáneas.
Los eventos adversos más cmunes relacionados con el tratamiento (EMA, 2014) fueron: sofocos (7,5% con ospemifeno y 2,6% con placebo), flujo vaginal (3,7 vs. 0,3%) y cefalea (3,1 vs. 2,4%). La incidencia de eventos adversos graves con ospemifeno (60 mg) fue del 3,1% vs. 1,7% con placebo, y en el caso de aquellos específicamente relacionados con el tratamiento, fueron del 0,6% y 0,1%, respectivamente. La suspensión del tratamiento como consecuencia de un evento adverso se registró en el 5,2% con ospemifeno y en el 1,8% con placebo.
ASPECTOS INNOVADORES
El ospemifeno es un modulador selectivo de los receptores estrogénicos que ha sido autorizado para el tratamiento de la atrofia vulvovaginal sintomática de moderada a grave en mujeres postmenopáusicas que no cumplen los requisitos para recibir un tratamiento vaginal con estrógenos locales.
Los datos clínicos disponibles son metodológicamente robustos, aunque los resultados solo pueden ser considerados como modestos en términos clínicos. En cualquier caso, se ha demostrado una superioridad estadísticamente significativa sobre el placebo en diversos parámetros, tales como el pH vaginal y los porcentajes de células parabasales y superficiales de la vagina. Asimismo, los porcentajes de mujeres respondedoras al tratamiento con ospemifeno mostraron una superioridad estadísticamente significativa en la sequedad vaginal y en la dispareunia, aunque los porcentajes de respuesta al placebo fueron ciertamente elevados y las diferencias favorables al ospemifeno fueron modestas. Los datos clínicos a un año sugieren que el efecto se mantiene durante al menos este periodo. Un metanálisis (Cui, 2014) ha confirmado la superioridad estadística del ospemifeno sobre el placebo, particularmente en lo relativo a la dispareunia.
Presenta un perfil de seguridad aceptable, en principio, con eventos adversos generalmente leves y transitorios, aunque algunos de ellos (sofocos, cefalea, etc.) pueden agravar o prolongar los eventos característicos de la menopausia. Un 5% de las mujeres suspenden el tratamiento por eventos adversos (vs. 2% con placebo).
Debe tenerse en cuenta que el ospemiefno es un modulador selectivo de receptores estrogénicos (SERM) y este grupo de fármacos ha sido asociado con un incremento del riesgo de Tromboembolismo venoso, por lo que no puede excluirse este mismo riesgo para el ospemifeno. No obstante, los datos actualmente disponibles no han mostrado ninguna diferencia con placebo en este aspecto.
Se trata del primer medicamento autorizado para esta indicación por vía oral, aunque actualmente se dispone de diversos preparados de naturaleza estrogénica de aplicación tópica. Precisamente por ello, se echa de menos la utilización de algún comparador activo en los estudios clínicos pivotales; no obstante, una comparación bibliográfica de la superioridad sobre el placebo con dichos preparados tópicos arroja valores de la misma magnitud que los encontrados con el ospemifeno. Por todo ello y teniendo en cuenta que farmacológicamente tampoco supone aporta nada nuevo, no parece que este nuevo fármaco pueda ser considerado como innovador.
|
VALORACIÓN |
|
|
OSPEMIFENO
 SENSHIO® (Shionogi) |
|
|
Grupo Terapéutico (ATC): G03XC. SISTEMA GENITOURINARIO Y HORMONAS SEXUALES. Hormonas sexuales y moduladores del sistema genital: moduladores selectivos del receptor de estrógenos. |
|
|
Indicaciones autorizadas: Tratamiento de la atrofia vulvovaginal sintomática de moderada a grave en mujeres postmenopáusicas que no cumplen los requisitos para recibir un tratamiento vaginal con estrógenos locales. |
|
|
VALORACIÓN GLOBAL: SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
♣ |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Tamoxifeno |
Nolvadex |
AstraZeneca |
1977 |
|
Toremifeno |
Fareston* |
Orion** |
1996 |
|
Raloxifeno |
Evista |
Daiichi Sankyo*** |
1998 |
|
Bazedoxifeno |
Conbriza |
Pfizer |
2009 |
|
Ospemifeno |
Senshio |
Shionogi |
2016 |
* No comercializado actualmente
** Originalmente, Schering Plough
*** Originalmente, Lilly.
BIBLIOGRAFÍA