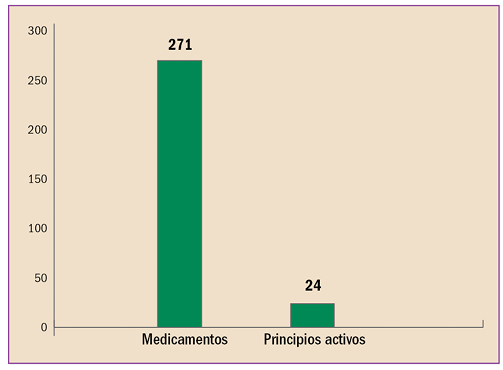
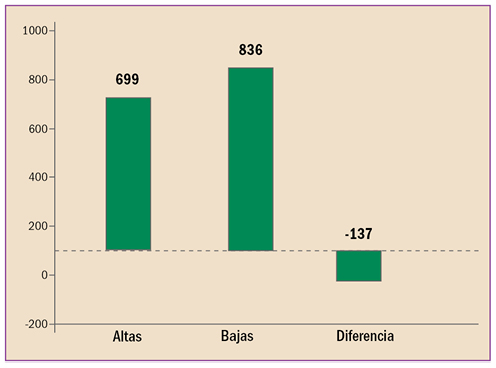
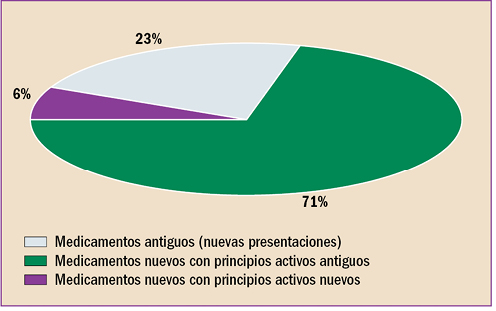
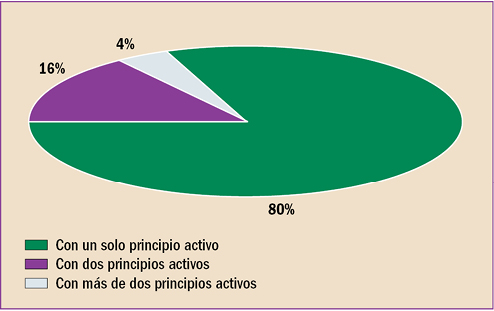
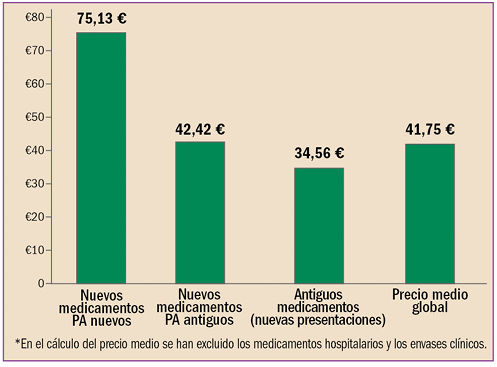
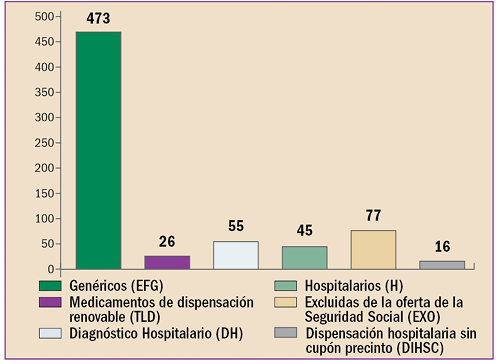
|
FECHA |
REF. |
TÍTULO ALERTA |
MEDICAMENTO |
PRINCIPIO ACTIVO |
MEDIDAS A TOMAR |
MOTIVOS |
ALERTA RELACIONADA |
|
27 Abril |
6/20015 |
Riesgo de bradicardia severa y bloqueo cardiaco asociado a la administración de ▼Harvoni, y la combinación de ▼Sovaldi más ▼Daklinza, con amiodarona |
▼Harvoni, ▼Sovaldi, ▼Daklinza, Trangorex |
Sofosbuvir, ledipasvir, daclatasvir, amiodarona |
No se recomienda utilizar amiodarona junto con estos antivirales frente a hepatitis C, excepto si no es posible usar otros antiarrítmicos. En tal caso, vigilar estrechamente a los pacientes (especialmente en las primeras semanas). |
Notificados casos de bradicardia severa y bloqueo cardiaco en la administración conjunta de amiodarona y estas asociaciones frente a la hepatitis C |
— |
|
12 Junio |
7/2015 |
Riesgo de cetoacidosis diabética asociada al uso de canagliflozina, dapagliflozina y empagliflozina |
▼Invokana, ▼Forxiga, ▼Xigduo, ▼Jardiance |
Canagliflozina, dapagliflozina y empagliflozina |
Monitorizar cuerpos cetónicos en pacientes que desarrollen síntomas sugestivos de cetoacidosis diabética (incluso cuando glucemia no sugiera el diagnóstico). Informar a pacientes sobre la sintomatología de la cetoacidosis diabética y de la necesidad de acudir al médico en el caso de presentarse. |
Notificados casos graves de cetoacidosis diabética en pacientes en tratamiento con estos medicamentos (la mayoría fueron hospitalizados). El cuadro clínico, en muchos casos, fue inusual (y puede retrasar el diagnóstico): ascensos moderados de glucosa en sangre sin hiperglucemia concomitante, incluso en algún paciente se produjo hipoglucemia. |
— |
|
13 Julio |
8/2015 |
Vacuna frente al virus del papiloma humano: inicio de una revisión europea de aspectos específicos de seguridad |
Cervarix, Gardasil |
Vacunas frente al virus del papiloma humano |
Por el momento no es necesario realizar ningún cambio en las condiciones de uso. |
Inicio de la un revisión (parte de procedimientos habituales) para analizar posible relación con dos síndromes (s. de dolor regional complejo, CRPS; s. de taquicardia postural ortostática, POTS) |
— |
|
23 Octubre |
9/2015 |
Micofenolato mofetilo y micofenolato sódico: riesgos de malformaciones congénitas y aborto espontáneo |
Cellcept, Myfenax, Myfortic, y EFG con micofenolato mofetilo |
Micofenolato mofetilo y micofenolato sódico |
Se debe informar a los pacientes (mujeres con capacidad de gestación y varones) que deben utilizar medidas anticonceptivas eficaces (recomendándose emplear simultáneamente dos métodos complementarios). |
Tras la revisión de los datos disponibles, se confirma su potente efecto teratogénico; en exposición durante el embarazo, se incrementa el riesgo de malformaciones congénitas y aborto espontáneo. |
— |