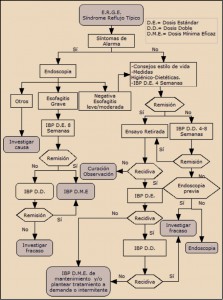
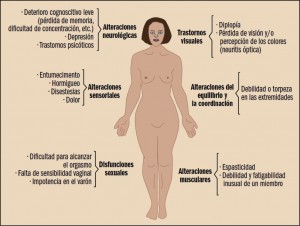
MEDICAMENTOS DE USO HUMANO AUTORIZADOS (EMA/AEMPS)
DURANTE LOS ÚLTIMOS DOCE MESES, CON NUEVOS PRINCIPIOS ACTIVOS
QUE AÚN NO ESTÁN COMERCIALIZADOS EN ESPAÑA
|
Principio activo |
Medicamento® |
Laboratorio |
Autorización |
GT |
Indicación autorizada1 |
|
Bupropión/Naltrexona |
Mysimba |
Orexigen Therapeutics |
2015/03/26 |
A08AA |
Obesidad |
|
Liraglutida2 |
Saxendra |
Novo Nordisk |
2015/03/23 |
A10BX |
Obesidad |
|
Tedizolid |
Sivextro |
Cubist |
2015/03/23 |
J01XX |
Infecciones de piel y tejidos blandos |
|
Safinamida |
Xadago |
Zambon |
2015/02/24 |
N04BD |
Enfermedad de Parkinson |
|
Dalbavancina |
Xydalba |
Durata |
2015/02/19 |
J01XA |
Infecciones de piel y tejidos blandos |
|
Células epiteliales corneales humanas autólogas |
Holoclar |
Chiesi |
2015/02/17 |
S01XA |
Enfermedades de la córnea (O) (E) |
|
Eliglustat |
Cerdelga |
Genzyme |
2015/01/19 |
A16AX |
Enfermedad de Gaucher (O) |
|
Vorapaxar |
Zontivity |
Merck Sharp Dohme |
2015/01/19 |
B01AC |
Infarto de miocardio |
|
Secukinumab |
Cosentyx |
Novartis |
2015/01/15 |
L04AC |
Psoriasis y artritis psoriásica |
|
Nindetanib |
Ofev |
Boehringer Ingelheim |
2015/01/15 |
L01XE |
Fibrosis pulmonar idiopática (O) |
|
Apremilast |
Otezla |
Celgene |
2015/01/15 |
L04AA |
Psoriasis y artritis psoriásica |
|
Ospemifeno |
Senshio |
Shionogi |
2015/01/15 |
G03XC |
Postmenopausia |
|
Afamelanotida |
Scenesse |
Clinuvel |
2014/12/22 |
D02BB |
Protoporfiria hematopoyética (O) (E) |
|
Ramucirumab |
Cyramza |
Lilly |
2014/12/19 |
L01XC |
Cáncer de estómago (O) |
|
Nonacog gamma |
Ruxibis |
Baxter |
2014/12/19 |
B02BD |
Hemofilia B |
|
Olaparib |
Lynparza |
AstraZeneca |
2014/12/16 |
L01XX |
Cáncer epitelial de ovario (O) |
|
Naloxegol |
Moventig |
AstraZeneca |
2014/12/08 |
A06AH |
Estreñimiento |
|
Nintedanib |
Vargatef |
Boehringer Ingelheim |
2014/11/21 |
L01XE |
Cáncer de pulmón no microcítico |
|
Darunavir/Cobicistat |
Rezolsta |
Janssen Cilag |
2014/11/19 |
J05AE |
Infección VIH |
|
Aclidinio/Formoterol |
Brinika/Duakir Genuair |
Almirall |
2014/11/19 |
R03AL |
EPOC |
|
Ibrutinib |
Imbruvica |
Janssen Cilag |
2014/10/21 |
L01XE |
Leucemia linfocítica crónica (O) |
|
Idelalisib |
Zydelig |
Gilead |
2014/09/18 |
L01XX |
Leucemia/linfoma |
|
Ataluren |
Translarna |
PTC Therapeutics |
2017/07/31 |
M09AX |
Distrofia muscular de Duchenne (O) (C) |
|
Obinotuzumab |
Gazyvaro |
Roche |
2014/07/23 |
L01XC |
Leucemia linfocítica crónica (O) |
|
Peginterferón beta-1a |
Plegridy |
Biogen |
2014/07/18 |
L03AB |
Esclerosis múltiple |
|
Trametinib |
Mekinist |
Glaxo |
2017/06/30 |
L01XE |
Melanoma |
1 O= Medicamento huérfano; C= Autorizado condicionalmente; E= Autorizado en condiciones excepcionales
2 Ya está autorizado en España, desde 2009, un medicamento con liraglutida (Victoza®), aunque indicado en el tratamiento de la diabetes mellitus de tipo 2.
MEDICAMENTOS CON NUEVOS PRINCIPIOS ACTIVOS COMERCIALIZADOS EN ESPAÑA
|
MEDICAMENTOS CON NUEVOS PRINCIPIOS ACTIVOS COMERCIALIZADOS EN ESPAÑA |
||||||||||
|
PAM |
Principio activo |
Medicamento® |
INNOVACIÓN |
Indicación principal |
Laboratorio |
|||||
|
a |
b |
c |
d |
e |
f |
|||||
|
384 |
Riociguat |
Adempas |
⇑ |
⇑ |
|
|
|
♣♣ |
Hipertensión pulmonar |
Bayer |
|
384 |
Albiglutida |
Eperzan |
|
|
|
⇑ |
|
♣♣ |
Diabetes mellitus de tipo 2 |
Glaxo SmithKline |
|
384 |
Canagliflozina |
Invokana |
|
|
|
|
|
♣ |
Diabetes mellitus de tipo 2 |
Janssen Cilag |
|
384 |
Empagliflozina |
Jardiance |
|
|
|
|
|
♣ |
Diabetes mellitus de tipo 2 |
Boehringer |
|
383 |
Dasabuvir |
Exviera |
⇑ |
|
|
|
|
♣♣ |
Hepatitis C |
Abbvie |
|
383 |
Ombitasvir/ Paritaprevir/ Ritonavir |
Viekirax |
⇑ |
|
|
|
|
♣♣ |
Hepatitis C |
Abbvie |
|
383 |
Ledipasvir/Sofosbuvir |
Harvoni |
⇑ |
|
|
|
|
♣♣ |
Hepatitis C |
Gilead |
|
383 |
Pixantrona |
Pixuvri |
⇑ |
|
⇑ |
|
|
♣♣ |
Linfoma no hodgkiniano de células B |
Servier |
|
383 |
Tianeptina |
Zinosal |
⇑ |
⇑ |
|
|
|
♣♣ |
Depresión |
Juste |
|
382 |
Radio [223Ra], cloruro |
Xofigo |
|
⇑ |
⇑ |
|
|
♣♣ |
Cáncer de próstata |
Bayer |
|
382 |
Regorafenib |
Stivarga |
⇑ |
|
|
|
|
♣♣ |
Cáncer colorrectal/GIST |
Bayer |
|
382 |
Sufentanilo |
Sufentanilo GES |
|
|
|
|
|
♣ |
Anestesia/sedación |
GES |
|
381 |
Alemtuzumab |
Lemtrada |
⇑ |
|
|
|
|
♣♣ |
Esclerosis múltiple |
Genzyme |
|
381 |
Olodaterol |
Striverdi Respimat |
|
|
|
|
|
♣ |
EPOC |
Boehringer Ingelheim |
|
380 |
Daclatasvir |
Daklinza |
⇑ |
⇑ |
⇑ |
|
|
♣♣♣ |
Hepatitis C |
Bristol-Myers Squib |
|
380 |
Vandetanib |
Caprelsa |
⇑ |
|
|
|
|
♣♣ |
Cáncer medular de tiroides |
AstraZeneca |
|
380 |
Ruxolitinib |
Jakavi |
⇑ |
⇑ |
|
|
|
♣♣ |
Mielofibrosis |
Novartis |
|
380 |
Fumarato de dimetilo |
Tecfidera |
⇑ |
⇑ |
|
|
|
♣♣ |
Esclerosis múltiple |
Biogen Idec |
|
380 |
Teriflunomida |
Aubagio |
|
|
|
⇑ |
|
♣♣ |
Esclerosis múltiple |
Sanofi Aventis |
|
379 |
Enzalutamida |
Xtandi |
⇑ |
|
|
|
|
♣♣ |
Cáncer de próstata |
Astellas |
|
378 |
Vacuna herpes zóster |
Zostavax |
⇑ |
|
|
|
|
♣♣ |
Prevención del herpes zóster |
Sanofi Pasteur MSD |
|
378 |
Lipegfilgrastim |
Lonquex |
|
|
|
|
|
♣ |
Prevención de neutropenia |
Teva |
|
378 |
Nalmefeno |
Selincro |
|
|
|
⇑ |
|
♣♣ |
Alcoholismo |
Lundbeck |
|
377 |
Sofosbuvir |
Sovaldi |
⇑ |
⇑ |
⇑ |
⇑ |
|
♣♣♣ |
Hepatitis C |
Gilead |
|
377 |
Decitabina |
Dacogen |
⇑ |
|
|
|
|
♣♣♣ |
Leucemia mieloide aguda |
Janssen Cilag |
|
377 |
Vilanterol/Fluticasona |
Relvar Ellipta |
|
|
|
⇑ |
|
♣♣ |
Asma y EPOC |
Glaxo SmithKline |
|
377 |
Vacuna meningococo B |
Bexsero |
⇑ |
|
|
|
⇑ |
♣♣♣ |
Prevención meningitis |
Novartis |
|
377 |
Dexmedetomidina |
Dexdor |
|
⇑ |
|
|
|
♣♣ |
Sedoanalgesia |
Orion |
|
377 |
Dolutegravir |
Tivicay |
⇑ |
|
|
⇑ |
|
♣♣ |
Infección por VIH |
Glaxo SmithKline |
|
376 |
Brentuximab vedotina |
Adcetris |
⇑ |
⇑ |
|
|
|
♣♣ |
Linfomas |
Takeda |
|
376 |
Ocriplasmina |
Jetrea |
⇑ |
|
⇑ |
|
|
♣♣ |
Tracción vitreomacular |
Alcon Cusi |
|
376 |
Ofatumumab |
Arzerra |
⇑ |
|
|
|
|
♣♣ |
Leucemia linfocítica crónica |
Glaxo SmithKline |
|
376 |
Pirfenidona |
Esbriet |
⇑ |
⇑ |
|
|
|
♣♣ |
Fibrosis pulmonar idiopática |
InterMune |
|
376 |
Simeprevir |
Olysio |
⇑ |
⇑ |
⇑ |
⇑ |
|
♣♣♣ |
Hepatitis C |
Janssen Cilag |
|
376 |
Tetradecilsulfato sódico |
Veinfibro |
|
|
|
|
|
♣ |
Escleroterapia de venas |
STD |
|
375 |
Afatinib |
Giotrif |
⇑ |
|
|
|
|
♣♣ |
Cáncer de pulmón |
Boehringer Ingelheim |
|
375 |
Linaclotida |
Constella |
⇑ |
⇑ |
|
|
|
♣♣ |
Síndrome del intestino irritable |
Almirall |
|
375 |
Pertuzumab |
Perjeta |
⇑ |
⇑ |
|
|
|
♣♣♣ |
Cáncer de mama |
Roche |
|
375 |
Pomalidomida |
Imnovid |
⇑ |
|
⇑ |
|
|
♣♣ |
Mieloma múltiple |
Celgene |
A. Clínica: Mejora la eficacia clínica con relación al tratamiento estándar.
B. Molecular: Incorpora variaciones significativas en la estructura molecular
y/o en el mecanismo de acción.
C. Seguridad: Mejora el perfil toxicológico con relación a la terapia estándar.
D. Farmacocinética: Mejora las características farmacocinéticas, con incidencia potencial o demostrada en las condiciones de uso y en la respuesta del paciente.
E. Técnico-Económica: Mejora algún aspecto farmacoeconómico y/o farmacotécnico.
F. Valoración Global
VALORACIÓN DE LA INNOVACIÓN TERAPÉUTICA EN PANORAMA ACTUAL DEL MEDICAMENTO
Es importante indicar que se valora el grado de innovación. Todos los medicamentos no innovadores tienen utilidad terapéutica, en tanto que su autorización por las autoridades sanitarias implica han demostrado rigurosamente su eficacia, su seguridad, su calidad y las condiciones de uso (incluyendo la información contenida en la ficha técnica – sumario de características – y en el prospecto del medicamento). Por tanto, la valoración que se hace se refiere a la incorporación, en el grado que se determine, de algún elemento innovador con respecto a otros medicamentos autorizados previamente para iguales o similares indicaciones terapéuticas o, en su caso, cubriendo la ausencia de éstas. Asimismo, debe considerarse que ésta es una evolución que se practica coincidiendo con la comercialización inicial del medicamento. Se trata, por consiguiente, de una valoración provisional de la innovación realizada en función de la evidencia clínica disponible hasta ese momento, lo que no prejuzga, en ningún caso, el potencial desarrollo de nuevas indicaciones clínicas ni la posible aparición de aspectos desfavorables (efectos adversos graves previamente desconocidos, interacciones, etc.). Se consideran tres posibles niveles, adjudicados en función de la relevancia de la(s) innovación(es) presentes en el nuevo medicamento, siempre en relación al arsenal terapéutico disponible clínicamente en España en el momento de la comercialización:
– SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas (♣)
– INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar (♣♣)
– INNOVACIÓN IMPORTANTE. Aportación sustancial a la terapéutica estándar (♣♣♣).
Se distinguen dos niveles de evidencia científica para los aspectos innovadores de los nuevos medicamentos:
– Evidencia clínica: mediante estudios controlados específicamente diseñados y desarrollados para demostrar lo que pretende ser un avance o mejora sobre la terapia estándar.
– Plausibilidad científica (potencialidad): existencia de aspectos en el medicamento que racionalmente podrían mejorar la terapéutica actual, pero que no han sido adecuadamente demostradas mediante ensayos clínicos, bien por motivos éticos o bien por imposibilidad de realización en el momento de la comercialización del nuevo medicamento: perfil de interacciones, mecanismos nuevos que permiten nuevas vías terapéuticas, nuevos perfiles bioquímicos frente a mecanismos de resistencia microbiana, posibilidad de combinar con otros medicamentos para la misma indicación terapéutica, efectos sobre el cumplimiento terapéutico (por mejoras en la vía, número de administraciones diarias, etc.), mejora de la eficiencia, etc.
El rigor de los datos contrastados mediante ensayos clínicos controlados (evidencia clínica) es determinante en la valoración de la innovación, mientras que las potencialidades solo pueden ser valoradas accesoriamente, como aspectos complementarios de esta valoración. En ningún caso, un medicamento es valorado con un nivel de innovación importante en función de sus ventajas potenciales, si no aporta otras ventajas demostradas clínicamente. Se analizan cinco aspectos de la innovación: clínica, molecular, toxicológica, físico-química y económico-tecnológica. Como ya se ha indicado, la fundamental y determinante es la novedad clínica.
|
MEDICAMENTOS CON NUEVOS PRINCIPIOS ACTIVOS COMERCIALIZADOS EN ESPAÑA |
||||
|
GRUPO TERAPéUTICO |
Principio activo |
Medicamento® |
Laboratorio |
PAM |
|
A. Tracto alimentario y metabolismo |
Albiglutida |
Eperzan |
Glaxo SmithKline |
384 |
|
Canagliflozina |
Invokana |
Janssen Cilag |
384 |
|
|
Empagliflozina |
Jardiance |
Boehringer Ingelheim |
384 |
|
|
Linaclotida |
Constella |
Almirall |
375 |
|
|
C. Aparato cardiovascular |
Riociguat |
Adempas |
Bayer |
384 |
|
Tetradecilsulfato sódico |
Veinfibro |
STD |
376 |
|
|
J. Antiinfecciosos, uso sistémico |
Daclatasvir |
Daklinza |
Bristol-Myers Squibb |
380 |
|
Dasabuvir |
Exviera |
Abbvie |
383 |
|
|
Dolutegravir |
Tivicay |
Glaxo SmithKline |
377 |
|
|
Ledipasvir/Sofosbuvir |
Harvoni |
Gilead |
383 |
|
|
Ombitasvir/Paritaprevir/ Ritonavir |
Viekirax |
Abbvie |
383 |
|
|
Simeprevir |
Olysio |
Janssen Cilag |
376 |
|
|
Sofosbuvir |
Sovaldi |
Gilead |
377 |
|
|
Vacuna meningococo B |
Bexsero |
Novartis |
377 |
|
|
Vacuna herpes zóster |
Zostavax |
Sanofi Pasterur MSD |
378 |
|
|
L. Antineoplásicos y terapia |
Afatinib |
Giotrif |
Boehringer Ingelheim |
375 |
|
Alemtuzumab |
Lemtrada |
Genzyme |
381 |
|
|
Brentuximab vedotina |
Adcetris |
Takeda |
376 |
|
|
Decitabina |
Dacogen |
Janssen Cilag |
377 |
|
|
Enzalutamida |
Xtandi |
Astellas |
379 |
|
|
Lipegfilgrastim |
Lonquex |
Teva |
378 |
|
|
Ofatumumab |
Arzerra |
Glaxo SmithKline |
376 |
|
|
Pertuzumab |
Perjeta |
Roche |
375 |
|
|
Pirfenidona |
Esbriet |
InterMune |
376 |
|
|
Pixantrona |
Pixuvri |
Servier |
383 |
|
|
Pomalidomida |
Imnovid |
Celgene |
375 |
|
|
Regorafenib |
Stivarga |
Bayer |
382 |
|
|
Ruxolitinib |
Jakavi |
Novartis |
380 |
|
|
Teriflunomida |
Aubagio |
Sanofi Aventis |
380 |
|
|
Vandetanib |
Caprelsa |
AstraZeneca |
380 |
|
|
Vemurafenib |
Zelboraf |
Roche |
375 |
|
|
N. Sistema nervioso |
Dexmedetomidina |
Dexdor |
Orion |
377 |
|
Fumarato de dimetilo |
Tecfidera |
Biogen Idec |
380 |
|
|
Nalmefeno |
Selincro |
Lundbeck |
378 |
|
|
Sufentanilo |
Sufentanilo GES |
GES |
382 |
|
|
Tianeptina |
Zinosal |
Juste |
383 |
|
|
R. Aparato respiratorio |
Olodaterol |
Striverdi Respimat |
Boehringer Ingelheim |
381 |
|
Vilanterol/Fluticasona |
Relvar Ellipta |
Glaxo SmithKline |
377 |
|
|
S. Órganos de los sentidos |
Ocriplasmina |
Jetrea |
Alcon Cusi |
376 |
|
V. Varios |
Radio [223Ra], cloruro |
Xofigo |
Bayer |
382 |
|
MEDICAMENTOS CON NUEVOS PRINCIPIOS ACTIVOS COMERCIALIZADOS EN ESPAÑA DURANTE LOS ÚLTIMOS DOCE MESES, POR LABORATORIOS |
|||
|
Laboratorio |
Principio activo |
Medicamento |
PAM |
|
Abbvie |
Dasabuvir |
Exviera |
383 |
|
Ombitasvir/Paritaprevir/Ritonavir |
Viekirax |
383 |
|
|
Alcon Cusi |
Ocriplasmina |
Jetrea |
376 |
|
Almirall |
Linaclotida |
Constella |
375 |
|
Astellas |
Enzalutamida |
Xtandi |
379 |
|
AstraZeneca |
Vandetanib |
Caprelsa |
380 |
|
Bayer |
Radio [223Ra], cloruro |
Xofigo |
382 |
|
Regorafenib |
Stivarga |
382 |
|
|
Riociguat |
Adempas |
384 |
|
|
Biogen Idec |
Fumarato de dimetilo |
Tecfidera |
380 |
|
Boehringer Ingelheim |
Afatinib |
Giotrif |
375 |
|
Empagliflozina |
Jardiance |
384 |
|
|
Olodaterol |
Striverdi Respimat |
381 |
|
|
Bristol-Myers Squibb |
Daclatasvir |
Daklinza |
380 |
|
Celgene |
Pomalodomida |
Imnovid |
375 |
|
Genzyme |
Alemtuzumab |
Lemtrada |
381 |
|
GES |
Sufentanilo |
Sufentanilo GES |
382 |
|
Gilead |
Ledipasvir/Sofosbuvir |
Harvoni |
383 |
|
Sofosbuvir |
Sovaldi |
377 |
|
|
Glaxo SmtihKline |
Albiglutida |
Eperzan |
384 |
|
Dolutegravir |
Tivicay |
377 |
|
|
Ofatumumab |
Arzerra |
376 |
|
|
Vilanterol/Fluticasona |
Relvar Ellipta |
377 |
|
|
InterMune |
Pirfenidona |
Esbriet |
376 |
|
Janssen Cilag |
Canagliflozina |
Invokana |
384 |
|
Decitabina |
Dacogen |
377 |
|
|
Simeprevir |
Olysio |
376 |
|
|
Juste |
Tianeptina |
Zinosal |
383 |
|
Lundbeck |
Nalmefeno |
Selincro |
378 |
|
Novartis |
Ruxolitinib |
Jakavi |
380 |
|
Vacuna meningococo B |
Bexsero |
377 |
|
|
Orion |
Dexmedetomidina |
Dexdor |
377 |
|
Roche |
Pertuzumab |
Perjeta |
375 |
|
Sanofi Aventis |
Teriflunomida |
Aubagio |
380 |
|
Sanofi Pasteur MSD |
Vacuna herpes zóster |
Zostavax |
378 |
|
Servier |
Pixantrona |
Pixuvri |
383 |
|
STD |
Tetradecilsulfato sódico |
Veinfibro |
376 |
|
Takeda |
Brentuximab vedotina |
Adcetris |
376 |
|
Teva |
Lipegfilgrastim |
Lonquex |
378 |