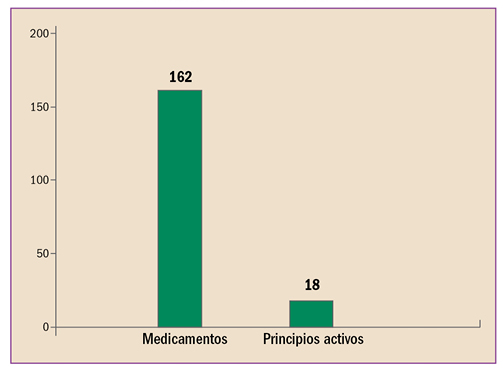
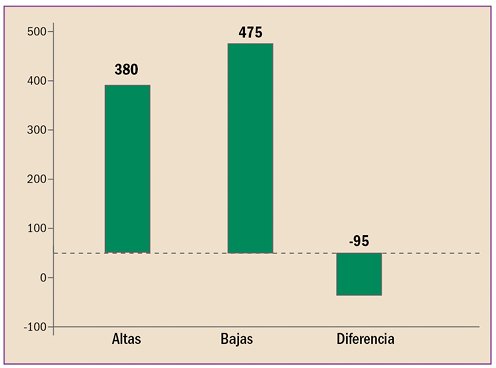
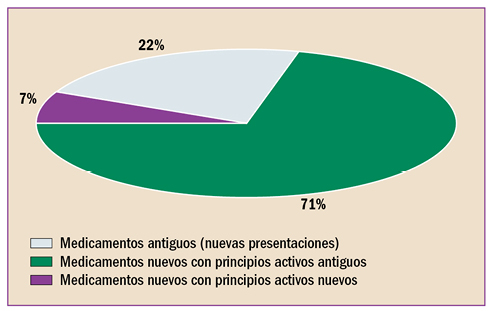
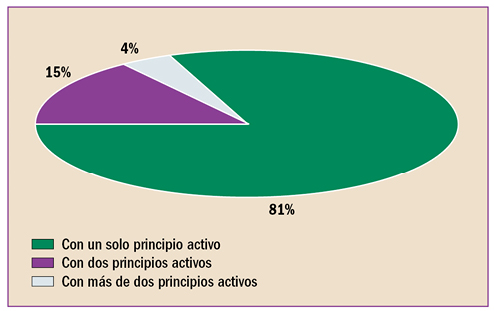
En la revisión periódica de los datos de seguridad de pomalidomida (▼Imnovid®), se ha identificado que puede provocar toxicidad hepática grave, enfermedad pulmonar intersticial (EPI) e insuficiencia cardiaca. Por ello, la AEMPS, recomienda monitorizar periódicamente la función hepática de los pacientes durante los primeros 6 meses de tratamiento con pomalidomida y posteriormente, cuando esté clínicamente indicado. En caso de que sea necesario iniciar el tratamiento en pacientes con enfermedad cardiaca pre-existente o factores de riesgo, vigilar la evolución del paciente y la posible aparición de insuficiencia cardiaca. Descartar EPI en caso de inicio repentino o empeoramiento idiopático de los síntomas pulmonares en pacientes en tratamiento con pomalidomida y suspender el tratamiento hasta el diagnóstico definitivo.
Recientemente la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado1 de los resultados de la revisión de la información de seguridad relativa a pomalidomida (▼Imnovid®), en cuanto a casos de toxicidad hepática grave, enfermedad pulmonar intersticial (EPI) e insuficiencia cardiaca.
Pomalidomida es un agente inmunomodulador que, en combinación con dexametasona, se encuentra indicada en pacientes adultos con mieloma múltiple resistente al tratamiento y recidivante que hayan recibido al menos dos tratamientos previos, incluyendo lenalidomida y bortezomib, y que hayan experimentado una progresión de la enfermedad en el último tratamiento.
En una revisión europea llevada a cabo como parte de la evaluación periódica de seguridad de pomalidomida, se concluyó que puede provocar toxicidad hepática grave, enfermedad pulmonar intersticial (EPI) e insuficiencia cardíaca.
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios. Pomalidomida (▼Imnovid®): riesgo de toxicidad hepática grave, insuficiencia cardiaca uy enfermedad pulmonar intersticial. Nota informativa MUH (FV), nº 5/2015, 24 de abril de 2015. Disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2015/docs/NI-MUH_FV_05-poliadomida.pdf (consultado 09 junio 2015).
IMPORTANTE
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) se basa en el programa de notificación espontánea de un profesional sanitario (médico, odontólogo, farmacéutico, enfermero, otros) de una sospecha de relación entre un medicamento (incluidos vacunas, sueros, gases medicinales, fórmulas magistrales, plantas medicinales) y un síntoma o signo adverso (reacción adversa, RAM) que manifieste el paciente (programa de tarjeta amarilla). El Real Decreto 577/2013 de Farmacovigilancia de medicamentos de uso humano (BOE núm. 179, de 27 de julio de 2013) entró en vigor el 28 de julio de 2013. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) coordina el SEFV-H.
¿Qué notificar?
Se deben notificar las sospechas de RAM:
– con medicamentos autorizados, incluidas las de aquellos que se hayan utilizado en condiciones diferentes a las autorizadas o con medicamentos extranjeros importados con autorización de la AEMPS,
– principalmente las RAM ‘graves’ (mortales, o que amenacen la vida, prolonguen o provoquen una hospitalización, causen incapacidad o sean médicamente importantes y las trasmisiones de un agente infeccioso a través de un medicamento) o RAM ‘inesperadas’ de cualquier medicamento,
– con medicamentos de ‘seguimiento adicional’ (durante sus primeros 5 años desde la autorización, identificados con un triángulo negro invertido (▼) a la izquierda del nombre del medicamento en el material informativo, en el prospecto y en la ficha técnica); ver la lista mensual de los medicamentos con triángulo negro en la web de la AEMPS, en la sección de CIMA con criterio de búsqueda del “Triángulo negro”: http://www.aemps.gob.es/cima/pestanias.do?metodo=accesoAplicaciona
– las que sean consecuencia de ‘errores de medicación’, que ocasionen daño en el paciente,
– las originadas por ‘interacciones’ con medicamentos, plantas medicinales, incluso alimentos (zumo de pomelo, ahumados, crucíferas, etc).
¿Cómo notificar?
No olvide notificar cualquier sospecha de RAM a su Centro Autonómico o Regional de Farmacovigilancia mediante las ‘tarjetas amarillas’. Consulte en este directorio su Centro Autonómico de Farmacovigilancia correspondiente.
NUEVO MÉTODO: se puede notificar a través del sitio web https://www.notificaRAM.es/, y el sistema electrónico hace llegar a su centro correspondiente la notificación de sospecha de RAM. Sirve para profesionales sanitarios y para ciudadanos, en formularios diferentes. La nueva legislación europea de farmacovigilancia establece esta posibilidad para facilitar la notificación de las sospechas de RAM por la población en general.
¿Dónde conseguir tarjetas amarillas?
Consultando a su Centro correspondiente del SEFV-H. Podrá encontrar el directorio de Centros en las primeras páginas del “Catálogo de Medicamentos” y en las páginas de Internet http://www.portalfarma.com y http://www.aemps.gob.es/vigilancia/medicamentosUsoHumano/docs/dir_serfv.pdf.
¿Dónde consultar las fichas técnicas y prospectos de los medicamentos?
En la página web de la AEMPS http://www.aemps.gob.es >> seleccionando >> ”CIMA: Centro de Información on-line de Medicamentos de la AEMPS, Humanos”, se pueden consultar por nombre comercial o por sus principios activos. También están disponibles en la base de datos BOT Plus.
NOTA: la mención de marcas comerciales en el texto solo tiene fines de identificación, y en absoluto se les debe asignar directamente lo descrito en el texto.