Resumen
El Consejo General de Colegios Oficiales de Farmacéuticos, la Fundación Pharmaceutical Care, la Sociedad Española de Farmacia Familiar y Comunitaria (SEFAC), la Unidad de Farmacia Clínica y Farmacoterapia de la Universidad de Barcelona y el Grupo de Investigación en AF de la Universidad de Granada constituyen el Grupo de Trabajo denominado Foro de Atención Farmacéutica en Farmacia Comunitaria (Foro AF-FC).
Foro AF-FC está trabajando desde 2008 en la difusión de los procedimientos de los Servicios Profesionales Farmacéuticos, específicamente los Servicios consensuados vinculados con la Atención Farmacéutica (1,2), con la colaboración de laboratorios Cinfa.
La clave de esos Servicios reside en el enfoque asistencial de cualquiera de ellos, que conlleva la responsabilidad profesional de conseguir el mejor resultado posible de los tratamientos farmacológicos prescritos, dispensados o indicados a los pacientes, en ese entorno. Este enfoque profesional ha dado lugar a la práctica de la entrevista clínica como paso indispensable para la evaluación de los Problemas Relacionados con los Medicamentos (PRM) y/o de los Resultados Negativos asociados a la Medicación (RNM) que haya que resolver en cada paciente atendido.
En este sentido, y con el fin de asegurar la continuidad asistencial, la Farmacia Comunitaria, en colaboración con la Farmacia Hospitalaria y otros profesionales sanitarios, puede impulsar y mejorar los procesos de Conciliación de la medicación de los pacientes en la transición de niveles asistenciales (Figura1).
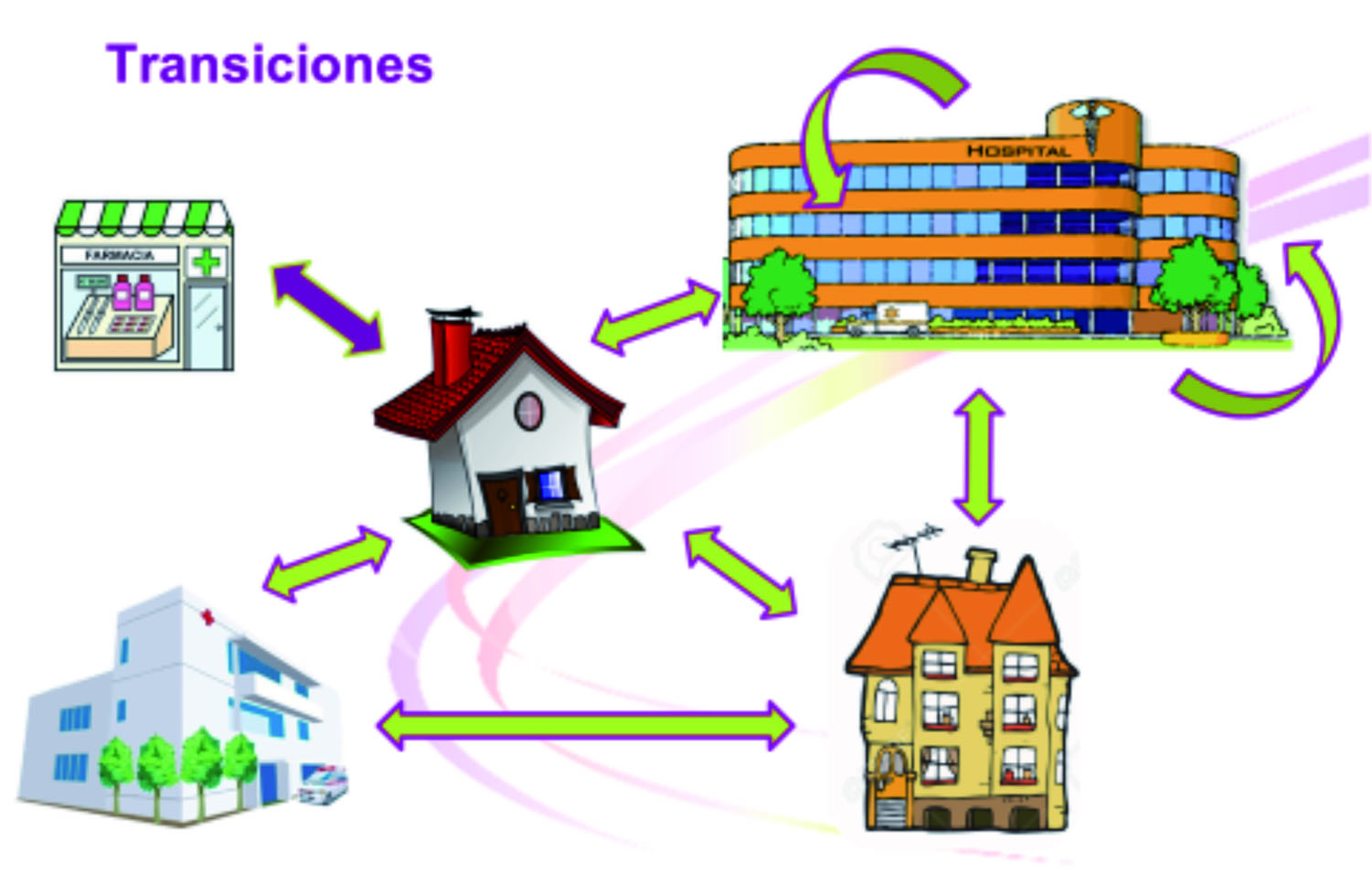
Figura 1- Transición entre niveles asistenciales, presentación en Infarma 24 de marzo 2015, Barcelona
Como punto de partida se considera fundamental definir y procedimentar este Servicio en el entorno de la Farmacia Comunitaria, para, en sinergia con los diferentes niveles, proporcionar la colaboración necesaria en la consecución del mejor resultado de la farmacoterapia en el paciente tras un alta hospitalaria, en coordinación con hospital y primaria.
Por todo ello Foro AF-FC consensua en diciembre de 2014 la información que se destaca a continuación, publicada y editada en el folleto divulgativo Documento “Servicio de Conciliación de la Medicación en la Farmacia Comunitaria” (Figura 2) accesible desde

Figura 2- Documento «Servicio de Conciliación de la Medicación en la Farmacia Comunitaria»
¿QUE ES LA CONCILIACIÓN DE LA MEDICACIÓN?
Según la Sociedad Americana de Farmacia Hospitalaria:
La Conciliación de la Medicación (medication reconciliation) es el proceso formal y estandarizado de obtener la lista completa de la medicación previa de un paciente, compararla con la prescripción activa, y analizar y resolver las discrepancias encontradas (3).
La Conciliación de la Medicación es un proceso formal y protocolizado que incluye los siguientes pasos (4):
- Obtener el listado completo y preciso de la medicación utilizada previamente por el paciente, incluyendo el nombre del medicamento, dosis, vía y frecuencia de administración. Debe incluir medicamentos sujetos a prescripción médica y medicamentos no sujetos a prescripción médica, como medicamentos OTC, vitaminas, plantas medicinales, etc.
- Identificar todas las necesidades farmacoterapéuticas del paciente, de acuerdo a su situación clínica actual.
- Comparar el listado con la prescripción médica actual, identificar discrepancias, comunicar al médico prescriptor todas las discrepancias que requieren aclaración que han sido observadas y, finalmente, documentar y comunicar cualquier cambio en el tratamiento al paciente, familiar o cuidador.
Una Discrepancia es cualquier diferencia entre la medicación habitual que el paciente tomaba previamente y la medicación prescrita después de una transición asistencial (5).
Una Transición asistencial es toda interfaz en la que la prescripción debe ser revisada y nuevamente registrada. A nivel hospitalario incluye el ingreso, traslado de servicio y el alta hospitalaria; desde el punto de vista ambulatorio habría que incluir la atención domiciliaria, la asistencia a urgencias o a diferentes consultas médicas, así como los cambios de domicilio y de médico de familia o los ingresos en centros sociosanitarios(6).
¿POR QUÉ ES NECESARIO EL SERVICIO DE CONCILIACIÓN DE LA MEDICACIÓN?
01 La seguridad de los pacientes se considera un aspecto clave de las políticas de calidad de los sistemas de salud (7,8). Para disminuir los efectos adversos de los medicamentos es preciso reconocer que los mismos existen, identificarlos, y analizar sus causas (9).
02 La aparición de problemas asociados a la falta de efectividad de los tratamientos es muy frecuente durante las diferentes transiciones asistenciales de los pacientes (5).
03 Con la conciliación de la medicación se podrían reducir (10):

04 La conciliación de la medicación permite detectar PRM y RNM, especialmente el RNM de no necesidad en el paciente polimedicado, lo que puede reducir su impacto en el sistema sanitario (11).
05 Existen diferentes factores que influyen en la aparición de errores en la medicación en la transición entre los diferentes niveles asistenciales (5).
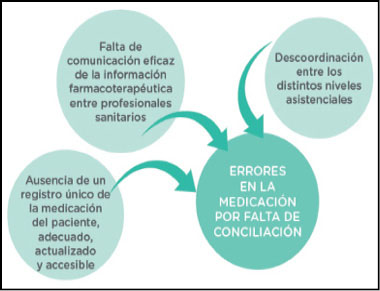
06 Todos los puntos en los que el paciente cambia de profesional responsable son especialmente vulnerables a los errores de conciliación (5):
- Ingreso hospitalario
- Cambio de especialista
- Automedicación
- Alta hospitalaria
- Traslado a centro sociosanitario
07 Los errores en el momento del alta hospitalaria son los que comportan mayor riesgo potencial para el paciente (5).
SERVICIO DE CONCILIACION DE LA MEDICACIÓN EN LA FARMACIA COMUNITARIA
Foro AF-FC está comprometido con el impulso y desarrollo de nuevos Servicios Profesionales Farmacéuticos. En consecuencia está trabajando en la metodología y terminología propias de este Servicio Asistencial en Farmacia Comunitaria, y en su integración en el marco del resto de Servicios de Atención Farmacéutica.
El primer paso ha sido definir el Servicio de Conciliación en la Farmacia Comunitaria, consensuando la siguiente definición:
La Conciliación de la Medicación en Farmacia Comunitaria es el servicio profesional en el que el farmacéutico realiza una comparación sistemática y protocolizada de la lista de medicamentos utilizados por el paciente, antes y después de una transición entre niveles asistenciales, con el objetivo de asegurar la necesidad, efectividad y seguridad del tratamiento farmacológico actual realizando las oportunas intervenciones, en coordinación con los profesionales sanitarios implicados. La actuación principal de este servicio consiste en la identificación, por parte del farmacéutico comunitario, de posibles discrepancias para su posterior análisis, evaluación y resolución, en su caso.
El Servicio de Conciliación en la Farmacia Comunitaria cobra especial interés en situaciones como las siguientes:
- Al alta hospitalaria del paciente que regresa a su domicilio.
- Al ingreso en centros sociosanitarios atendidos por Farmacia Comunitaria.
- En el domicilio del paciente tras el alta en la hospitalización domiciliaria.
Además, la Farmacia Comunitaria puede colaborar con Farmacia Hospitalaria al ingreso de un paciente proporcionando el listado de medicamentos que el paciente utiliza en atención primaria.
PARA TODO ELLO ES PRECISO:
 |
El diseño de las herramientas necesarias para el desarrollo de este Servicio. |
 |
La mejora y optimización de los mecanismos de comunicación entre Farmacia Comunitaria y Farmacia Hospitalaria y otros profesionales de la salud. |
 |
El impulso de iniciativas de formación y comunicación para el desarrollo de este Servicio en Farmacia Comunitaria. |
 |
La elaboración de protocolos de coordinación entre los diferentes niveles asistenciales, especialmente con Farmacia Hospitalaria. |
 |
El desarrollo de estudios de aplicabilidad y medición de resultados de salud que amplíen el conocimiento sobre este Servicio y demuestren su valor añadido para el Sistema de Salud. |
Foro AF-FC ha puesto en marcha un grupo de trabajo en colaboración con la SEFH y la vocalía de farmacéuticos de hospital, inicialmente, contará con la participación de farmacéuticos de primaria, para el desarrollo de un estudio del Servicio coordinado de conciliación de la medicación entre niveles asistenciales. La puesta en marcha de este grupo de trabajo demuestra el compromiso adquirido e interés de Foro AF-FC en el impulso y desarrollo de nuevos Servicios Profesionales Farmacéuticos que posibiliten la mejora de la calidad de vida de los pacientes.

D. Eduardo Mariño, D. Teodomiro Hidalgo, D. Fernando Martínez, Dña. Raquel Varas, D. Jose Antonio Fornos, Dña Ana Aliaga, Dña. Flora Guisasola, Dña. Mª Sol Ucha, Dña. Flor Alvarez de Toledo, D. Federico Tutau, D. Francisco Farfan, D. Miguel Ángel Gastelurrutia Y Dña. Ana Molinero. Comisión de conciliación; representantes de FORO AF-FC, SEFH y Vocalía de Farmacéuticos de Farmacia Hospitalaria reunidos on line y de forma presencial el pasado 18 de marzo 2015.
BIBLIOGRAFÍA
- Foro de Atención Farmacéutica en Farmacia Comunitaria, panel de expertos. Guía Práctica para los Servicios de Atención Farmacéutica en la Farmacia Comunitaria, mayo de 2010. Ed. Consejo General de Colegios Oficiales de Farmacéuticos, Madrid. ISBN-13: 978-84-693-1717-4.
- Foro de Atención Farmacéutica en Farmacia Comunitaria, panel de expertos. Actualidad y comunicación, 2012. Ed. Consejo General de Colegios Oficiales de Farmacéuticos, Madrid. ISBN-13: 978-84-695-4660-4.
- Roure C, Aznar T, Delgado O, Fuster L, Villar I. Grupo coordinador del grupo de trabajo de la SEFH de conciliación de la medicación. Documento de Consenso en terminología y clasificación en conciliación de la medicación. Ediciones Mayo, Barcelona; 2009.
- Institute for Healthcare Improvement (IHI). Prevent adverse drugs events with medication reconciliation. Disponible en: http://www.ihi.org/explore/ADEsMedicationReconciliation/Pages/default.aspx. Consulta: 23/05/2012.
- Rodríguez G, Rosich I. Conciliación de la medicación. Capítulo 2. Elementos básicos del abordaje de la medicación en el paciente crónico: Información al paciente, conciliación, revisión y adherencia. SEFAP 2012. Disponible en: http://issuu.com/sefap/docs/sefap/1. Último acceso: Diciembre de 2014
- Departamento de Salud del Gobierno Vasco. Conciliación de la Medicación. Información farmacoterapéutica de la comarca (INFAC) 2013: Volumen 21 (10). Disponible en: http://www.osakidetza.euskadi.net/contenidos/informacion/cevime_infac/es_cevime/adjuntos/INFAC_Vol_21_n_10.pdf. Último acceso: Diciembre de 2014.
- Estudio nacional sobre los efectos adversos ligados a la hospitalización: ENEAS 2005. Madrid: Ministerio de Sanidad y Consumo; 2006. Disponible en: http://www.msssi.gob.es/eu/organizacion/sns/planCalidadSNS/pdf/excelencia/opsc_sp2.pdf. Último acceso: Diciembre de 2014.
- Estudio sobre la seguridad de los pacientes en atención primaria de salud: APEAS 2008. Madrid: Ministerio de Sanidad y Consumo; 2008. Disponible en: http://www.msssi.gob.es/organizacion/sns/planCalidadSNS/docs/estudio_apeas.pdf. Último acceso: Diciembre de 2014.
- Durán-García E, Fernandez-Llamazares CM, Calleja-Hernández MA. Medication reconciliation: passing phase or real need? Int J Clin Pharm. 2012;34(6):797-802.
- ISMP Medication Safety Alert!, July 13, 2006. Disponible en: http://www.ismp.org/newsletters/acutecare/ articles/20060713.asp. Último acceso: Diciembre de 2014.
- Tomás Vecina S, García Sánchez L, Pascual Arce B, et al. Programa de intervención farmacéutica en el servicio de urgencias para mejorar la seguridad del paciente. Emergencias 2010; 22:85-90.
Este documento y más información de interés está disponible en las páginas webs de todas las instituciones que conforman FORO AF-FC:
- www.portalfarma.com
- www.pharmaceutical-care.org
- www.sefac.org
- www.atencionfarmaceutica-ugr.es
- www.ub.edu/farcli/wp0.html