|
FECHA |
REF. |
TÍTULO ALERTA |
MEDICAMENTO |
PRINCIPIO ACTIVO |
MEDIDAS A TOMAR |
MOTIVOS |
ALERTA RELACIONADA |
|---|---|---|---|---|---|---|---|
|
13 Febrero |
2/2015 |
Hidroxizina (Atarax): nuevas restricciones de uso para minimizar su riesgo arritmogénico |
Atarax |
Hidroxizina |
Uso contraindicado en pacientes con prolongación del intervalo QT congénito o adquirido o con factores de riesgo predisponentes para la prolongación del mismo. No se recomienda utilizar en pacientes de edad avanzada. Administrar la menor dosis eficaz y durante el menor tiempo posible. (Dosis máximas no deben superar 100 mg/día en adultos y 2 mg/kg/día en niños de hasta 40 kg de peso) |
Revisión de datos sobre riesgo de prolongación del intervalo QT del ECG y de torsade de pointes, asociado al uso de hidroxizina |
— |
Archive
Revista PAM: 381
Número 381, Marzo 2015
Nuevas indicaciones aprobadas 2015
Modificaciones de Medicamentos marzo 2015
|
CAMBIO DE PRECIO Y CODIGO NACIONAL (marzo) |
|||
|---|---|---|---|
|
CN Nuevo |
PVP nuevo |
NOMBRE Y PRESENTACIÓN |
CN Antiguo |
|
700544 |
74.78 |
Anasma accuhaler 50/500 mcg 60 dosis |
843029 |
|
700543 |
55.42 |
Anasma accuhaler 50/250 mcg 60 dosis |
842906 |
|
700541 |
55.42 |
Brisair accuhaler 50/250 mg 60 alveolos |
934406 |
|
700540 |
74.78 |
Brisair accuhaler 50/500 mg 60 alveolos |
934380 |
|
700550 |
5.35 |
Citorsal 2 bolsas |
653593 |
|
700551 |
16.24 |
Genoxal 1 g 1 vial |
672085 |
|
700546 |
74.78 |
Inaladuo accuhaler 50/500 mcg 60 dosis |
849000 |
|
700545 |
55.42 |
Inaladuo accuhaler 50/250 mcg 60 dosis |
848689 |
|
700539 |
74.78 |
Seretide accuhaler 50/500 mcg 60 alveolos |
804997 |
|
700538 |
55.42 |
Seretide accuhaler 50/500 mcg 60 alveolos |
804757 |
|
CAMBIO EN LAS CONDICIONES DE DISPENSACIÓN/OFERTA AL SNS (Acumulado desde enero 2015) |
|
|---|---|
|
MEDICAMENTO |
ACTUAL |
|
667808 Acilostat 200 mg 100 comprimidos |
Exclusión SNS. No facturable junio 2015 |
|
699829 Azitromicina onedose 500 mg 3 compr |
Exclusión SNS. No facturable abril 2015. |
|
659323 Bialfoli 5 mg 60 comprimidos |
Exclusión SNS. No facturable julio 2015 |
|
699831 Ciprofloxacino onedose 250 mg 14 compr |
Exclusión SNS. No facturable abril 2015. |
|
699833 Ciprofloxacino onedose 500 mg 14 compr |
Exclusión SNS. No facturable abril 2015. |
|
695999 Claritromicina onedose 250 mg 14 compr |
Exclusión SNS. No facturable abril 2015. |
|
696002 Claritromicina onedose 500 mg 21 compr |
Exclusión SNS. No facturable abril 2015. |
|
696001 Claritromicina onedose 500 mg 14 compr |
Exclusión SNS. No facturable abril 2015. |
|
660257 Claritromicina Sandoz 100 ml 50 mg/ml |
Exclusión SNS. No facturable agosto 2015 |
|
654112 Colchimax 0.5/5 mg 60 comprimidos |
Exclusión SNS. No facturable octubre 2015 |
|
679845 Dalsy 400 mg 30 comprimidos |
Exclusión SNS. No facturable septiembre 2015 |
|
660782 Dalsy suspensión 150 ml |
Exclusión SNS. No facturable septiembre 2015 |
|
666107 Dalsy 20 mg/ml. suspensión 200 ml |
Exclusión SNS. No facturable septiembre 2015 |
|
662876 Dexketoprofeno Menarini 25 mg 20 sobres |
Exclusión SNS. No facturable junio 2015 |
|
651567 Diovan cardio 40 mg 14 comprimidos |
Exclusión SNS. No facturable julio 2015 |
|
901249 Dolo Voltaren 20 comprimidos |
Exclusión SNS. No facturable junio 2015 |
|
662879 Enantyum 25 mg 20 sobres |
Exclusión SNS. No facturable junio 2015 |
|
950584 Enison 5 mg 1 vial |
Paso a Hospitalario. No facturable marzo 2015 |
|
766287 Equin 0.6 28 comprimidos |
Exclusión SNS. No facturable octubre 2015 |
|
687719 Esomeprazol Ethypharm 20 mg 28 compr |
Exclusión SNS. No facturable octubre 2015 |
|
687717 Esomeprazol Ethypharm 20 mg 14 compr |
Exclusión SNS. No facturable octubre 2015 |
|
687728 Esomeprazol Ethypharm 40 mg 14 compr |
Exclusión SNS. No facturable octubre 2015 |
|
687730 Esomeprazol Ethypharm 40 mg 28 compr |
Exclusión SNS. No facturable octubre 2015 |
|
679427 Espidifen 600 mg 40 sobres |
Exclusión SNS. No facturable marzo 2015. |
|
878561 Estraderm Matrix 100 mcg 8 parches |
Exclusión SNS. No facturable octubre 2015 |
|
730587 Estraderm Matrix 50 mcg 8 parches |
Exclusión SNS. No facturable octubre 2015 |
|
816223 Estraderm Matrix 25 mcg 8 parches |
Exclusión SNS. No facturable octubre 2015 |
|
756056 Febrectal adultos 600 mg 6 supositorios |
Exclusión SNS. No facturable octubre 2015 |
|
756072 Febrectal adultos 300 mg 6 supositorios |
Exclusión SNS. No facturable octubre 2015 |
|
652367 Folinato Cálcico Teva 10 ml |
Paso a Hospitalario. No facturable febrero 2015 |
|
652368 Folinato Cálcico Teva 20 ml |
Paso a Hospitalario. No facturable febrero 2015 |
|
652369 Folinato Cálcico Teva 30 ml |
Paso a Hospitalario. No facturable febrero 2015 |
|
652372 Folinato Cálcico Teva 5 ml |
Paso a Hospitalario. No facturable febrero 2015 |
|
654625 Glutaferro 170 mg/ml frasco 25 ml |
Exclusión SNS. No facturable julio 2015 |
|
654702 Ibuprofeno Arginina Cinfa 600 4 sobres |
Exclusión SNS. No facturable octubre 2015 |
|
660693 Ibuprofeno Arginina Sandoz 600 4 sobres |
Exclusión SNS. No facturable octubre 2015 |
|
654668 Ibuprofeno Kern Pharma 600 mg 40 sobres |
Exclusión SNS. No facturable junio 2015 |
|
685706 Ibuprofeno onedose 600 mg 40 compr |
Exclusión SNS. No facturable abril 2015. |
|
6528440 Kalpress cardio 40 mg 14 comprimidos |
Exclusión SNS. No facturable julio 2015 |
|
662878 Ketesse 25 mg 20 sobres |
Exclusión SNS. No facturable junio 2015 |
|
698321 Lansoprazol onedose 15 mg 28 capsulas |
Exclusión SNS. No facturable abril 2015. |
|
698322 Lansoprazol onedose 15 mg 28 capsulas |
Exclusión SNS. No facturable abril 2015. |
|
698323 Lansoprazol onedose 30 mg 28 cápsulas |
Exclusión SNS. No facturable abril 2015. |
|
698324 Lansoprazol onedose 30 mg 28 cápsulas |
Exclusión SNS. No facturable abril 2015. |
|
698326 Lansoprazol onedose 30 mg 14 cápsulas |
Exclusión SNS. No facturable abril 2015. |
|
688325 Lansoprazol onedose 30 mg 14 cápsulas |
Exclusión SNS. No facturable abril 2015. |
|
692199 Levofloxacino onedose 500 mg 7 compr |
Exclusión SNS. No facturable abril 2015. |
|
692200 Levofloxacino onedose 500 mg 14 compr |
Exclusión SNS. No facturable abril 2015. |
|
696687 Levotiroxina Sanofi 500 mcg 1 vial |
Paso a Hospitalario. No facturable junio 2015 |
|
652839 Miten Cardio 40 mg 14 comprimidos |
Exclusión SNS. No facturable julio 2015 |
|
663798 Olanzapina Actavis 28 compr |
Exclusión SNS. No facturable abril 2015. |
|
840686 Octostim 1 frasco 2.5 ml |
No facturable julio 2015. Dispensación Hospital. Aportación reducida |
|
685699 Paracetamol onedose 1 g 40 comprimidos |
Exclusión SNS. No facturable abril 2015. |
|
685698 Paracetamol onedose 1 g 20 comprimidos |
Exclusión SNS. No facturable abril 2015. |
|
774067 Paracodina jarabe 125 ml |
Exclusión SNS. No facturable enero 2015 |
|
693288 Pantoprazol onedose 40 mg 14 compr |
Exclusión SNS. No facturable abril 2015. |
|
693286 Pantoprazol onedose 40 mg 28 compr |
Exclusión SNS. No facturable abril 2015. |
|
674747 Progynova 50 mcg/24 h 4 parches |
Exclusión SNS. No facturable octubre 2015 |
|
681200 Quetiapina Actavis 25 mg 60 compr |
Exclusión SNS. No facturable abril 2015. |
|
662877 Quiralam 25 mg 20 sobres |
Exclusión SNS. No facturable junio 2015 |
|
650444 Reandron 1 g 1 ampolla |
Exclusión SNS. No facturable agosto 2015 |
|
653050 Risperidona Mylan 4 mg 28 comprimidos |
Exclusión SNS. No facturable junio 2015 |
|
870063 Seroquel 25 mg 6 comprimidos |
Exclusión SNS. No facturable junio 2015 |
|
685696 Unebril 650 mg 20 compr |
Exclusión SNS. No facturable abril 2015. |
|
685697 Unebril 650 mg 40 compr |
Exclusión SNS. No facturable abril 2015. |
|
685705 Unodol 400 mg 30 compr |
Exclusión SNS. No facturable abril 2015. |
|
677359 Unodol 400 mg 1 compr |
Exclusión SNS. No facturable abril 2015. |
|
693268 Venlafaxina onedose 150 mg 30 caps |
Exclusión SNS. No facturable abril 2015. |
|
693271 Venlafaxina onedose 75 mg 30 caps |
Exclusión SNS. No facturable abril 2015. |
|
686782 Xeloda 500 mg 120 comprimidos |
Exclusión SNS. No facturable. |
|
686774 Xeloda 150 mg 60 comprimidos |
Exclusión SNS. No facturable. |
|
674192 Xenetix 250 mg frasco 200 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
674200 Xenetix 250 mg frasco 100 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
674218 Xenetix 250 mg frasco 50 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
658141 Xenetix 300 mg bolsa 100 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
659142 Xenetix 300 mg bolsa 500 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
674168 Xenetix 300 mg frasco 500 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
674176 Xenetix 300 mg frasco 100 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
674184 Xenetix 300 mg frasco 50 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
698351 Xenetix 300 mg bolsa 150 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
698352 Xenetix 300 mg bolsa 200 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
658309 Xenetix 350 mg bolsa 100 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
658311 Xenetix 350 mg bolsa 150 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
658312 Xenetix 350 mg bolsa 200 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
658313 Xenetix 350 mg bolsa 500 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
674135 Xenetix 350 mg frasco 200 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
674143 Xenetix 350 mg frasco 100 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
674150 Xenetix 350 mg frasco 50 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
707406 Xenetix 350 mg frasco 150 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
707471 Xenetix 350 mg frasco 500 ml |
Paso a Hospitalario. No facturable mayo 2015 |
|
MODIFICACIONES DE NOMBRE (Acumulado desde enero 2015) |
|
|---|---|
|
NOMBRE ACTUAL |
NOMBRE ANTERIOR |
|
Atenolol/Clortalidona Qualigen |
Normopresil |
|
Carvedilol Placasod |
Carvedilol Sandoz |
|
Carvedilol Sandoz (Sandoz) |
Carvedilol Bexal (Bexal) |
|
Clopidogrel Ababor (Ababor) |
Clopidogrel Edigen (Germed) |
|
Lansoprazol Pharma Combix (Combix) |
Lansoprazol Edigen (Germed) |
|
Memantina Pharma Combix (Combix) |
Memantina Zydus France (Zydus France) |
|
Mirtazapina Mylan |
Mirtamylan |
|
Paroxetina Stadagen (Stada) |
Paroxetina Farmalider (Farmalider) |
|
Tramadol Sandoz (Sandoz) |
Tramadol Bexal (Bexal) |
|
Zolmitriptan Aristo (Aristo Pharma) |
Zolmitriptan Geprem (Premium Pharma) |
Medicamentos dados de baja (marzo 2015)
|
CÓDIGO |
NOMBRE, PRESENTACIÓN Y LABORATORIO |
|---|---|
|
6116654 |
ACTIRA 400 MG 100 COMPRIMIDOS RECUBIERTOS (BAYER HISPANIA S.L.) |
|
8414291 |
ACTIRA 400 MG 5 COMPRIMIDOS RECUBIERTOS (BAYER HISPANIA S.L.) |
|
8414529 |
ACTIRA 400 MG 7 COMPRIMIDOS RECUBIERTOS (BAYER HISPANIA S.L.) |
|
6982952 |
AMLODIPINO/ATORVASTATINA TEVA EFG 10/10 MG 28 COMPRIMIDOS RECUBIERTOS (TEVA PHARMA S.L.U.) |
|
6983102 |
AMLODIPINO/ATORVASTATINA TEVA EFG 5/10 MG 28 COMPRIMIDOS RECUBIERTOS (TEVA PHARMA S.L.U.) |
|
6968123 |
AMOXICILINA/ACIDO CLAVULANICO RATIOPHARM EFG 250/62.5 MG/5 ML SUSPENSION ORAL 1 FRASCO 100 ML (RATIOPHARM) |
|
6719060 |
AMOXICILINA/ACIDO CLAVULANICO RATIOPHARM EFG 250/62.5 MG/5 ML SUSPENSION ORAL 1 FRASCO 120 ML (RATIOPHARM) |
|
6637555 |
ANTISTAX 180 MG 50 CAPSULAS (BOEHRINGER INGELHEIM ESPAÑA) |
|
6830338 |
ARUSOPT 20 MG/ML COLIRIO 1 FRASCO SOLUCION 5 ML (BAUSCH & LOMB) |
|
6608456 |
BUTO AIR 5 MG/ML SOLUCION INHALACION 20 ML (ALDO UNION) |
|
6738788 |
CANDESARTAN ALTER EFG 4 MG 14 COMPRIMIDOS (ALTER) |
|
6562727 |
CARDISER RETARD 300 MG 28 CAPSULAS LIBERACION PROLONGADA (MERCK S.L.) |
|
6535936 |
CITORSAL POLVO ORAL 2 BOLSAS 28 G (ERN) |
|
6536018 |
CITORSAL POLVO ORAL 5 BOLSAS 28 G (ERN) |
|
6713273 |
CLOPIDOGREL GENTIAN GENERICS EFG 75 MG 28 COMPRIMIDOS RECUBIERTOS (GENTIAN GENERICS LIMITED) |
|
6515679 |
DIOVAN CARDIO 40 MG 14 COMPRIMIDOS RECUBIERTOS (NOVARTIS FARMACEUTICA) |
|
6002803 |
DIOVAN CARDIO 40 MG 280 COMPRIMIDOS RECUBIERTOS (NOVARTIS FARMACEUTICA) |
|
6829608 |
DORZOLAMIDA/TIMOLOL DR. GERHARD MANN 20/5 MG/ML COLIRIO 1 FRASCO SOLUCION 5 ML (BAUSCH & LOMB) |
|
8240296 |
ESCARMINE 600 MG 40 SOBRES GRANULADO MENTA (ZAMBON) |
|
6934470 |
FLUVASTATINA ACCORD EFG 80 MG 28 COMPRIMIDOS LIBERACION PROLONGADA (ACCORD HEALTHCARE, S.L.U.) |
|
6720851 |
GENOXAL 1 G 1 VIAL POLVO (BAXTER) |
|
6949689 |
HEMODIAFILTRACION BAXTER D6 1 BOLSA 3000 ML (BAXTER) |
|
6949504 |
HEMODIAFILTRACION BAXTER D6 1 BOLSA 5000 ML (BAXTER) |
|
6450369 |
HEMODIAFILTRACION BAXTER D6 2 BOLSAS 5000 ML (BAXTER) |
|
6450444 |
HEMODIAFILTRACION BAXTER D6 4 BOLSAS 3000 ML (BAXTER) |
|
6538166 |
HEMODIAFILTRACION BAXTER D8 1 BOLSA 1000 ML (BAXTER) |
|
6538081 |
HEMODIAFILTRACION BAXTER D8 1 BOLSA 2000 ML (BAXTER) |
|
6950234 |
HEMODIAFILTRACION BAXTER D8 1 BOLSA 3000 ML (BAXTER) |
|
6950159 |
HEMODIAFILTRACION BAXTER D8 1 BOLSA 5000 ML (BAXTER) |
|
6450932 |
HEMODIAFILTRACION BAXTER D8 2 BOLSAS 5000 ML (BAXTER) |
|
6451014 |
HEMODIAFILTRACION BAXTER D8 4 BOLSAS 3000 ML (BAXTER) |
|
7734994 |
ISO-LACER RETARD 20 MG 20 COMPRIMIDOS LIBERACION PROLONGADA (LACER) |
|
6543771 |
ISO-LACER RETARD 20 MG 50 COMPRIMIDOS LIBERACION PROLONGADA (LACER) |
|
8554294 |
JUNIPRO 20 MG/ML SUSPENSION ORAL 150 ML NARANJA (RECKITT BENCKISER HEALTHCARE, S.A.) |
|
6705087 |
KALCIPOS D 1250 MG/800 UI 30 COMPRIMIDOS MASTICABLES (MEDA PHARMA SAU) |
|
6528440 |
KALPRESS CARDIO 40 MG 14 COMPRIMIDOS RECUBIERTOS (LACER) |
|
9913724 |
MIKELAN OFTALMICO 10 MG/ML COLIRIO 1 FRASCO SOLUCION 5 ML (OTSUKA PHARMACEUTICAL) |
|
9913809 |
MIKELAN OFTALMICO 20 MG/ML COLIRIO 1 FRASCO SOLUCION 5 ML (OTSUKA PHARMACEUTICAL) |
|
6528396 |
MITEN CARDIO 40 MG 14 COMPRIMIDOS RECUBIERTOS (NOVARTIS FARMACEUTICA) |
|
9466244 |
MOTILIUM NIÑOS 30 MG 12 SUPOSITORIOS (ESTEVE) |
|
6903582 |
OXALIQUID EFG 5 MG/ML 1 VIAL CONCENTRADO PERFUSION 10 ML (SANDOZ FARMACEUTICA S.A.) |
|
6903599 |
OXALIQUID EFG 5 MG/ML 1 VIAL CONCENTRADO PERFUSION 20 ML (SANDOZ FARMACEUTICA S.A.) |
|
6903605 |
OXALIQUID EFG 5 MG/ML 1 VIAL CONCENTRADO PERFUSION 40 ML (SANDOZ FARMACEUTICA S.A.) |
|
7937944 |
POLIO SABIN 1 DOSIS 1 TUBO 0.2 ML (GLAXO SMITHKLINE) |
|
6886816 |
TEALINE 250/150 MG 160 CAPSULAS (ARKOPHARMA) |
|
6886809 |
TEALINE 250/150 MG 40 CAPSULAS (ARKOPHARMA) |
|
6748428 |
TOPOTECAN EBEWE 1 MG/ML 1 VIAL CONCENTRADO PERFUSION 1 ML (SANDOZ FARMACEUTICA S.A.) |
|
6748435 |
TOPOTECAN EBEWE 1 MG/ML 1 VIAL CONCENTRADO PERFUSION 3 ML (SANDOZ FARMACEUTICA S.A.) |
|
6748442 |
TOPOTECAN EBEWE 1 MG/ML 1 VIAL CONCENTRADO PERFUSION 4 ML (SANDOZ FARMACEUTICA S.A.) |
|
6776834 |
TROBALT INICIO 50 MG 21 COMPR + 100 MG 42 COMPR (GLAXO SMITHKLINE) |
|
8737529 |
ULCETRAX 40 MG 14 COMPRIMIDOS (SALVAT) |
|
8749096 |
ULCETRAX 40 MG 28 COMPRIMIDOS (SALVAT) |
|
8473502 |
VITABER A + E 30 GRAGEAS (LLORENS) |
Medicamentos dados de alta (marzo 2015)
|
NP |
CÓDIGO |
NOMBRE, PRESENTACIÓN Y LABORATORIO |
G. TER. |
PRECIO (€) |
DISP. |
TIPO |
|---|---|---|---|---|---|---|
| 7047605 | ARIPIPRAZOL QUALIGEN EFG 10 MG 28 COMPRIMIDOS (QUALIGEN S.L.) | N05AX | 84,56 € | R | AR CPD75 | |
| 7047629 | ARIPIPRAZOL QUALIGEN EFG 15 MG 28 COMPRIMIDOS (QUALIGEN S.L.) | N05AX | 84,56 € | R | AR CPD75 | |
| 7047612 | ARIPIPRAZOL QUALIGEN EFG 5 MG 28 COMPRIMIDOS (QUALIGEN S.L.) | N05AX | 79,68 € | R | AR CPD75 | |
| 7047414 | ARIPIPRAZOL STADA GENERICOS EFG 10 MG 28 COMPRIMIDOS (STADA GENERICOS S.L) | N05AX | 84,56 € | R | AR CPD75 | |
| 7047438 | ARIPIPRAZOL STADA GENERICOS EFG 15 MG 28 COMPRIMIDOS (STADA GENERICOS S.L) | N05AX | 84,56 € | R | AR CPD75 | |
| 7047407 | ARIPIPRAZOL STADA GENERICOS EFG 5 MG 28 COMPRIMIDOS (STADA GENERICOS S.L) | N05AX | 79,68 € | R | AR CPD75 | |
| 7043225 | CARBETOCINA GP-PHARM 100 MCG/ML 5 JERINGAS PRECARGADAS 1 ML (GP-PHARM) | H01BB | 177,75 € | FR R | H EXO | |
| 7043997 | CITALOPRAM LAREQ EFG 30 MG 56 COMPRIMIDOS RECUBIERTOS (APOTEX ESPAÑA S.L.) | N06AB | 15,36 € | R | AR | |
| 7001195 | CITONEUROX EFG 100 MG/ML SOLUCION ORAL 30 ML (PHARMADIET) | N06BX | 4,85 € | R | ||
| NP | 7020806 | EXFORGE HCT «10/320/25» MG 28 COMPRIMIDOS RECUBIERTOS (NOVARTIS FARMACEUTICA) | C09DX | 37,64 € | R | |
| 7018810 | INFLECTRA 100 MG 1 VIAL POLVO (HOSPIRA) | L04AA | 510,29 € | FR R | H | |
| N | 7010180 | LEMTRADA 12 MG 1 VIAL CONCENTRADO PERFUSION 1.2 ML (SANOFI AVENTIS S.A.) | L04AA | 7858,15 € | FR R | H |
| 7035657 | LEVODOPA/CARBIDOPA/ENTACAPONA RATIOPHARM EFG 100/25/200 MG 100 COMPRIMIDOS RECUBIERTOS (RATIOPHARM) | N04BA | 76,34 € | R | AR | |
| 7035664 | LEVODOPA/CARBIDOPA/ENTACAPONA RATIOPHARM EFG 125/31.25/200 MG 100 COMPRIMIDOS RECUBIERTOS (RATIOPHARM) | N04BA | 77,41 € | R | AR | |
| 7035671 | LEVODOPA/CARBIDOPA/ENTACAPONA RATIOPHARM EFG 150/37.5/200 MG 100 COMPRIMIDOS RECUBIERTOS (RATIOPHARM) | N04BA | 78,48 € | R | AR | |
| 7035688 | LEVODOPA/CARBIDOPA/ENTACAPONA RATIOPHARM EFG 200/50/200 MG 100 COMPRIMIDOS RECUBIERTOS (RATIOPHARM) | N04BA | 80,72 € | R | AR | |
| 7035732 | LEVODOPA/CARBIDOPA/ENTACAPONA RATIOPHARM EFG 50/12.5/200 MG 100 COMPRIMIDOS RECUBIERTOS (RATIOPHARM) | N04BA | 73,09 € | R | AR | |
| 7035749 | LEVODOPA/CARBIDOPA/ENTACAPONA RATIOPHARM EFG 75/18.75/200 MG 100 COMPRIMIDOS RECUBIERTOS (RATIOPHARM) | N04BA | 74,71 € | R | AR | |
| 6530283 | MICLAST EFG 10 MG/ML SOLUCION TOPICA 30 ML (PIERRE FABRE IBERICA) | D01AE | 2,64 € | R | ||
| 7026815 | NORLEVO BCNFARMA 1.5 MG 1 COMPRIMIDO (BCNFARMA) | G03AD | 18,76 € | EXO MSP | ||
| 7031765 | ORACEA 40 MG 28 CAPSULAS LIBERACION MODIFICADA (GALDERMA) | J01AA | 25,76 € | R | ||
| 7047681 | OTILONIO QUALIGEN EFG 40 MG 60 COMPRIMIDOS RECUBIERTOS (QUALIGEN S.L.) | A03AB | 11,02 € | R | ||
| 7025818 | PARICALCITOL CINFA EFG 1 MCG 28 CAPSULAS (CINFA) | H05BX | 80,11 € | R | DH CPD AR | |
| NP | 6912706 | PAROXETINA STADAGEN 30 MG 28 COMPRIMIDOS (STADA S.L) | N06AB | 9,13 € | R | AR |
| NP | 7042877 | PAROXETINA STADAGEN EFG 10 MG 30 COMPRIMIDOS (STADA S.L) | N06AB | 3,26 € | R | AR |
| 7035763 | PERINDOPRIL/INDAPAMIDA COMBIX EFG 2/0.625 MG 30 COMPRIMIDOS (OPA/AL/PVC/AL) (COMBIX S.L.) | C09BA | 8,82 € | R | ||
| 7035770 | PERINDOPRIL/INDAPAMIDA COMBIX EFG 4/1.25 MG 30 COMPRIMIDOS (OPA/AL/PVC/AL) (COMBIX S.L.) | C09BA | 17,64 € | R | ||
| N | 6948293 | PIXUVRI 29 MG 1 VIAL POLVO (SERVIER S.L) | L01DB | 737,27 € | FR R | H |
| 7038955 | RAMIPRIL/HIDROCLOROTIAZIDA STADA EFG 2.5/12.5 MG 28 COMPRIMIDOS (PVC/PE/PVDC/ALU) (STADA S.L) | C09BA | 3,45 € | R | ||
| 7038962 | RAMIPRIL/HIDROCLOROTIAZIDA STADA EFG 5/25 MG 28 COMPRIMIDOS (PVC/PE/PVDC/ALU) (STADA S.L) | C09BA | 6,90 € | R | ||
| 7026945 | REMSIMA 100 MG 1 VIAL POLVO (KERN PHARMA) | L04AA | 510,29 € | FR R | H | |
| 7039570 | RISEDRONATO NORMON EFG 75 MG 2 COMPRIMIDOS RECUBIERTOS (NORMON) | M05BA | 21,26 € | R | ||
| 7033288 | SEVELAMERO MYLAN PHARMACEUTICALS 800 MG 180 COMPRIMIDOS RECUBIERTOS (MYLAN PHARMACEUTICALS S.L.) | V03AE | 145,74 € | R | AR | |
| 7031413 | SEVELAMERO STADA 800 MG 180 COMPRIMIDOS RECUBIERTOS (STADA S.L) | V03AE | 145,74 € | R | AR | |
| 7027980 | SEVELAMERO TEVA 800 MG 180 COMPRIMIDOS RECUBIERTOS (TEVA PHARMA S.L.U.) | V03AE | 178,39 € | R | AR | |
| NP | 7042570 | TRAMADOL/PARACETAMOL QUALIGEN EFG 37.5/325 MG 20 COMPRIMIDOS EFERVESCENTES (QUALIGEN S.L.) | N02AX | 3,70 € | R | |
| NP | 7042532 | TRAMADOL/PARACETAMOL STADA GENERICOS EFG 37.5/325 MG 20 COMPRIMIDOS EFERVESCENTES (STADA GENERICOS S.L) | N02AX | 3,70 € | R | |
| 7039778 | TRAMADOL/PARACETAMOL TEVA EFG 37.5/325 MG 60 COMPRIMIDOS RECUBIERTOS (TEVA PHARMA S.L.U.) | N02AX | 11,10 € | R | ||
| 7022008 | VALGANCICLOVIR TEVA EFG 450 MG 60 COMPRIMIDOS RECUBIERTOS (TEVA PHARMA S.L.U.) | J05AB | 849,02 € | R | DH DIHSC AR | |
| N | 7037958 | ZINOSAL EFG 12.5 MG 90 COMPRIMIDOS RECUBIERTOS (PVC/PVDC-AL) (JUSTE) | N06AX | 22,48 € | R | AR |
| SIGLAS EMPLEADAS | |
|---|---|
| A: | Psicótropo (Anexo II del R.D. 2829/1977 de 6 de octubre). |
| AR: | Aportación Reducida. |
| CPD75: | Visado de inspección >75 años. |
| CPD: | Cupón precinto diferenciado. |
| DH: | Medicamento de Diagnóstico Hospitalario. |
| DiHSC: | Dispensación hospitalaria sin cupón precinto. |
| E: | Estupefaciente. |
| ECM: | Medicamento Control Médico. |
| EFG: | Medicamento Farmacéutico Genérico. |
| EXO: | Excluida Oferta Seguridad Social. |
| EXOI: | Excluida, con cupón precinto diferenciado. |
| FR: | Medicamentos que precisan conservación en frigorífico. |
| H: | Medicamento Hospitalario. |
| MSP: | Medicamento susceptible publicidad al público. |
| N: | Medicamentos con principio activo nuevo. |
| NP: | Nueva presentación. |
| P: | Psicótropo (Anexo I del R.D. 2829/1977 de 6 de octubre). |
| R: | Receta. |
| ST: | Suspensión temporal de comercialización. |
| TLD: | Medicamento de dispensación renovable. |
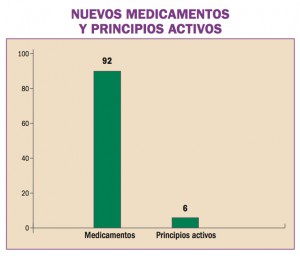
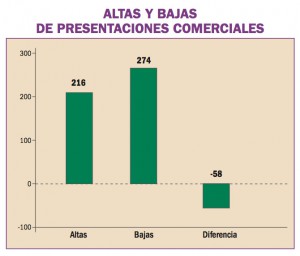
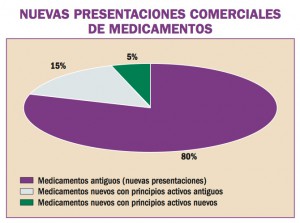
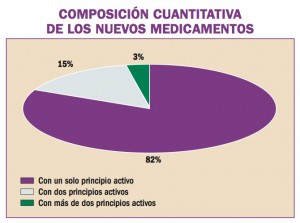
Estadísticas de Medicamentos en España (Acumulado anual)
Nuevos medicamentos huérfanos
Los medicamentos huérfanos son aquéllos que sirven para diagnosticar, prevenir o tratar enfermedades raras de carácter muy grave o con riesgo para la vida. En la Unión Europea, la calificación de enfermedad rara se aplica a todas aquellas que no afectan a más de 5 de cada 10.000 personas.
|
NUEVAS DESIGNACIONES Y AUTORIZACIONES DE MEDICAMENTOS HUÉRFANOS (EMA) |
|||
|---|---|---|---|
|
Medicamento |
Indicación |
Laboratorio |
Decisión Fecha* Designación (D)/ Autorización (A) |
|
Ácido 3-[2-(4-carbamimidoil-fenilcarbamoil)-5-metoxi-4-vinil-fenil]-6-(ciclopropilmetil-carbamoil)-piridina-2-carboxilico |
Tratamiento del angioedema hereditario |
BioCryst UK Ltd. |
D: 12/02/2015 |
|
Sevuparina |
Tratamiento de la drepanocitosis |
Dilaforette AB |
D: 12/02/2015 |
|
Nitroglicerina |
Tratamiento de la esclerosis sistémica |
Covis Pharma S.à.r.l. |
D: 12/02/2015 |
|
Lactobacillus reuteri |
Prevención de la enterocolitis necrotizante |
Infant Bacterial Therapeutics AB |
D: 12/02/2015 |
|
Alvocidib |
Tratamiento de la leucemia mieloide aguda |
Theorem Clinical Research GmbH |
D: 12/02/2015 |
|
Linfocitos T alogénicos CD4+ y CD8+ incubados con péptidos sintéticos de antígenos virales de citomegalovirus, adenovirus y virus de Epstein-Barr |
Tratamiento de la infección por citomegalovirus |
Miltenyi Biotec GmbH |
D: 12/02/2015 |
|
5-hidroximetil-2-furfural |
Tratamiento de la drepanocitosis |
Baxter Innovations GmbH |
D: 12/02/2015 |
|
Fibrinogeno recubierto de esferas de albúmina |
Tratamiento de la enfermedad por virus del Ébola |
Fibreu Limited |
D: 12/02/2015 |
|
Glutamato oxalacetato transaminasa 1 recombinante humana |
Tratamiento del glioma |
Impasara Ltd |
D:12/02/2015 |
|
Mazindol |
Tratamiento de la narcolepsia |
HAC Pharma |
D:12/02/2015 |
|
Ulocuplumab |
Tratamiento de la leucemia mieloide aguda |
Bristol-Myers Squibb Pharma EEIG |
D: 12/02/2015 |
|
Olaratumab |
Tratamiento del sarcoma de tejidos blandos |
Eli Lilly Nederland B.V. |
D: 12/02/2015 |
|
NUEVAS DESIGNACIONES Y AUTORIZACIONES DE MEDICAMENTOS HUÉRFANOS (FDA) |
|||
|---|---|---|---|
|
Medicamento |
Indicación |
Laboratorio |
Decisión Fecha* Designación (D)/ Autorización (A) |
|
Ácido glicil-L-2-metilpropil-L-glutamico |
Tratamiento del síndrome deRett |
Neuren Pharmaceuticals, Ltd. |
D: 11/02/2015 |
|
Copanlisib |
Tratamiento del linfoma folicular |
Bayer HealthCare Pharmaceuticals, Inc. |
D: 02/02/2015 |
|
Defarasirox |
Tratamiento del cáncer de ovario |
Verastem, Inc. |
D: 12/02/2015 |
|
Ibrutinib |
Tratamiento del lifoma |
Pharmacyclics, Inc. |
D: 05/02/2015 |
|
Ketotifeno |
Tratamiento de la mastocitosis |
Melbourne Laboratories LLC |
D: 25/02/2015 |
|
Bortezomib |
Tratamiento de la leucemia aguda linfoblástica |
Millennium Pharmaceuticals, Inc. |
D: 03/02/2015 |
|
Acetilcisteina en comprimidos efervescentes |
Prevención del daño hepático por sobredosis de acetaminofeno |
Arbor Pharmaceuticals, LLC |
D: 24/02/2015 |
|
Levomefolato |
Tratamiento de la anemia causada por deficiencia de folatos |
Cox Biosciences LLC |
D: 10/02/2015 |
|
5-[8-metil-9-(1-metiletil)-2-(4-morfolinil)-9H-purin-6il]-2-pirimidinamina |
Tratamiento del mesotelioma maligno |
Verastem, Inc. |
D: 10/02/2015 |
|
Ácido 3-pentilbenzenacético |
Tratamiento de la fibrosis pulmonar idiopática |
ProMetic Life Sciences, Inc. |
D: 11/02/2015 |
|
Naltrexona |
Tratamiento de la neuralgia postherpética |
Allodynic Therapeutics, LLC |
D: 23/02/2015 |
|
Paramomicina |
Tratamiento de la leishmaniosis cutánea |
The Surgeon General, Dept. of the Army |
D: 11/02/2015 |
|
Pelareorep |
Tratamiento del cáncer de páncreas |
Oncolytics Biotech, Inc. |
D: 11/02/2015 |
|
Pelareorep |
Tratamiento del cáncer de ovario |
Oncolytics Biotech, Inc. |
D: 11/02/2015 |
|
Pelareorep |
Tratamiento del cáncer de trompas de Falopio |
Oncolytics Biotech, Inc. |
D: 11/02/2015 |
|
Polidocanol |
Tratamiento de las malformaciones venosas congénitas |
Provensis Ltd |
D: 19/02/2015 |
|
Propanolol y etadolac |
Tratamiento del carcinoma hepatocelular |
Vicus Therapeutics, LLC |
D: 24/02/2015 |
|
Tisagenlecleucel-T |
Tratamiento del linfoma de células B |
Novartis Pharmaceuticals Corporation |
D: 03/02/2015 |
|
Tolerogen |
Tratamiento de la miastenia grave |
Toleranzia AB |
D: 05/02/2015 |
|
Rituximab |
Tratamiento del pénfigo vulgar |
Genentech, Inc. |
D: 23/02/2015 |
|
Saposin C |
Tratamiento del glioblastoma multiforme |
Bexion Pharmaceuticals, LLC |
D: 03/02/2015 |
* La designación de un medicamento como huérfano no garantiza su uso en la condición designada y no implica necesariamente que el producto satisfaga los criterios de eficacia, seguridad y calidad necesarios para la concesión de la autorización de comercialización. Como para cualquier medicamento, estos criterios sólo pueden ser evaluados una vez que la solicitud de autorización de comercialización haya sido presentada.
Publicaciones y páginas web de interés
- A) Instituciones y redes españolas
- INSTITUTO DE SALUD CARLOS III (MINISTERIO DE CIENCIA E INNOVACIÓN):
- INSTITUTO DE ENFERMEDADES RARAS:
http://www.isciii.es/htdocs/centros/enfermedadesraras/enfermedadesraras_presentacion.jsp
- CIBERER (CENTRO DE INVESTIGACIÓN BIOMÉDICA EN RED DE ENFERMEDADES RARAS):
http://www.isciii.es/htdocs/centros/enfermedadesraras/enfermedadesraras_presentacion.jsp
- INSTITUTO DE ENFERMEDADES RARAS:
- INSTITUTO DE MAYORES Y SERVICIOS SOCIALES (IMSERSO, MINISTERIO DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD):
- FEDERACIÓN ESPAÑOLA DE ENFERMEDADES RARAS (FEDER)
- ASOCIACIONES DE PACIENTES EN ESPAÑA:
- INSTITUTO DE SALUD CARLOS III (MINISTERIO DE CIENCIA E INNOVACIÓN):
- B) Instituciones y redes europeas
- AGENCIA EUROPEA DE MEDICAMENTOS. APARTADO DE MEDICAMENTOS HUÉRFANOS (INGLÉS):
- COMISIÓN EUROPEA: WEB OFICIAL DE LA COMISIÓN EUROPEA SOBRE ENFERMEDADES RARAS Y MEDICAMENTOS HUÉRFANOS (ESPAÑOL).
http://ec.europa.eu/health/rare_diseases/policy/index_es.htm
- ORPHANET: PORTAL DE INFORMACIÓN OFICIAL DE LA UNIÓN EUROPEA SOBRE ENFERMEDADES RARAS
Y MEDICAMENTOS HUÉRFANOS (ESPAÑOL). - EURORDIS: FEDERACIÓN EUROPEA DE ASOCIACIONES DE PACIENTES CON ENFERMEDADES RARAS (ESPAÑOL).
- C) Otras instituciones y redes internacionales
- FOOD & DRUG ADMINISTRATION (FDA, ESTADOS UNIDOS). APARTADO DE MEDICAMENTOS HUÉRFANOS (INGLÉS):
http://www.fda.gov/ForIndustry/DevelopingProductsforRareDiseasesConditions/default.htm
- PHARMACEUTICALS & MEDICAL DEVICES AGENCY. AGENCIA DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS, DE JAPÓN (INGLÉS):
- FOOD & DRUG ADMINISTRATION (FDA, ESTADOS UNIDOS). APARTADO DE MEDICAMENTOS HUÉRFANOS (INGLÉS):
Nuevos medicamentos de terapia avanzada
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products1 que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT)2,3 cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
|
PRODUCTOS DE TERAPIA AVANZADA |
|||
|---|---|---|---|
|
Medicamento |
Indicación |
Clasificación |
Fecha |
|
Condrocitos autólogos cultivados en fibrina en excipiente de origen humano |
Tratamiento de los defectos cartilaginosos no artríticos grados III a IV de la clasificación de Outerbridge |
Ingeniería tisular |
21/01/2015 |
|
Adipocitos autólogos derivados de tejido subcutáneo adiposo |
Tratamiento de la fístula perianal |
Ingeniería tisular |
17/12/2014 |
|
Células alogénicas sanguíneas de cordón adaptadas con 16,16 dimetil prostaglandina E2 |
Tratamiento del transplante de células hematopoyéticas |
Ingeniería tisular |
17/12/2014 |
|
Células progenitoras mesenquimanles de hígado humano derivadas del tejido de Wharton de cordón umbilical |
Tratamiento de la parálisis cerebral |
Ingeniería tisular |
20/11/2014 |
|
Células progenitoras mesenquimanles de hígado humano derivadas del tejido de Wharton de cordón umbilical |
Tratamiento de lesiones cartilaginosas |
Ingeniería tisular |
20/11/2014 |
|
Células progenitoras humanas embrionarias derivadas de pigmento retiniano epitelial |
Tratamiento de la degeneración macular relacionada con la edad y la distrofia muscular de Stargardt. |
Ingeniería tisular |
20/11/2014 |
|
Vector viral adenoasociado (AAV) transportador de un gen bacteiano de halorodopsina |
Tratamiento de la retinitis pigmentosa |
Terapia génica |
20/11/2014 |
|
Lactococcus lactis genéticamente modificado conteniendo el gen del factor alfa antitumoral humano |
Tratamiento para la reducción de síntomas y mantenimiento de la remisión clínica de pacientes con colitis ulcerosa moderada. |
Terapia génica |
23/10/2014 |
|
Selección y ampliación ex vivo de células sanguíneas humanas de cordón umbilical
|
Reconstrucción hematopoyética e inmunológica de los regímenes no mieloablativos en cánceres hematológicos |
Ingeniería tisular |
26/09/2014 |
|
Derivado autólogo de células mononucleares de médula ósea |
Tratamiento de la enfermedad cardiaca crónica |
Terapia celular somática |
26/09/2014 |
|
Células dendríticas autólogas maduras dirigidas con péptidos sintéticos derivados de antígenos tumorales |
Tratamiento del glioblastoma |
Terapia celular somática |
26/09/2014 |
|
Vectores virales adenoasociados portadores de genes supresores de la producción de rodopsina no funcional y productores de rodopsina funcional |
Tratamiento de la retinitis pigmentosa autosómica dominante ligada a rodopsina |
Terapia génica |
26/09/2014 |
|
Plásmido codificador de telomerasa humana transcriptasa inversa fusionado con ubiquitina |
Tratamiento de diversos cánceres y prevención de recaídas |
Terapia génica |
21/07/2014 |
|
Virua oncolítico derivado de una modificación genética del virus del herpex simple tipo 1 (HSV-1) |
Tratamiento del cáncer pancreático avanzado y/o carcinoma hepatocelular no resecable |
Terapia génica |
21/07/2014 |
|
Concentrado autólogo de aspirado de médula ósea |
Tratamiento de daños óseos por enfermedad, fractura o disfunción relacionada con la edad |
Ingeniería tisular |
24/06/2014 |
|
Entramado traqueal sembrado con médula ósea autóloga derivada de células mononucleares |
Reconstrucción de la tráquea tras el daño debido a estenosis por cáncer, lesión o infección |
Ingeniería tisular |
16/05/2014 |
|
Tejido adiposo autólogo derivado de células progenitoras mesenquimales |
Tratamiento de artritis degenerativa, osteoartrtitis y defectos articulares cartilaginosos |
Ingeniería tisular |
16/05/2014 |
|
Antígeno antólogo específico regulador de linfocitos T |
Tratamiento de enfermedades articulares inflamatorias |
Terapia celular somática |
16/05/2014 |
|
Antígeno alogénico quimérico del receptor de células T (CAR+) modificado genéticamente |
Tratamiento de la leucemia linfoblástica aguda y leucemia linfocítica crónica |
Terapia génica |
30/04/2014 |
|
Aspirado de células de médula ósea autólogas en plasma autólogo |
Tratamiento de la osteoartrosis |
Ingeniería tisular |
30/04/2014 |
|
Células autólogas progenitoras mesenquimales incluidas en el desarrollo de cultivos cardiovasculares |
Tratamiento del fallo cardíaco secundario a cardiomiopatía isquemica |
Ingeniería tisular |
30/04/2014 |
|
Células autólogas de mucosa oral sembradas sobre una membrana |
Tratamiento de la estenosis uretral |
Ingeniería tisular |
30/04/2014 |
|
Células efectoras linfoides autólogas |
Tratamiento de cánceres sólidos |
Terapia celular somática |
18/02/2014 |
1 http://ec.europa.eu/enterprise/pharmaceuticals/eudralex/vol-1/reg_2007_1394/reg_2007_1394_en.pdf
2 http://www.ema.europa.eu/htms/general/contacts/CAT/CAT.html
3 http://www.ema.europa.eu/pressoffice/cat.htm
Nuevos medicamentos en el mundo, durante el año 2015
|
Fármacos |
Laboratorio |
Comentarios |
|---|---|---|
|
Apatorsen HSPB1 |
Oncogenex |
Apatorsen es un inhibidor de la producción de Hsp27 que se está ensayando para el tratamienton del cáncer de próstata, páncreas, vejiga, pulmón y adenocarcinoma. |
|
Durvalumab |
AstraZeneca |
Durvalumab es un anticuerpo monoclonal anti PD-L1 con actividad sobre varios tipos de tumores. |
|
Dupilumab |
Regeneron/Sanofi |
Dupilumab es un anticuerpo monoclonal totalmente humano que está en desarrollo clínico para el tratamiento del asma, la dermatitis atópica y la poliposis nasal. Dupilumab bloquea la IL-4 y la IL-13, dos citoquinas necesarias para la respuesta inmunitaria de Th2. |
|
Lucitanib (E-3810) |
Advenchen Pharmaceuticals |
Lucitanib es un inhibidor dual de los receptores enduteliales vasculares del factor de crecimiento y de los receptores del factor de crecimiento de fibroblastos con capacidad para inhibir la angiogénesis y proliferación celular de tumores. |
|
Rociletinib (CO-1686) |
Clovis Oncology |
Rociletinib es un inhibidor irreversible del receptor de las formas mutantes del factor de crecimiento epidermal causantes del cáncer. |
|
Rucaparib |
Clovis Oncology |
Rucaparib es una pequeña molécula inhibidora de la ADP-ribosa polimerasa 1 y 2. Se está estudiando para el tratamiento del cáncer de páncreas y ovario. |
|
Selinexor KPT-330) |
Karyopharm |
Selinexor es un inhibidor de XPO, proteína de exportación nuclear cuya inhibición conduce a la acumulación nuclear de proteínas supresoras de tumor (PST). XPO1 se sobreexpresa en muchos tumores, incluido el cáncer de la próstata (PrCa). |
|
Sonidegib (LDE225) |
Novartis |
Sonidegib es un inhibidor específico del receptor SMO con actividad oncolítica. |
Olodaterol STRIVERDI RESPIMAT® (Boehringer Ingelheim)
Resumen
El olodaterol es un agonista de acción prolongada de los receptores β2 adrenérgicos que ha sido autorizado para el tratamiento broncodilatador de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica (EPOC). Ha sido objeto de varios ensayos clínicos controlados con placebo y con comparadores activos (formoterol y tiotropio), mostrando una respuesta sobre los FEV1 pico y valle sustancial, mejorando en más de 100 ml, valor considerado como el umbral de la significación clínica. En este sentido, los efectos son equiparables a los de otros broncodilatadores de larga duración, tanto adrenérgicos (formoterol, indacaterol) como anticolinérgicos (tiotropio). El perfil de seguridad de la combinación está en línea con el de otros fármacos de esta familia y no se han observado eventos adversos específicos; en cualquier caso, la incidencia no es elevada y raramente es motivo de suspensión del tratamiento. El olodaterol requiere una única administración diaria, como el vilanterol, y como éste también ha demostrado producir efectos conjuntos con los anticolinérgicos broncodilatadores (tiotropio, glicopirronio, aclidinio) superiores a los producidos por cada agente por separado.
ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA (EPOC)
Según la guía GOLD (Global Initiative for Chronic Obstructive Lung Disease; GOLD, 2011), la EPOC es una entidad prevenible y tratable, caracterizada por una limitación persistente al flujo aéreo, generalmente progresiva y asociada a una respuesta inflamatoria exagerada de las vías aéreas y del parénquima pulmonar frente a partículas o gases nocivos. La limitación crónica al flujo aéreo se asocia, sobre todo, con el humo del tabaco como causa fundamental. Esta definición no utiliza los términos de enfisema1 y de bronquitis crónica2, y excluye el asma (que implica una limitación reversible al flujo aéreo). Los síntomas principales la EPOC son la disnea, la tos crónica y la expectoración crónica.
La prevalencia de la EPOC en España es similar a la encontrada en otros países europeos y en los Estados Unidos. Concretamente, en España es del 10% de la población entre 40 y 80 años; es decir, la EPOC afectaría a más de 2 millones de personas, que representan al 15 % de los varones y al 6% de las mujeres. En España, la EPOC representa la cuarta causa de mortalidad, con una tasa global de 33/100.000 habitantes, que aumenta a 176/100.000 habitantes en población de más de 75 años, e incluso algunos estudios señalan que pasará a ser la tercera causa de mortalidad para el 2020. Se trata, por tanto, de un problema clínico relevante, con importantes repercusiones socioeconómicas, lo que lo convierte en un importante problema de salud pública, que merece todo el interés de profesionales y autoridades sanitarias. La mayoría de los casos de EPOC están asociados al consumo de cigarrillos, si bien sólo el 15-20% de los fumadores desarrollan esta patología debido a diferencias en susceptibilidad de naturaleza aún desconocida, aunque se piensa que tienen una base genética o quizás ambiental.
Desde el punto de vista funcional, la resistencia al flujo aéreo en la EPOC contribuyen:
- La disminución de la luz bronquial por el engrosamiento de la pared y la hipersecreción de mucinas.
- La contracción de la musculatura lisa de las vías aéreas.
- La pérdida de elasticidad del parénquima pulmonar.
Los parámetros funcionales respiratorios más habitualmente utilizados en la descripción clínica de la EPOC son:
- Capacidad Vital (CV): volumen máximo de aire que el sujeto es capaz de inspirar y espirar en condiciones no forzadas, y corresponde a la suma VC + VRI +VRE:
- Volumen corriente (VC): cantidad de aire empleado en cada respiración (inspiración y espiración) normal (no forzada), lo que da idea del volumen de aire circulado en cada ciclo respiratorio. Habitualmente, el valor expresado representa el aire espirado, que no corresponde exactamente al inspirado, por ser un valor generalmente más estable que el inspirado. En término medio es de 0,5 litros.
- Volumen de Reserva Inspiratoria (VRI): máximo volumen de aire que puede ser inspirado. Se sitúa habitualmente en torno a 3 litros (con las consiguientes diferencias entre grupos de edad, desarrollo, etc.).
- Volumen de Reserva Espiratoria (VRE): volumen máximo de aire que es espirado en condiciones normal (sin forzar la respiración). En término medio, se sitúa sobre 1,7 l.
- Capacidad Vital Forzada (CVF): es el equivalente a la capacidad vital (CV), pero en condiciones forzadas y con la máxima rapidez que el sujeto pueda.
- Volumen Espiratorio Forzado en 1 segundo (VEF1): volumen de aire exhalado durante el primer segundo de una espiración forzada (máxima). Se considera como un parámetro fundamental para el diagnóstico y control de la evolución clínica de la EPOC. El diagnóstico clínico de EPOC implica la existencia de un cociente FEV1/CVF posbroncodilatador fijo de menos de 0,70. Una variante de este parámetro es el VEF1%, la fracción correspondiente del VEF1 entre la Capacidad Vital (CV), expresándolo en términos porcentuales (VEF1% = [VEF1/CV] x 100).
La gravedad de la limitación al flujo aéreo en la EPOC se categoriza en cuatro estadios o niveles:
- GOLD1 (leve): FEV1 ≥80% del valor de referencia.
- GOLD2 (moderada): FEV1: 50-79% del valor de referencia
- GOLD3 (grave): FEV1: 30-49% del valor de referencia
- GOLD4 (muy grave): FEV1 <30% del valor de referencia
Las exacerbaciones en EPOC se definen como un episodio agudo caracterizado por un empeoramiento de los síntomas respiratorios más allá de la variabilidad diaria, que obliga a un cambio del tratamiento habitual. El riesgo de exacerbaciones aumenta de forma proporcional al deterioro de la limitación al flujo aéreo.
En contraposición al asma bronquial, que es una inflamación eosinofílica crónica con obstrucción reversible de vías aéreas, la EPOC presenta un perfil de inflamación neutrofílica crónica con obstrucción no reversible. Los estudios histopatológicos muestran una implicación predominante de las vías respiratorias (bronquiolos) y del parénquima pulmonar, mientras que el asma implica inflamación de todas las vías respiratorias, aunque normalmente sin implicación del parénquima pulmonar. Existe una obstrucción de los bronquiolos, con fibrosis e infiltración con macrófagos y linfocitos T. Se produce la destrucción del parénquima pulmonar y un aumento de macrófagos y linfocitos T, con un mayor aumento de células CD8+ (citotóxicas) en comparación con las células CD4+ (coadyuvantes).
Cualquier opción terapéutica en la EPOC debe pasar por el abandono radical e inmediato del hábito tabáquico en el paciente, habida cuenta su decisivo papel en el origen y progresión de la enfermedad. Junto con el abandono definitivo del tabaquismo, la oxigenoterapia continua domiciliaria cuando la situación lo requiera3, son los dos elementos básicos para frenar la progresión de la enfermedad. El alivio sintomático y la mejoría de la calidad de vida se obtienen mediante el empleo de agentes broncodilatadores, la rehabilitación respiratoria y el soporte ventilatorio domiciliario (Cortijo, 2014).
La prevención de las exacerbaciones o reagudizaciones también es el objetivo de la utilización de broncodilatadores y de corticosteroides en inhalación.
Cuando las terapias farmacológicas y rehabilitadoras no son suficientes, se recurre a la cirugía de reducción pulmonar o, incluso, al trasplante. Cuando hay disnea o intolerancia al ejercicio físico, se recomienda el uso de agentes broncodilatadores de acción corta, en inhalación. La elección de agonistas beta2-adrenérgicos (salbutamol, terbutalina, etc.) o de anticolinérgicos (ipratropio) depende de la respuesta y de la incidencia de efectos adversos en cada paciente (Cuéllar, 2014). En caso de exacerbaciones o disnea persistente con la terapia anterior, las opciones dependen del grado de limitación del flujo respiratorio:
- FEV1 ≥ 50%: Las alternativas son
- Agonista beta2-adrenérgico de larga duración (indacaterol, formoterol, salmeterol, vilanterol, etc.), manteniendo el uso de los de acción corta, a demanda. En caso de falta de respuesta adecuada, puede añadirse un corticosteroide en inhalación, o un anticolinérgico de acción prolongada en inhalación en caso de baja respuesta o intolerancia al corticosteroide.
- Anticolinérgico de acción prolongada (tiotropio, etc.), descontinuando el uso de anticolinérgicos de acción corta. En caso de respuesta inadecuada, puede combinarse con un agonista beta2-adrenérgico de larga duración y un corticosteroide, todos ellos en inhalación.
- FEV1 ≤ 50%: Se aconseja el tratamiento sostenido con corticosteroides inhalados.
- Agonista beta2-adrenérgico de larga duración (indacaterol, formoterol, salmeterol, vilanterol, etc.) más un corticosteroide en inhalación, o un anticolinérgico de acción prolongada en inhalación en caso de baja respuesta o intolerancia al corticosteroide.
- Anticolinérgico de acción prolongada (tiotropio, etc.), descontinuando el uso de anticolinérgicos de acción corta. En caso de respuesta inadecuada, puede combinarse con un agonista beta2-adrenérgico de larga duración y un corticosteroide, todos ellos en inhalación.
Solo cuando la terapia inhalada sea insuficiente para mantener la calidad de vida de los pacientes, se debe recurrir a la terapia sistémica (oral o parenteral):
- Corticosteroides: no se recomienda su uso continuado en EPOC, salvo en aquellos casos en que no puede suspenderse el tratamiento, tras una exacerbación.
- Teofilina: Puede usarse en combinación con agonistas beta2-adrenérgicos y anticolinérgicos, teniendo siempre presente el amplio espectro de interacciones farmacológicas de este agente. Además, son menos efectivas y peor toleradas que los broncodilatadores en inhalación.
- Mucolíticos: Se considera aceptable su uso en pacientes con tos crónica productiva, siempre que produzcan una mejora sintomática apreciable. No se recomienda su uso para la prevención de las exacerbaciones.
- Inhibidores selectivos de la fosfodiesterasa 4 (PDE4): Roflumilast es un fármaco que es capaz de reducir la incidencia de exacerbaciones graves o muy graves en pacientes con EPOC e historial de exacerbaciones frecuentes.
- La vacuna de la gripe puede reducir la gravedad y la mortalidad de la EPOC. Por su parte, la neumocócica (polisacarídica) es aconsejable en pacientes con EPOC mayores de 65 años; además, también es útil (reduce el riesgo de neumonía) en pacientes más jóvenes con un FEV1 <40% del valor de referencia.
El pronóstico de los pacientes con EPOC depende del grado de obstrucción al flujo aéreo y del abandono del consumo de tabaco. La tasa de mortalidad a los 10 años de establecido el diagnóstico es superior al 50%. La evolución o historia natural de la EPOC sigue un curso lento, pero inexorable, en el que pueden sobrevenir episodios de exacerbación, con desarrollo de insuficiencia respiratoria e hipercapnia potencialmente graves, incluso mortales, que constituyen, por tanto, una urgencia médica en potencia.
ACCIÓN Y MECANISMO
El olodaterol es un agonista de acción prolongada de los receptores β2 adrenérgicos que ha sido autorizado para el tratamiento broncodilatador de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
El olodaterol presenta una elevada afinidad hacia los receptores β2 adrenérgicos, similar a la de vilanterol y salmeterol, pero superior a la del formoterol e indacaterol; igualmente, la selectividad relativa para receptores β2 adrenérgicos (240 veces mayor que para los β1 y 2.300 veces que para β3) es comparable a la de vilanterol y salmeterol, y mayor que la del formoterol e indacaterol.
Se conocen tres tipos de receptores adrenérgicos β: β1 (predominantes en el corazón), β2 (músculo liso) y β3 (relacionados con el metabolismo lipídico intracelular). La activación de todos los subtipos de receptores β desencadena un mecanismo de acción similar, mediante el cual la adenilciclasa ligada al receptor se activa y cataliza la conversión del trifosfato de adenosina (ATP) en adenosín monofosfato cíclico (AMPc), provocando, en el caso de los receptores β2 de las células musculares bronquiales, la relajación de éstas y, en consecuencia, una broncodilatación. Estudios de autorradiografía en pulmón humano han demostrado la presencia exclusiva de receptores β2 en el músculo liso de las vías aéreas, sobre todo en las vías periféricas, aunque existen también adrenoceptores β2 en el epitelio, la pared alveolar, las glándulas submucosas, el músculo liso vascular pulmonar, células con capacidad de liberar mediadores (mastocitos, basófilos, eosinófilos), y en los ganglios y las terminaciones nerviosas posganglionares colinérgicas.
Al margen del efecto broncodilatador ligado a la relajación del músculo liso bronquial, los fármacos agonistas β2 adrenérgicos son capaces de desarrollar otras acciones eventualmente útiles para el tratamiento de las patologías respiratorias: aumento del aclaramiento mucociliar, inhibición de la transmisión colinérgica, potenciación de la integridad vascular e inhibición de la liberación de mediadores bioquímicos (leucotrienos, prostaglandinas, histamina) por los mastocitos pulmonares.
ASPECTOS MOLECULARES
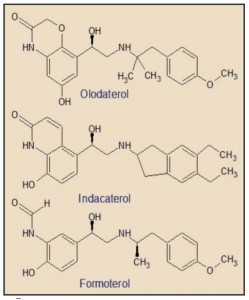
El olodaterol presenta una estructura que recuerda abiertamente a las del indacaterol y del formoterol. Todos los fármacos agonistas β2 adrenérgicos derivan de una estructura similar a la de la adrenalina, y por tanto se basan en el esqueleto de la feniloxietilamina. Por consiguiente, resulta indispensable la presencia de un grupo hidroxilo (-OH) en posición α con respecto al anillo aromático y que el grupo amino de la cadena lateral sea de tipo secundario (-NHR1) y no terciario (NR1R2), ya que precisa del átomo de H para estabilizar la estructura molecular formando un enlace por puente de hidrógeno con el grupo hidroxilo.
La potencia estimulante y la selectividad hacia los receptores β2 viene determinada básicamente por dos aspectos estructurales.
- Presencia de grupos hidroxilo (-OH) en meta (3 o 5) o para (4) del anillo aromático. Estos hidroxilos catecólicos forman enlaces por puente de hidrógeno con sendos restos serina de la cadena peptídica del receptor, estabilizando el complejo. En algunos derivados, uno de los grupos hidroxilo (-OH) es sustituido por su isóstero natural, el grupo amino (-NH2).
- Sustitución voluminosa del grupo amino secundario de la cadena lateral. Cuanto más voluminosa sea esta sustitución, tanto más selectivo será el fármaco hacia los diferentes receptores β. Si el resto es poco voluminoso, como el grupo isopropilo [-CH(CH3)2], los fármacos no muestran, en general, selectividad relativa hacia ninguno de los subtipos de receptor β (isoprenalina, clorprenalina, isoetarina, orciprenalina). Con restos más ramificados, como el terbutilo [-C(CH3)3], el grado de selectividad β2 comienza a ser significativo (terbutalina, salbutamol, etc). En mayor medida sucede cuando los restos contienen anillos aromáticos, tanto sin cadenas largas (formoterol, indacaterol, etc.), como con ellas (salmeterol, vilanterol). Estos restos voluminosos suelen aportar una mayor lipofilia a la molécula y facilita el acceso de ésta al receptor β2 adrenérgico.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad del olodaterol en el tratamiento de mantenimiento de la EPOC han sido contrastadas en cinco parejas de ensayos clínicos replicados de fase III, de 6 a 52 semanas de duración, aleatorizados, de grupos paralelos, doblemente ciegos y controlados con placebo y/o comparadores activos (formoterol, tiotropio). Se utilizaron dosis de 5 o 10 µg/24 h administrados mediante inhalación utilizando para ello un dispositivo Respinat® (5 µg equivalen a dos pulsaciones).
Los pacientes incluidos en todos estos ensayos clínicos tenían una edad mínima de 40 años y habían sido diagnosticado de EPOC, con un historial de tabaquismo de al menos 10 años y una insuficiencia pulmonar de moderada a muy grave (estadios II a IV de la guía GOLD). En todos o en la mayoría de los estudios se permitió el uso concomitante de medicamentos pulmonares, a excepción de agonistas β2 adrenérgicos de acción prolongada. Las variables primarias de eficacia utilizadas consistieron en la variación sobre los valores basales del VEF1, los valores máximos («pico»; área bajo la curva de 0 a 3 horas: AUC0-3) y estables («valle») de las respuestas de la función pulmonar, y la variación sobre el valor basal predeterminado del VEF1 valle (pre-dosis). En los estudios más largos (48-52 semanas) se midieron también la disnea mediante el ITD (Índice de Transición de la Disnea) y la calidad de vida relacionada con la percepción de la salud (Cuestionario Respiratorio Saint Georges, SGRQ)
Olodaterol vs. placebo
Dos estudios replicados (Ferguson, 2014) de 48 semanas de duración, en el que los pacientes (624 y 642) recibieron 5 o 10 µg/24 h de olodaterol o placebo en inhalación. Los resultados mostraron un aumento medio en los primeros cinco minutos tras la administración de la dosis diaria de 130 ml en el VEF1 y la mejora de la función pulmonar se mantuvo durante 24 h (aumento medio del 162 ml en VEF1 AUC0-3 y de 71 ml en la VEF1 valle durante 24 horas, en comparación con placebo; p< 0,0001).
Olodaterol vs. formoterol
Dos estudios replicados (Feldman, 2014) de 6 semanas de duración, en el que los pacientes recibieron 5 o 10 µg/24 h de olodaterol, 12 µg/12 h de formoterol o placebo en inhalación. Los resultados mostraron un aumento medio tras la administración de 5 o 10 µg/24 h de olodaterol de 175 ml (205 con formoterol) en VEF1 AUC0-3 y de 137 ml (108 con formoterol) en VEF1 AUC0-24, y de 102 ml en el VEF1 valle, todos ellos en comparación con placebo.
Otro dos estudios replicados (Koch, 2014), en este caso de 48 semanas de duración, en el que los pacientes (904 y 934) recibieron 5 o 10 µg/24 h de olodaterol, 12 µg/12 h de formoterol o placebo en inhalación. Los resultados mostraron un aumento medio en los primeros cinco minutos tras la administración de 5 o 10 µg/24 h de olodaterol de 151 y165 ml en el VEF1 y la mejora de la función pulmonar se mantuvo durante 24 h (aumento medio del 129 y 154 ml en VEF1 AUC0-3 y de 53 y 85 ml en la VEF1 valle durante 24 horas, en comparación con placebo; p< 0,0001). Unos resultados similares se obtuvieron con formoterol. El análisis primario de los resultados no mostró la existencia de diferencias significativas en el índice de transición de la disnea (ITD) en relación al placebo, aunque al realizar un análisis post hoc de los resultados (tomando en cuenta las suspensiones del tratamiento) sí pudo apreciarse una diferencia estadísticamente significativa con el placebo. También se apreciaron variaciones significativas favorables en la calidad de vida (SGRQ) con olodaterol vs. placebo (+0,5 puntos), pero no se apreciaron con formoterol vs. placebo (+0,4).
Tiotropio±olodaterol
Dos estudios replicados (ZuWallack, 2014) de 12 semanas de duración, en el que los pacientes (1.132 y 1.135) recibieron 18 µg/24 h de tiotropio con 5 µg/24 h de olodaterol o placebo en inhalación. Los resultados mostraron una variación media de VEF1 AUC0-3 de 191-196 ml con tiotropio+placebo vs. 297-313 con tiotropio-olodaterol (diferencias de 106-117 ml; p>0,0001) y de VEF1 valle de 133-135 ml con tiotropio+placebo vs. 175-195 con tiotropio-olodaterol (diferencias de 40-62 ml; p>0,03). Asimismo, se observó una variación media de VEF1 pico de 270-271 ml con tiotropio+placebo vs. 371-389 con tiotropio-olodaterol (diferencias de 100-119 ml; p>0,0001). Por su parte, la diferencia en la puntuación SGRQ al final fue de -1,9 (43,1 vs- 41,2) favorable a la combinación.
Tiotropio vs. olodaterol vs. tiotropio+olodaterol
Finalmente, en otros dos estudios replicados (Buhl, 2015) de 52 semanas de duración, en el que los pacientes (2.624 y 2.538) recibieron combinaciones fijas de tiotropio y oldaterol (2,5/5 o 5/5 µg/24 h) o los componentes por separado (tiotropio 2,5 o 5 µg/24 h o olodarerol o 5 µg/24 h). Los resultados mostraron una mayor mejoría estadísticamente significativa de VEF1 AUC0-3 y de VEF1 valle de las combinaciones sobre los monocomponentes. Igualmente, se apreció una mayor mejoría significativa en la puntuación SGRQ.
Seguridad
El perfil de seguridad del medicamento es benigno, en línea con lo observado en otros agentes β2 adrenérgicos; de hecho, en muchos de los ensayos clínicos controlados con placebo, la incidencia de eventos adversos fue muy parecida para el olodaterol y el placebo. Los descritos, con poca frecuencia, son nasofaringitis, mareos, erupciones exantemáticas y, raramente, dolores articulares e hipertensión.
ASPECTOS INNOVADORES
El olodaterol es un agonista de acción prolongada de los receptores β2 adrenérgicos que ha sido autorizado para el tratamiento broncodilatador de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
Ha sido objeto de varios ensayos clínicos controlados con placebo y con comparadores activos (formoterol y tiotropio), mostrando una respuesta sobre los FEV1 pico y valle sustancial, mejorando en más de 100 ml, valor considerado como el umbral de la significación clínica (Jones, 2014). En este sentido, los efectos son equiparables a los de otros broncodilatadores de larga duración, tanto adrenérgicos (formoterol, indacaterol) como anticolinérgicos (tiotropio).
El perfil de seguridad de la combinación está en línea con el de otros fármacos de esta familia y no se han observado eventos adversos específicos; en cualquier caso, la incidencia no es elevada y raramente es motivo de suspensión del tratamiento.
El olodaterol requiere una única administración diaria, como el vilanterol, y como éste también ha demostrado producir efectos conjuntos con los anticolinérgicos broncodilatadores (tiotropio, glicopirronio, aclidinio) superiores a los producidos por cada agente por separado. Este tipo de combinaciones en un único dispositivo inhalador y con administración única diaria está convirtiéndose poco a poco en un estándar terapéutico en EPOC (Montuschi, 2015), junto con las combinaciones con corticosteroides. Aunque es evidente que el olodaterol es eficaz en la indicación autorizada y previsiblemente acabará formando parte de alguna de estas combinaciones, no parece aportar nada innovador.
|
VALORACIÓN |
|
|---|---|
|
Olodaterol ► STRIVERDI RESPIMAT® (Boehringer Ingelheim) |
|
|
Grupo Terapéutico (ATC): R03AC. APARATO RESPIRATORIO. Medicamentos contra alteraciones obstructivas pulmonares: agonistas beta-2 selectivos en inhalación. |
|
|
Indicaciones autorizadas: Tratamiento broncodilatador de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica (EPOC). |
|
|
VALORACIÓN GLOBAL: SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
♣ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Terbutalina |
Tedipulmo |
Estedi |
1960 |
|
Salbutamol |
Ventolin |
GlaxoSmithKline |
1975 |
|
Salmeterol |
Serevent |
GlaxoSmithKline |
1992 |
|
Bambuterol |
Bambec |
AstraZaneca |
1993 |
|
Formoterol |
Foradil |
Novartis |
1998 |
|
Indacaterol |
Onbrez |
Novartis |
2010 |
|
Vilanterol* |
Relvar Ellipta |
GlaxoSmithKline |
2014 |
|
Olodaterol |
Striverdi Respimat |
Boehringer Ingelheim |
2015 |
* Solo está disponible en España en combinación con fluticasona.
BIBLIOGRAFÍA