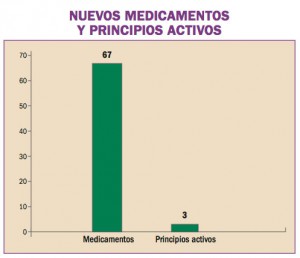
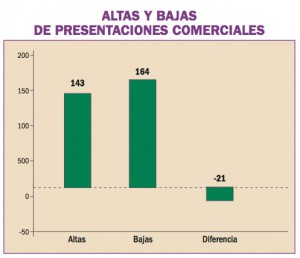
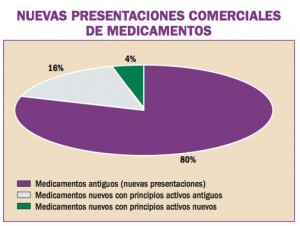
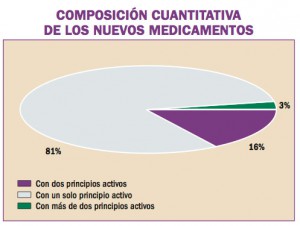
Las recomendaciones acordadas en la Unión Europea en el uso de regadenosón (Rapiscan®), vasodilatador coronario para uso diagnóstico, son retrasar la administración de Rapiscan® en pacientes con hipertensión arterial no controlada, no administrar Rapiscan® en pacientes con hipotensión arterial severa y tomar precauciones si se decide administrar Rapiscan® a pacientes con antecedentes de fibrilación auricular, o a aquellos con riesgo de presentar hipotensión grave.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha informado1 recientemente a través de la carta de seguridad remitida a los profesionales sanitarios por parte del laboratorio titular de la autorización de comercialización del medicamento Rapiscan®, con regadenosón. La decisión ha sido consensuada entre todas las agencias nacionales europeas y la Agencia Europea de Medicamentos (EMA).
Regadenosón es un vasodilatador coronario selectivo que se utiliza como agente en la prueba de esfuerzo farmacológica para realizar estudios de imagen de perfusión miocárdica con radionúclidos en pacientes adultos que no pueden someterse a una adecuada prueba de esfuerzo con ejercicio.
Se han notificado casos de accidentes cerebrovasculares, algunos de los cuales tuvieron lugar tras presentar los pacientes aumentos clínicamente significativos en la presión arterial, hipotensión severa o agravamiento de una fibrilación auricular preexistente, tras la administración de regadenosón.
Recomendaciones a los profesionales sanitarios
Revisados los datos anteriores, las recomendaciones son:
- Retrasar la administración de regadenosón en pacientes con hipertensión arterial no controlada.
- Tener precaución cuando se decida administrar regadenosón a pacientes con antecedentes de fibrilación auricular, o a aquellos con riesgo de presentar hipotensión grave.
- No administrar regadenosón a pacientes con hipotensión arterial severa.
Se puede administrar aminofilina para atenuar las reacciones adversas severas y/o persistentes provocadas por regadenosón. Sin embargo, una revisión reciente de casos de convulsiones inducidas por regadenosón indicó que la administración de aminofilina puede prolongar dichas convulsiones por lo que:
- No se recomienda el uso de aminofilina para hacer cesar las convulsiones inducidas por regadenosón.
- Se debe tener precaución al considerar la administración de regadenosón a pacientes con antecedentes de convulsiones o factores de riesgo para las mismas.
Referencias
- Agencia Española de Medicamentos y Productos Sanitarios. Regadenosón (Rapiscan®): Nuevas recomendaciones para minimizar el riesgo de accidente cerebrovascular y de prolongación de las convulsiones inducidas por Rapiscan tras la administración de aminofilina. Carta de Seguridad a los Profesionales sanitarios, de diciembre de 2014. Disponible en la página web de la AEMPS: https://sinaem.agemed.es/CartasFarmacovigilanciaDoc/2014/DHPC_Rapiscan-17-Dic-2014.pdf (consultado 30 enero 2015).
IMPORTANTE
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H) se basa en el programa de notificación espontánea de un profesional sanitario (médico, odontólogo, farmacéutico, enfermero, otros) de una sospecha de relación entre un medicamento (incluidos vacunas, sueros, gases medicinales, fórmulas magistrales, plantas medicinales) y un síntoma o signo adverso (reacción adversa, RAM) que manifieste el paciente (programa de tarjeta amarilla). El Real Decreto 577/2013 de Farmacovigilancia de medicamentos de uso humano (BOE núm. 179, de 27 de julio de 2013) entró en vigor el 28 de julio de 2013. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) coordina el SEFV-H.
¿Qué notificar?
Se deben notificar las sospechas de RAM:
– con medicamentos autorizados, incluidas las de aquellos que se hayan utilizado en condiciones diferentes a las autorizadas o con medicamentos extranjeros importados con autorización de la AEMPS,
– principalmente las RAM ‘graves’ (mortales, o que amenacen la vida, prolonguen o provoquen una hospitalización, causen incapacidad o sean médicamente importantes y las trasmisiones de un agente infeccioso a través de un medicamento) o RAM ‘inesperadas’ de cualquier medicamento,
– con medicamentos de ‘seguimiento adicional’ (durante sus primeros 5 años desde la autorización, identificados con un triángulo negro invertido (▼) a la izquierda del nombre del medicamento en el material informativo, en el prospecto y en la ficha técnica); ver la lista mensual de los medicamentos con triángulo negro en la web de la AEMPS, en la sección de CIMA con criterio de búsqueda del «Triángulo negro»: http://www.aemps.gob.es/cima/pestanias.do?metodo=accesoAplicacion
– las que sean consecuencia de ‘errores de medicación’, que ocasionen daño en el paciente,
– las originadas por ‘interacciones’ con medicamentos, plantas medicinales, incluso alimentos (zumo de pomelo, ahumados, crucíferas, etc).
¿Cómo notificar?
No olvide notificar cualquier sospecha de RAM a su Centro Autonómico o Regional de Farmacovigilancia mediante las ‘tarjetas amarillas’. Consulte en este directorio su Centro Autonómico de Farmacovigilancia correspondiente.
NUEVO MÉTODO: se puede notificar a través del sitio web https://www.notificaRAM.es/, y el sistema electrónico hace llegar a su centro correspondiente la notificación de sospecha de RAM. Sirve para profesionales sanitarios y para ciudadanos, en formularios diferentes. La nueva legislación europea de farmacovigilancia establece esta posibilidad para facilitar la notificación de las sospechas de RAM por la población en general.
¿Dónde conseguir tarjetas amarillas?
Consultando a su Centro correspondiente del SEFV-H. Podrá encontrar el directorio de Centros en las primeras páginas del «Catálogo de Medicamentos» y en las páginas de Internet http://www.portalfarma.com y http://www.aemps.gob.es/vigilancia/medicamentosUsoHumano/docs/dir_serfv.pdf.
¿Dónde consultar las fichas técnicas y prospectos de los medicamentos?
En la página web de la AEMPS http://www.aemps.gob.es >> seleccionando >> «CIMA: Centro de Información on-line de Medicamentos de la AEMPS, Humanos», se pueden consultar por nombre comercial o por sus principios activos. También están disponibles en la base de datos BOT Plus.
NOTA: la mención de marcas comerciales en el texto solo tiene fines de identificación, y en absoluto se les debe asignar directamente lo descrito en el texto.