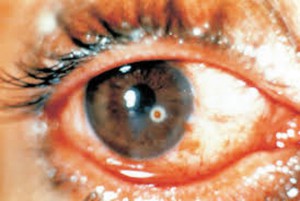
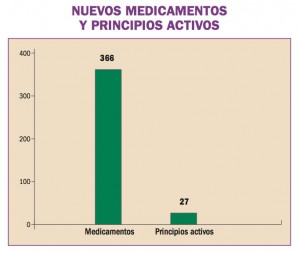
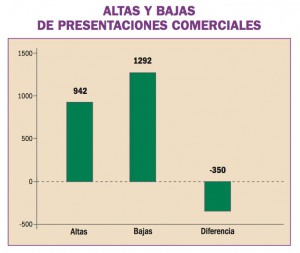
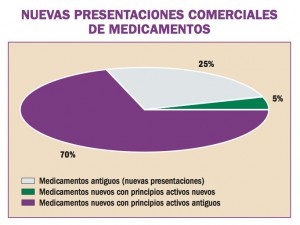
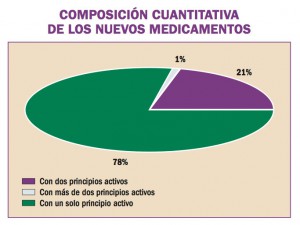
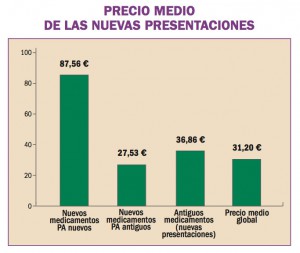
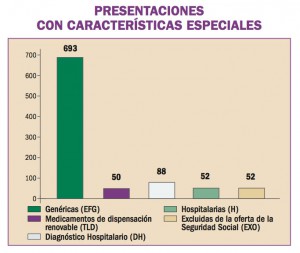
África Occidental está sufriendo el mayor, más grave y más complejo brote de virus del Ebola (EVE) de toda la historia. Los brotes de EVE pueden contenerse con las intervenciones disponibles, como la detección y aislamiento precoz, el rastreo y seguimiento de los contactos y la observancia de procedimientos rigurosos de control de la infección. No obstante, si hubiera vacunas o tratamientos específicos serían un arma poderosa para luchar contra el virus.
En el último decenio se ha trabajado en el desarrollo de vacunas y fármacos contra la EVE. Algunos han dado resultados prometedores en el laboratorio, pero todavía no se ha evaluado su seguridad y eficacia en el ser humano. El gran número de personas afectadas por el brote de África Occidental de 2014 y la alta tasa de letalidad han llevado a proponer el uso de intervenciones médicas en fase de investigación para intentar salvar la vida de los pacientes y frenar la epidemia. Por consiguiente, la OMS convocó el pasado 11 de agosto de 2014 una reunión consultiva para examinar y evaluar las implicaciones éticas que tendría el posible uso de intervenciones no registradas en la toma de decisiones clínicas. El grupo de expertos acordó por consenso que en las circunstancias particulares de este brote, y siempre que se cumplan determinadas condiciones, es ético ofrecer intervenciones no probadas, cuya eficacia y efectos adversos todavía no se conocen, con fines potencialmente terapéuticos o preventivos. El uso de esas intervenciones debe regirse por criterios éticos, tales como la transparencia de todos los aspectos de la atención, el consentimiento informado, la libertad de elección, la confidencialidad, el respeto a las personas, la protección de su dignidad y la participación de la comunidad.
A fin de conocer la seguridad y la eficacia de estas intervenciones, el grupo aconsejó que, siempre que se utilicen para tratar a pacientes, hay la obligación moral de recopilar y dar a conocer todos los datos generados, incluidos los derivados de los tratamientos administrados de forma «compasiva» (acceso a un fármaco no aprobado fuera de un ensayo clínico). El grupo exploró cómo se puede evaluar científicamente el uso de estas intervenciones en fase de investigación para garantizar la disponibilidad de información puntual y exacta sobre su seguridad y eficacia. Hubo unanimidad con respecto al deber moral de evaluar también estas intervenciones (terapéuticas o profilácticas) en los mejores ensayos clínicos que sean posibles en las circunstancias vigentes, a fin de demostrar definitivamente su seguridad y eficacia o aportar pruebas para detener su uso. Las intervenciones futuras deberían guiarse por los resultados de una evaluación continua.