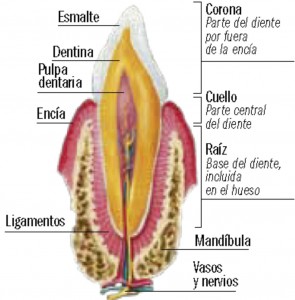
La FDA lleva bastante tiempo estudiando y analizando cómo los medicamentos funcionan en diferentes personas, sobre todo en hombres y mujeres.
Se ha publicado una guía para la industria farmacéutica sobre la inclusión en el análisis de los datos procedentes de los ensayos clínicos del estudio de las diferencias por sexo y por otros grupos demográficos. Se consideran por separado la efectos de los medicamentos en los hombres y en las mujeres con el fin de determinar si existen diferencias de sexo, y cuando existen decidir si es necesaria más información para evaluar las variaciones.
Por ejemplo, en 2013 la FDA actualizó la indicación de dosis para medicamentos que contenían zolpidem y se recomendó una reducción de la dosis inicial para las mujeres a 5 mg (de 10 mg). Esto se debió a que las mujeres resultaron ser especialmente susceptibles a los efectos secundarios de zolpidem, en gran parte debido a que se elimina más lentamente en las mujeres que en los hombres. Esto da lugar a que cuando las personas con ciertos niveles en sangre de zolpidem no indican sensación de somnolencia, su capacidad de conducción sí puede verse afectadas. Este es el caso en hombres y mujeres, pero debido a que las mujeres eliminan más lentamente el medicamento y por ello están más expuestas a tener riesgo de accidentes la mañana siguiente de tomar zolpidem.
Algunas diferencias en cómo los fármacos afectan a los hombres frente a las mujeres se pueden relacionar con las variaciones en el metabolismo y la tasa de absorción, y a veces incluso con una enfermedad concreta que tiene consecuencias diferentes entre hombres y mujeres. Así que se espera que los revisores y las empresas farmacéuticas incluyan rutinariamente datos con la diferencias de sexo en sus solicitudes de comercialización de fármacos nuevos. Muchas etiquetas de medicamentos incluyen información de dosis o perfiles de efectos secundarios de acuerdo a la edad, problemas de salud, o el sexo. Algunos medicamentos sólo están aprobados para uno de los sexos. Por ejemplo, alosetron, un medicamento utilizado para tratar el síndrome del intestino irritable (IBS), sólo se aprobó para las mujeres, porque los datos de los ensayos clínicos mostraron que el medicamento no es eficaz en los hombres. Balsalazida se utiliza para tratar la colitis ulcerosa de leve a moderada en hombres mayores de 18 años, ya que ha demostrado ser ineficaz en mujeres.
La FDA también monitorea todos los medicamentos para humanos que hay en el mercado a través de los programas de farmacovigilancia. Cuando los hallazgos sugieren problemas de seguridad que se cree que son importantes, se trabaja con las empresas para poner esa información en el etiquetado (si no está incluida), y a veces se exige que las empresas realicen estudios adicionales.
FDA Voice, 14 de febrero, 2014. http://blogs.fda.gov/fdavoice/index.php/2014/02/fda-is-committed-to-determining-sex-differences-in-how-drugs-work/#sthash. URUFz93s.dpuf