Número 464, Junio 2023
Los medicamentos de terapia avanzada (MTA o Advanced Therapy Medicinal Products, ATMP) ofrecen nuevos e innovadores tratamientos para las enfermedades. Están basados en la terapia génica, la terapia celular somática o la ingeniería tisular. El marco legal para las ATMP en la Unión Europea está establecido en la Regulation (EC) No 1394/2007 on advanced therapy medicinal products que asegura el libre movimiento de estas medicinas dentro de la Unión Europea y el acceso a los mercados. La regulación (EC) nº 1394/2007 también establece el nuevo Comité en Terapias avanzadas (CAT) cuya responsabilidad fundamental consiste en preparar un proyecto de opinión sobre cada nueva solicitud de medicamento de terapia avanzada planteada a la Agencia Europea de Medicamentos, antes de que el Comité de Medicamentos de Uso Humano (CHMP, Committee for Medicinal Products for Human Use) de la misma adopte una opinión definitiva sobre la concesión, modificación, suspensión o revocación de una autorización de comercialización para el medicamento en cuestión.
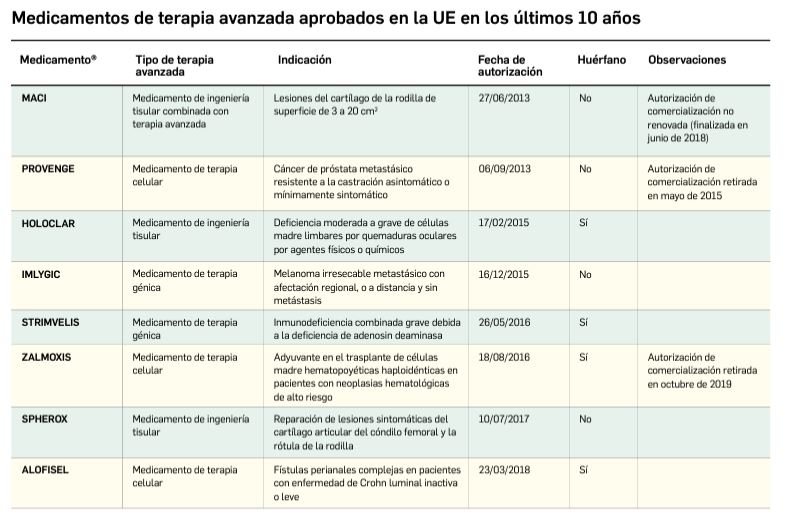
La siguiente tabla recoge los medicamentos de terapia avanzada que han recibido autorización de comercialización en la UE durante en los últimos 10 años (2013-2023).
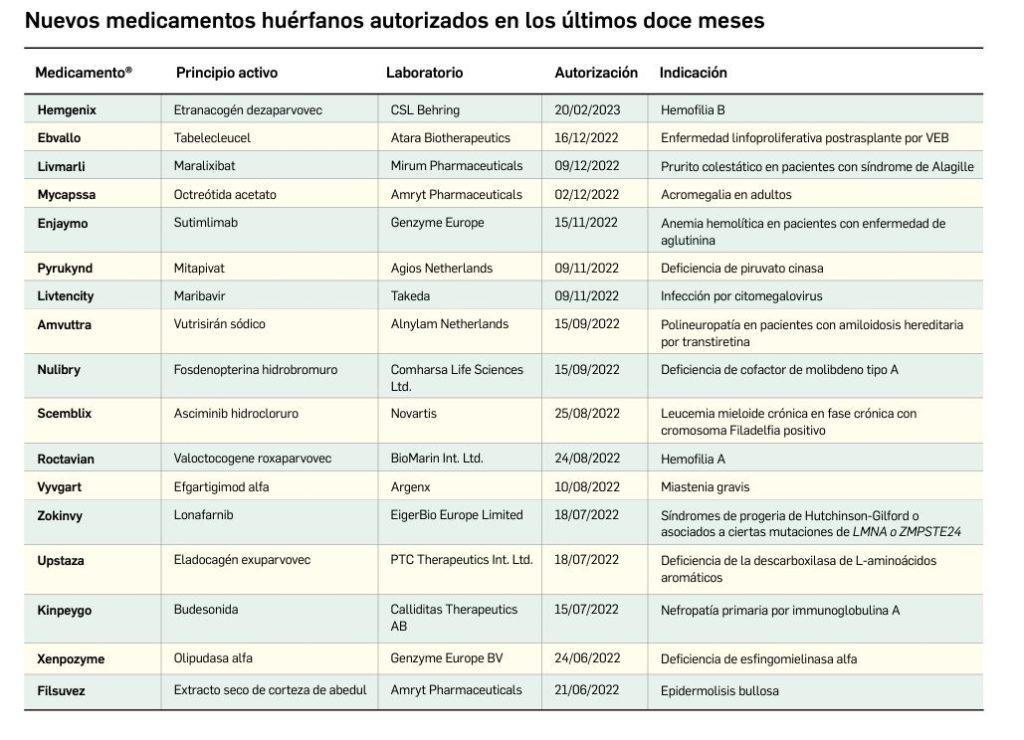
Los medicamentos huérfanos son aquéllos que sirven para diagnosticar, prevenir o tratar enfermedades raras de carácter muy grave o con riesgo para la vida. En la Unión Europea, la calificación de enfermedad rara se aplica a todas aquellas que no afectan a más de 5 de cada 10.000 personas. La designación de un medicamento como huérfano no garantiza su uso en la condición designada y no implica necesariamente que el producto satisfaga los criterios de eficacia, seguridad y calidad necesarios para la concesión de la autorización de comercialización. Como para cualquier medicamento, estos criterios solo pueden ser evaluados una vez que la solicitud de autorización de comercialización haya sido presentada.
► Instituto de Salud Carlos III (Ministerio de Ciencia e Innovación):
Instituto de Investigación en Enfermedades Raras:
https://www.isciii.es/QuienesSomos/CentrosPropios/IIER/Paginas/default.aspx
CIBERER (Centro de Investigación Biomédica en Red de Enfermedades Raras): https://www.ciberer.es/
► Instituto de Mayores y Servicios Sociales (IMSERSO, Ministerio de Derechos Sociales y Agenda 2030):
http://www.imserso.es/imserso_01/index.htm
► Federación Española de Enfermedades Raras (FEDER): www.enfermedades-raras.org
► Asociaciones de pacientes en España: https://enfermedades-raras.org/index.php/asociaciones/nuestros-socios
► Agencia Europea de Medicamentos (EMA; Europea Medicines Agency). Apartado de Medicamentos Huérfanos (inglés):
https://www.ema.europa.eu/en/human-regulatory/overview/orphan-designation-overview
https://www.ema.europa.eu/en/committees/committee-orphan-medicinal-products-comp
► Comisión Europea: web oficial de la Comisión Europea sobre enfermedades raras y medicamentos huérfanos (español).
http://ec.europa.eu/health/rare_diseases/policy/index_es.htm
► Orphanet: Portal de información oficial de la Unión Europea sobre enfermedades raras y medicamentos huérfanos (español).
http://www.orpha.net/consor/cgi-bin/index.php?lng=ES
► Eurordis: Federación Europea de Asociaciones de Pacientes con Enfermedades Raras (español). http://www.eurordis.org/es
► Food & Drug Administration (FDA, Estados Unidos). Apartado de Medicamentos Huérfanos (inglés):
http://www.fda.gov/ForIndustry/DevelopingProductsforRareDiseasesConditions/default.htm
► Pharmaceuticals & Medical Devices Agency. Agencia de Medicamentos y Dispositivos Médicos, de Japón (inglés):
http://www.pmda.go.jp/english/index.html
El Comité de Medicamentos de Uso Humano de la EMA (CHMP), tras evaluar los resultados del estudio de fase III STAND, en el que se comparó crizanlizumab con placebo en la prevención de crisis vaso-oclusivas asociadas a la anemia falciforme, recomienda la revocación de la autorización de comercialización del medicamento Adakveo®.
No deben iniciarse nuevos tratamientos con crizanlizumab (Adakveo®). Para aquellos pacientes que ya estuvieran tomando este medicamento, su médico le informará de otras opciones disponibles.
La AEMPS publicará la decisión final de la Comisión Europea y, en su caso, de la fecha efectiva de la retirada de la comercialización en Europa.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha comunicado la decisión final del Comité Europeo de medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA), que ha recomendado revocar la autorización de comercialización de Adakveo® (crizanlizumab), autorizado en 2020 para la prevención de las crisis vaso-oclusivas (CVO) recurrentes en pacientes de 16 años o mayores con anemia de células falciformes (AEMPS, 2023).
En 2020, en el momento de la autorización, los datos clínicos disponibles mostraban que Adakveo® reducía el número de CVO en pacientes con anemia falciforme. Sin embargo, estos datos eran limitados y existía cierta incertidumbre sobre la magnitud del efecto. En consecuencia, el medicamento obtuvo una “autorización condicionada” a que el laboratorio titular, Novartis Europharm Limited, llevara a cabo el estudio STAND, que tenía como objetivo confirmar el beneficio observado inicialmente, comparándose con placebo en pacientes que ya habían sufrido CVO, que precisaron atención médica.
Los resultados del estudio no han podido demostrar que Adakveo® redujera el número de CVO, ya que los pacientes tuvieron una media de 2,5 crisis dolorosas que requirieron atención médica durante el primer año de tratamiento, frente a 2,3 crisis en el grupo placebo. Incluso, el número medio de crisis que requirió atención médica en el domicilio fue de 4,7 con Adakveo®, frente a 3,9 con placebo.
El CHMP, para esta revisión, también ha tenido en cuenta datos de otros estudios, un programa de acceso controlado y datos de vida real. Sin embargo, los estudios tenían varias limitaciones, como la falta de un comparador, y no pudieron utilizarse para demostrar el efecto de Adakveo® o contrarrestar los resultados negativos del estudio STAND.
El estudio STAND, en cuanto a la seguridad de Adakveo®, no mostró nuevos problemas de seguridad, pero se observó una tasa mayor de efectos secundarios graves y severos relacionados con el tratamiento en comparación con placebo. Por todo ello, el CHMP ha concluido que sus beneficios no superan los riesgos y recomienda la revocación de la autorización de comercialización. La AEMPS publicará la decisión final de la Comisión Europea (CE) y, en su caso, de la fecha efectiva de la retirada de la comercialización. La CE es el órgano ejecutivo europeo que autoriza o revoca la comercialización de los medicamentos en la Unión Europea, que se evalúan entre los Estados miembros en el CHMP de la EMA.
Se comunica a los pacientes la siguiente información:
En síntesis, la AEMPS comunica las siguientes recomendaciones a los profesionales sanitarios: