Resumen
Somatrogón es una forma recombinante de la hormona del crecimiento humana (GH) de acción prolongada. Tras su administración por vía subcutánea, se une al receptor de la GH y desencadena una cascada de señalización intracelular que resulta en un estímulo del crecimiento y del metabolismo. Además, produce un aumento de IGF-1 que contribuye parcialmente al estímulo del crecimiento lineal, a los cambios metabólicos y a una mayor velocidad de crecimiento en pacientes pediátricos con deficiencia de GH. En base a estas acciones, somatrogón ha sido aprobado y se encuentra comercializado en un medicamento designado como huérfano, con indicación en el tratamiento de niños y adolescentes a partir de los 3 años con trastornos del crecimiento debido a una secreción insuficiente de la hormona del crecimiento.
La eficacia de somatrogón fue evaluada en un estudio pivotal de fase 3 abierto, aleatorizado, multicéntrico, de 12 meses de duración y de no inferioridad, en el que se compararon los efectos de la administración semanal de este fármaco con la terapia diaria con somatropina en niños prepuberales con deficiencia de GH. En este estudio (N= 224) se incluyó a niños de entre 3 y 12 años. La variable principal de eficacia fue la velocidad de crecimiento (cm/año) a los 12 meses, con un resultado similar para somatrogón (10,10 cm/año) y somatropina (9,78 cm/año) y una diferencia de la media de mínimos cuadrados de 0,33 a favor del nuevo principio activo (IC95%: -0,24, 0,89). Así, se demostró la no inferioridad de somatrogón, dado que el margen preespecificado de no inferioridad fue de -1,8 cm/año en el límite inferior del IC95% bilateral. Los resultados de un estudio abierto de extensión indican el sostenimiento de la eficacia en los pacientes que habían completado el estudio pivotal tras 6 y 12 meses adicionales, aunque el reducido tamaño muestral limita la posibilidad de extraer conclusiones sobre la eficacia a largo plazo del nuevo tratamiento.
El perfil de seguridad de somatrogón presenta características similares al de somatropina, aunque con una proporción algo superior de eventos adversos (84% vs. 78%), siendo los más comunes dolor en el lugar de inyección (39% vs. 25%), nasofaringitis (23% vs. 25%), dolor de cabeza (17% vs. 22%) y pirexia (17% vs. 14%), mayoritariamente de intensidad leve o moderada. En comparación con somatropina, el tratamiento con somatrogón se asoció a un mayor número de casos de anticuerpos anti-fármaco y también a más eventos adversos relacionados con la inmunogenicidad (18% vs. 8%), tales como conjuntivitis alérgica, rinitis alérgica y rash cutáneo. Por ahora, se desconocen las implicaciones a largo plazo que la aparición de estos anticuerpos puede tener sobre la eficacia y la seguridad de somatrogón. Tampoco se conocen completamente las implicaciones de seguridad de la elevación de los niveles de IGF-1 observada durante el tratamiento con somatrogón. Por ello, el titular de la autorización de comercialización se ha comprometido a desarrollar un plan de farmacovigilancia en el que se analice el potencial diabetogénico y tumorigénico asociado a esta elevación.
Si bien somatrogón no incorpora un nuevo mecanismo de acción, los resultados disponibles de eficacia indican que el nuevo fármaco no es inferior a somatropina, considerado el estándar de tratamiento. Este hecho, unido a una pauta de administración más favorable, puede representar una mejora en la adherencia y un mayor grado de preferencia de somatrogón por parte de los pacientes frente a somatropina. No obstante, persisten incertidumbres sobre los efectos a largo plazo del nuevo fármaco, tanto en relación al mantenimiento de la eficacia como a la posible toxicidad derivada de la elevación de los niveles de IGF-1 y de la formación de anticuerpos. Por tanto, se deberá esperar a la realización de estudios de farmacovigilancia que perfilen la relación beneficio-riesgo de somatrogón para concluir sobre su posicionamiento terapéutico en la práctica clínica habitual.
Aspectos fisiopatológicos
El crecimiento puede definirse como un incremento del tamaño como consecuencia de una ganancia de masa tisular y puede dividirse en varias fases (fetal, infantil, adolescencia) en función de los factores que lo estimulan en cada una de ellas.
Aunque en condiciones fisiológicas normales el crecimiento fetal y del neonato es rápido, su velocidad comienza a reducirse a partir del primer año de vida. En estas primeras etapas, una adecuada nutrición y la función de las hormonas tiroideas y de la hormona del crecimiento (GH, por sus siglas en inglés) son factores cruciales en la consecución de una talla considerada normal de acuerdo a los parámetros de distribución poblacional.
La influencia de la GH continúa siendo clave en el resto de las fases de crecimiento y, de hecho, el crecimiento durante la pubertad se relaciona con una reactivación del eje hipotalámico-hipofisario-gonadal con un incremento de la producción de GH estimulado por la producción de andrógenos y estrógenos.
La hormona de crecimiento, GH o somatotropina, es una proteína producida en la hipófisis anterior que estimula el crecimiento longitudinal durante la infancia y juventud del niño al actuar sobre los cartílagos de conjunción o cartílagos de crecimiento localizados en ambos extremos de los huesos largos.
La GH estimula la multiplicación de los condrocitos, que son las células de los cartílagos de crecimiento. Sin embargo, una parte importante de su acción biológica no se ejerce de forma directa, sino mediante el estímulo de la producción de un compuesto intermediario denominado factor de crecimiento similar a la insulina de tipo 1 o IGF-1 (insulin-like growth factor 1), también denominado somatomedina C, que se produce en las células hepáticas y en otros tejidos, incluyendo los propios cartílagos de crecimiento o las células vasculares. El IGF-1 es un péptido compuesto por 70 aminoácidos y con una secuencia muy parecida a la de la proinsulina. En el plasma, el IGF-1 circula unido a las proteínas de unión del factor de crecimiento similar a la insulina (IGFBP, insulin-like growth factor binding proteins), de las que aparentemente la más importante es la IGFBP-3. La síntesis y secreción de IGF-1 está bajo el control de la somatotropina.
Los efectos del IGF-1 son fundamentalmente de dos tipos: uno agudo, parecido a la insulina, que se caracteriza por una disminución rápida de la glucemia y de los niveles plasmáticos de ácidos grasos libres; y otro crónico, de estímulo de las mitosis en los fibroblastos, condrocitos y músculo liso. Muy probablemente, y a pesar de que se produce en gran cantidad en el hígado y circula en el plasma, el verdadero papel del IGF-1 se ejerce de manera paracrina, esto es, en el mismo tejido en el que va a ejercer sus funciones. Concretamente, se producirá en los condrocitos por acción de la somatotropina para generar en estos una proliferación celular y, por tanto, estimular los cartílagos de crecimiento.
Aparte de estas acciones, la somatotropina también estimula el anabolismo incrementando la biosíntesis proteica y, por tanto, también el crecimiento de músculos y tejidos blandos. Por otro lado, genera también lipolisis en el tejido graso, y a nivel del metabolismo glucídico tiene, a largo plazo, un efecto de incremento de glucemia.
La GH se encuentra regulada principalmente por dos hormonas hipotalámicas, una hormona estimulante –la hormona liberadora de la hormona del crecimiento, GHRH– y una hormona inhibidora –somatostatina–. Como resultado de la interacción de ambas hormonas, la secreción de la GH sigue un patrón pulsátil, con un pico cada 3 horas aproximadamente, y con mucha mayor secreción durante la noche.
La hormona del crecimiento es capaz de modular el metabolismo, pero éste es a su vez capaz de actuar sobre la secreción de la hormona. Así, la elevación de la glucemia, por ejemplo, determina una inhibición de la secreción de GH, mientras que la disminución de la glucemia, sobre todo a nivel de las células nerviosas, determina un incremento en su secreción.
Igualmente, la modificación de los niveles de ácidos grasos libres tiene también un efecto importante sobre la secreción de somatotropina, en la misma forma que en el caso de la glucemia. Por su parte, aunque no todos los aminoácidos son capaces de modular la secreción de somatotropina, algunos como la arginina o la ornitina son potentes estimuladores.
La somatotropina se une a receptores específicos situados en la membrana de diversas células, lo que da lugar a la activación y fosforilación de diversas proteínas citoplasmáticas que estimulan la transcripción génica y otras vías de la cascada intracelular. Este proceso da lugar al estímulo del IGF-1, que determina la proliferación condrocítica.
La deficiencia de GH es una de las principales causas de talla baja. No obstante, la baja estatura debida a esta causa es una condición poco frecuente, cuya incidencia se ha estimado en aproximadamente 1 de cada 4000 niños. Este déficit se produce como consecuencia de una baja o nula secreción por parte de la hipófisis por causas congénitas, adquiridas o idiopáticas (de origen desconocido). En la mayor parte de los casos se desconoce la causa del déficit.
En periodo neonatal, la deficiencia de GH se presenta habitualmente en forma de hipoglucemia, hiperbilirrubinemia y micropene, a pesar de que la talla al nacer puede ser normal. El retraso en el crecimiento se percibe durante el primer año de vida en casos graves, pero puede tardar más tiempo en producirse en casos en los que la producción de la hormona está solo leve o moderadamente reducida. Los niños con deficiencia de GH a menudo presentan síntomas como un aspecto inmaduro para la edad, retraso en la dentición, voz aguda y un lento crecimiento de las uñas (Murray et al., 2020).
Establecido el diagnóstico de déficit de GH, se recomienda iniciar el tratamiento lo antes posible con el objetivo de que el paciente alcance una talla dentro del rango estadísticamente esperable teniendo en cuenta la estatura de los padres.
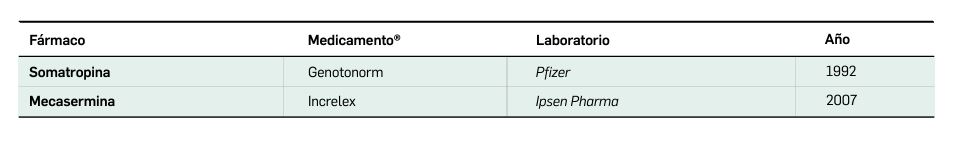
El estándar de tratamiento actual es la administración diaria por vía subcutánea de GH humana recombinante (GHr), también denominada somatropina, con eficacia comprobada en la normalización del crecimiento y en la mejora de los efectos metabólicos derivados del déficit hormonal (como una reducción del colesterol total, del colesterol-LDL y de los triglicéridos) y en los aspectos psicosociales asociados al retraso en el crecimiento (EMA, 2022).
A pesar de su eficacia, el tratamiento con somatropina presenta algunos inconvenientes o desventajas. En primer lugar, la necesidad de administración diaria puede condicionar la adherencia, teniendo en cuenta además que la vía de administración subcutánea resulta incómoda y puede generar rechazo, especialmente en la población infantil. Además, no todos los pacientes responden de manera adecuada al tratamiento, tanto por una inadecuada adherencia o por otros motivos, como algunos factores genéticos1. La posibilidad de predecir la respuesta al tratamiento con somatropina es de gran interés tanto para el paciente, en la medida en que la relación beneficio-riesgo a nivel individual quedaría mejor caracterizada, como para el sistema sanitario, al ahorrar el coste de tratamiento en pacientes en los que resultará útil. Entre los efectos adversos de la somatropina se encuentran la posibilidad de sangrado o hematomas en la zona de administración, hipotiroidismo, hipertensión intracraneal o resistencia a la insulina.
Por estos motivos, se requiere de alternativas cuya pauta de administración resulte más cómoda para los pacientes, teniendo en cuenta que estos fármacos deben ser utilizados durante periodos prolongados de tiempo, generalmente varios años.
Acción y mecanismo
Somatrogón es una forma recombinante de la hormona del crecimiento humana (GH) de acción prolongada. Tras su administración por vía subcutánea, se une al receptor de la GH y desencadena una cascada de señalización intracelular que incluye la activación de la vía STAT5b, cuyo resultado es un estímulo del crecimiento y del metabolismo. Además, produce un aumento de IGF-1 que contribuye parcialmente al estímulo del crecimiento lineal, a los cambios metabólicos y a una mayor velocidad de crecimiento en pacientes pediátricos con deficiencia de GH. En base a estas acciones, somatrogón ha sido aprobado y se encuentra comercializado en un medicamento designado como huérfano, con indicación en el tratamiento de niños y adolescentes a partir de los 3 años con trastornos del crecimiento debido a una secreción insuficiente de la hormona del crecimiento.
De acuerdo a los resultados de estudios in vitro, la afinidad de somatrogón por el receptor de la GH humana es entre 8 y 13 veces inferior a la de somatropina. Sin embargo, la constante de disociación de ambos fármacos respecto al receptor es similar, de modo que en un tratamiento prolongado la elevada semivida de somatrogón lleva a una activación mantenida del receptor con la producción de niveles altos de IGF-1. Este extremo se ha podido comprobar en estudios in vivo en ratas hipofisectomizadas –esto es, ratas a las que se les había extirpado la hipófisis–. Así, somatrogón produce efectos fisiológicos similares a los de la GH.
Aspectos moleculares
Somatrogón es una proteína de fusión recombinante de la hormona del crecimiento (GH) humana producida en un cultivo de células de ovario de hámster chino (CHO). Contiene una copia del péptido C-terminal de la cadena β de la gonadotropina coriónica humana (hCG) en el extremo N-terminal y dos copias del mismo péptido en el extremo C-terminal. Los dominios del péptido C-terminal de la hCG se encuentran ampliamente glucosilados, lo que contribuye a un incremento de la vida media de somatrogón.
Eficacia y seguridad clínicas
La eficacia y la seguridad clínicas de somatrogón han sido evaluadas en un estudio pivotal de fase 3 abierto, aleatorizado, multicéntrico, de 12 meses de duración, en el que se compararon los efectos de la administración semanal de somatrogón con la terapia diaria con somatropina en niños prepuberales con deficiencia de GH que previamente no habían recibido tratamiento con GH recombinante humana.
En el estudio se aleatorizó en proporción 1:1 a 224 pacientes para recibir uno de los dos fármacos, con el objetivo principal de demostrar la no inferioridad de somatrogón tras 52 semanas de tratamiento en términos de la velocidad de crecimiento (cm/año). Entre los objetivos secundarios se consideró la evaluación de la seguridad y la tolerabilidad de la administración semanal de somatrogón, la velocidad de crecimiento a los 6 meses o la maduración ósea a los 12 meses en comparación con la línea base2.
En cuanto a las características basales de los participantes, estas estuvieron balanceadas entre ambos brazos de tratamiento. La edad mediana fue de 7,87 años, teniendo en cuenta que en el estudio únicamente se incluyó a pacientes de entre 3 y menos de 11 años (niñas) o menos de 12 años (niños). La altura mediana fue de 110,3 cm y el peso mediano de 18,6 kg.
Los resultados de eficacia publicados (Deal et al., 2022) muestran una velocidad de crecimiento a los 12 meses ligeramente superior para somatrogón, con 10,10 cm/año frente a 9,78 cm/año en el brazo de somatropina, con una diferencia de la media de mínimos cuadrados de 0,33 a favor de somatrogón (IC95%: -0,24, 0,89), con un límite inferior por encima del margen preestablecido de no inferioridad (-1,8 cm/año). De este modo, se determinó la no inferioridad de somatrogón frente a somatropina.
Respecto a los objetivos secundarios de eficacia, la velocidad de crecimiento mediana anualizada a los 6 meses también fue algo superior para somatrogón (10,59 vs. 10,04 cm/año). El cambio medio en el grado de maduración ósea a los 12 meses también fue similar (1,07 en el brazo de somatrogón vs. 1,12 en el brazo de somatropina). Como variable subrogada de la actividad hormonal de los tratamientos se utilizó la puntuación de la desviación estándar de IGF-1 (IGF-1 SDS, por sus siglas en inglés)3, con un cambio desde -1,95 en la línea de base hasta 0,65 a los 12 meses en el brazo de somatrogón, frente a un cambio desde -1,72 hasta -0,69 en el brazo de somatropina, lo que sugiere una mayor capacidad de estimulación del IGF-1 por parte de somatrogón.
Se dispone asimismo de los resultados de un estudio abierto de extensión (OLE, por sus siglas en inglés) en el que participaron 212 de los pacientes aleatorizados que completaron el periodo de análisis del estudio pivotal, con datos disponibles en el mes 18 (mes 6 del OLE; N= 94) y en el mes 24 (mes 12 del OLE; N= 9). En este caso, los pacientes del brazo de somatropina pasaron a recibir somatrogón semanal. Los datos indican el sostenimiento de la eficacia para los pacientes que recibieron inicialmente somatrogón en términos de velocidad de crecimiento y una tendencia a la igualación con los datos de somatrogón para aquellos pacientes que inicialmente habían recibido somatropina.
Se ha llevado a cabo también un estudio de fase 3, aleatorizado, multicéntrico, abierto y cruzado en el que se ha analizado la preferencia de los pacientes (N= 87) por el tratamiento en función del intervalo de administración (diario con somatropina o semanal con somatrogón). Los resultados de este estudio (Maniatis et al., 2022) indican una menor interferencia en la vida cotidiana con la dosis semanal, con una puntuación media 15 puntos inferior para somatrogón y un resultado estadísticamente significativo (p < 0,0001).
Por lo que se refiere al perfil de seguridad del nuevo fármaco, los datos de seguridad disponibles provienen de 269 niños tratados con somatrogón. La mayor parte (N= 257) recibieron el fármaco en la dosis y forma farmacéutica (pluma precargada) para la que se solicitó la autorización y, de ellos, 147 fueron tratados al menos durante 12 meses.
En el estudio pivotal, la mayor parte de los pacientes experimentó algún evento adverso, tanto en el brazo de somatrogón (84,4%) como de somatropina (78,3%). Los eventos adversos observados con una frecuencia superior al 10% tras la administración de somatrogón vs. somatropina fueron dolor en el lugar de inyección (39,4% vs. 25,2%), nasofaringitis (22,9% vs. 25,2%), dolor de cabeza (16,5% vs. 21,7%) y pirexia (16,5% vs. 13,9%). En el estudio de extensión, los eventos adversos más habitualmente reportados fueron similares a los del estudio pivotal, aunque con una frecuencia total inferior (58%).
La mayor parte de los eventos adversos fueron leves o moderados, de modo que la incidencia de eventos adversos graves fue baja en ambos brazos (somatrogón: 2,8%; somatropina: 1,7%) y ninguno se consideró relacionado con el tratamiento. No se produjeron muertes durante el estudio y solo un paciente discontinuó el tratamiento, en el grupo de somatrogón, debido a una reacción adversa (eritema en el lugar de inyección).
El incremento de los niveles de IGF-1 por encima de dos desviaciones estándar fue considerado un evento adverso de especial interés. Este evento se observó En el estudio pivotal en 26 pacientes tratados con somatrogón y en 3 de los tratados con somatropina, de los cuales 12 requirieron una reducción de la dosis de somatrogón, de acuerdo al protocolo del estudio. No obstante, en 23 de los 26 pacientes tratados con somatrogón los valores de IGF-1 se obtuvieron al segundo o tercer día tras la administración, de modo que los niveles medidos representan un pico y no la media.
Se ha estudiado también la inmunogenicidad del nuevo principio activo. En el estudio pivotal, el 77,1% de los pacientes tratados con somatrogón presentaron anticuerpos anti-fármaco, frente al 15,7% en el grupo de somatropina. También fue superior en el brazo de somatrogón la proporción de pacientes que experimentó algún evento adverso relacionado con la inmunogenicidad o con la hipersensibilidad (18,3% vs. 7,8%), como conjuntivitis alérgica, rinitis alérgica y rash.
Aspectos innovadores
Somatrogón es una nueva forma recombinante de la hormona del crecimiento humana (GH) de acción prolongada. Tras su administración por vía subcutánea, se une al receptor de la GH y desencadena una cascada de señalización intracelular que incluye la activación de la vía STAT5b, cuyo resultado es un estímulo del crecimiento y del metabolismo. Produce asimismo un aumento de IGF-1 que contribuye parcialmente al estímulo del crecimiento lineal y a una mayor velocidad de crecimiento en pacientes pediátricos con deficiencia de GH. En base a estas acciones, somatrogón ha sido aprobado y se encuentra comercializado como medicamento huérfano, con indicación en el tratamiento de niños y adolescentes a partir de los 3 años con trastornos del crecimiento debido a una secreción insuficiente de la hormona del crecimiento.
La eficacia de somatrogón fue evaluada en un estudio pivotal de fase 3 abierto, aleatorizado, multicéntrico, de 12 meses de duración y de no inferioridad, en el que se compararon los efectos de la administración semanal de este fármaco con la terapia diaria con somatropina en niños prepuberales con deficiencia de GH. En este estudio se aleatorizó en proporción 1:1 a 224 pacientes pediátricos (≥ 3 y < 11 años en el caso de las niñas; < 12 años en el caso de los niños).
La variable principal de eficacia fue la velocidad de crecimiento (cm/año) a los 12 meses, con un resultado similar para somatrogón (10,10 cm/año) y somatropina (9,78 cm/año) y una diferencia de la media de mínimos cuadrados de 0,33 a favor del nuevo principio activo (IC95%: -0,24, 0,89). Se demostró la no inferioridad de somatrogón, dado que el margen preespecificado de no inferioridad fue de -1,8 cm/año en el límite inferior del IC95% bilateral. Los resultados de un estudio abierto de extensión indican el sostenimiento de la eficacia en los pacientes que habían completado el estudio pivotal tras 6 y 12 meses adicionales, aunque con una muestra reducida, de tan solo 9 pacientes para el mes 12 del OLE, lo que limita la posibilidad de extraer conclusiones sobre la eficacia a largo plazo del nuevo tratamiento.
Por cuanto respecta a las variables secundarias de eficacia, con los dos tratamientos se obtuvieron resultados muy similares, por ejemplo en la velocidad de crecimiento anualizada a los 6 meses (en torno a 10 cm/año) o en el cambio en el grado de maduración ósea.
Con un grado de eficacia comparable en ambos brazos del estudio, una de las principales ventajas de somatrogón respecto a somatropina –tratamiento estándar de la deficiencia de GH– radica en la pauta de administración semanal. En un estudio de fase 3 en el que se analizó la preferencia por parte de los pacientes, se ha concluido con un resultado estadísticamente significativo que somatrogón provoca una menor interferencia en la vida cotidiana y es mejor aceptado que la dosis diaria de somatropina.
Teniendo en cuenta que los problemas de adherencia (que se estiman en un 36-49% de los pacientes) son uno de los factores que en mayor medida condicionan la eficacia de esta terapia, un tratamiento con mayor aceptación por los pacientes es clave para alcanzar los resultados farmacoterapéuticos deseados.
El perfil de seguridad de somatrogón presenta características similares al de somatropina, aunque con una proporción algo superior de eventos adversos (84% vs. 78%), siendo los más comunes dolor en el lugar de inyección (39% vs. 25%), nasofaringitis (23% vs. 25%), dolor de cabeza (17% vs. 22%) y pirexia (17% vs. 14%). No obstante, los eventos adversos graves fueron poco frecuentes, produciéndose únicamente un caso de discontinuación debido a un evento adverso (eritema en el lugar de inyección).
El tratamiento con somatrogón se asoció a un mayor número de casos de anticuerpos anti-fármaco y también a más eventos adversos relacionados con la inmunogenicidad (18% vs. 8%), tales como conjuntivitis alérgica, rinitis alérgica y rash cutáneo. Por ahora, se desconocen las implicaciones a largo plazo que la aparición de estos anticuerpos puede tener sobre la eficacia y la seguridad de somatrogón, pero a corto plazo se relacionaron con una mayor probabilidad de sufrir eventos adversos, principalmente reacciones en el lugar de inyección.
Tampoco se conocen completamente las implicaciones de seguridad de la elevación de los niveles de IGF-1 observada durante el tratamiento con somatrogón. Por ello, el titular de la autorización de comercialización se ha comprometido a desarrollar un plan de farmacovigilancia en el que se analice el potencial diabetogénico y tumorigénico asociado a esta elevación (EMA, 2022).
Somatrogón es la primera forma recombinante de la GH humana de acción prolongada disponible en España. Aunque recientemente la Comisión Europea ha autorizado otra GHr humana de administración semanal (lonapegsomatropina), no se dispone de una comparación directa ni indirecta entre ésta y somatrogón.
Si bien somatrogón no incorpora un nuevo mecanismo de acción, los resultados disponibles de eficacia indican que el nuevo fármaco no es inferior a somatropina, lo que unido a una pauta de administración más favorable puede representar una mejora en la adherencia y un mayor grado de preferencia por los pacientes frente al estándar de tratamiento actual. No obstante, persisten incertidumbres sobre los efectos a largo plazo de somatrogón, tanto en relación al mantenimiento de la eficacia como a la posible toxicidad derivada de la elevación de los niveles de IGF-1 y de la formación de anticuerpos. Por tanto, se deberá esperar a la realización de estudios de farmacovigilancia que perfilen la relación beneficio-riesgo de somatrogón para concluir sobre su posicionamiento terapéutico en la práctica clínica habitual.
Valoración