Centros asistenciales afectados
En España, las obligaciones de verificación y desactivación de los identificadores únicos afecta a los servicios de farmacia de diversos centros:
- Hospitales públicos y privados.
- Centros de atención primaria públicos y privados (incluyendo los centros de vacunación).
- Centros sociosanitarios públicos y privados.
- Clínicas de diálisis, emergencias y otros.
- Mutuas.
- Centros penitenciarios.
- Hospitales y unidades dependientes de las Fuerzas Armadas.
También será responsabilidad de los servicios de farmacia la verificación y desactivación de los identificadores únicos que se dispensen al público desde depósitos dependientes de los mismos.
Punto de verificación y desactivación del identificador único
Los servicios de farmacia de los centros asistenciales descritos, ya sean de titularidad pública o privada, en España han alcanzado un elevado nivel de organización para atender sus obligaciones relacionadas con la dispensación, el seguimiento e información de medicamentos a pacientes ingresados en los hospitales, ambulantes y externos.
Para mantener este nivel de eficiencia en la planificación y organización de los servicios de farmacia, tal y como establece el Reglamento 2016/161 de la UE, la verificación de los dispositivos de seguridad y desactivación del identificador único de cada medicamento podría ser 1) en todo momento en que el medicamento obre en poder del centro asistencial, siempre que entre el suministro del medicamento al centro y su dispensación al paciente no medie venta del medicamento.
En cualquier caso, la opción de verificar los dispositivos de seguridad y desactivar el identificador único de cada medicamento 2) en el momento de la dispensación por el servicio de farmacia hospitalaria es también válida.
Si no se realiza la verificación del dispositivo de seguridad y desactivación del identificador único en el momento de la dispensación, el punto de menor impacto para el servicio de farmacia sería en el proceso de recepción de los medicamentos.
Recepción del pedido
Actualmente, la identificación informática del medicamento se incluye en el código de barras EAN13.
La incorporación del identificador único (código de producto; número nacional de reembolso y de identificación; número de lote y fecha de caducidad) va a hacer necesaria la evolución hacia un código de barras bidimensional.
Sería de interés que este nuevo código también figurara en el albarán de entrega para facilitar el proceso de lectura, además de ir en el envase del medicamento.
Es habitual que el servicio de farmacia reciba varios envases de un mismo medicamento en un único pedido. Por ello, sería deseable estudiar la posibilidad de que figurara en el envase de la agrupación, un código bidimensional agregado, que permita que con un único escaneado se realice la lectura y verificación de cada uno de los códigos del envase agrupado. Este código figuraría, igualmente, en el albarán de entrega.
También debería facilitarse la denominada “verificación múltiple” para permitir que al revisar un pedido y antes de su entrada en existencias, se capture con una única lectura, los distintos códigos de productos del pedido y queden agrupados para realizar una única llamada de verificación al sistema y, a su vez, éste devuelva una sola respuesta con el resultado de la verificación de cada envase.
De la misma manera, para asegurar la trazabilidad del medicamento en los servicios asistenciales, en beneficio de seguridad del paciente, los servicios de farmacia requerirían la captura automática de la identificación del medicamento en su acondicionamiento primario.
Comprobación de la autenticación del medicamento
Los procesos que actualmente se siguen en la recepción de los medicamentos en los servicios de farmacia se deberán ampliar con las siguientes actuaciones:
- Verificar el identificador único del medicamento.
- Desactivar el identificador único del medicamento.
- Comprobar la integridad del dispositivo de contra las manipulaciones.
En función de la organización interna del centro asistencial, estas comprobaciones se realizarán en el punto de recepción de los medicamentos o en otro momento del proceso que se siga.
Proceso a seguir en el caso de detectarse una posible falsificación
Si cuando se efectúen estos procesos se detecta que el envase de un medicamento ha sido manipulado o si la verificación de los dispositivos de seguridad pone de manifiesto que el medicamento puede no ser auténtico, no seguirá el proceso de almacenamiento establecido en el centro y se informará inmediatamente de ello a las autoridades competentes, de acuerdo con el sistema establecido.
Cambio de estatus de un identificador único desactivado
Puede darse el caso de que sea necesario activar el identificador único que ha sido previamente desactivado en la recepción del pedido.
Según establece el artículo 13 del Reglamento 2016/161 podrá efectuarse si se cumplen las siguientes condiciones:
- La persona que efectúa el cambio tiene la misma autorización o facultad y trabaja en las mismas instalaciones que la persona que anuló el identificador único;
- El cambio tiene lugar no más de diez días después de la desactivación del identificador único;
- El medicamento no ha caducado;
- El envase del medicamento no figura en el sistema de repositorios como recuperado, retirado, destinado a su destrucción o robado, ni a la persona que efectúa el cambio le consta que sea robado;
- El medicamento no ha sido dispensado.
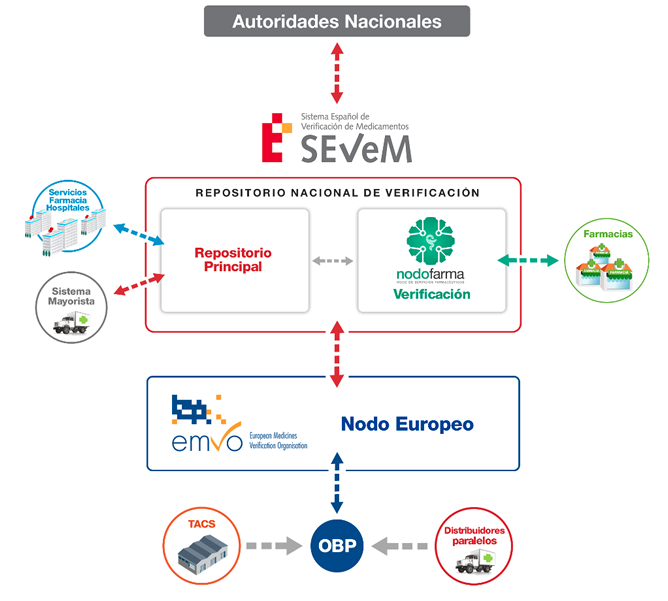
Conexión con el sistema de repositorio nacional
Se puede extraer de la legislación, que de forma general existe la necesidad de que el repositorio sea accesible y seguro para los agentes que participan, estando obligados a desplegar una serie de técnicas para permitir el acceso al mismo, únicamente a aquellos agentes que obtengan las credenciales necesarias, pero no determina en ningún caso que nivel de seguridad en los accesos y comunicaciones tendría.
Deja por tanto, abierta la posibilidad de que sea el SEVeM en este caso quien determine la arquitectura y el modelo de acceso y seguridad a través de la interfaz correspondiente.
Cabe la posibilidad de que el SEVeM pudiera desplegar diferentes modelos de seguridad, desde un acceso VPN muy poco probable, ya que debería generar y gestionar un gran número de redes VPN, con un alto coste de puesta en marcha y gestión, hasta un sistema por ejemplo con acceso a través de servidor seguro con encriptación a nivel de aplicación.
Como consecuencia de esto, hasta que SEVeM no desarrolle y documente la interfaz correspondiente, no se conocerá cómo serán las condiciones de acceso. Una vez determinadas estas condiciones deberán ser conocidas por el área/departamento TIC del hospital/comunidad autónoma, quien debe validar las condiciones de acceso al sistema desde terminales que se encuentran en la red del mismo.
Estas condiciones pueden ser válidas para una interfaz gráfica o para una interfaz consumida desde los softwares del hospital, lo que determinará las medidas de seguridad y el diseño a nivel de comunicaciones a desplegar.
Adaptación del software de gestión de los servicios de farmacia
Lectores de datos. Los lectores están actualmente preparados para la captura automática de datos a través de lectores de código de barras lineal, se deberá comprobar si dichos lectores también permiten la lectura de códigos bidimensionales.
Programas informáticos. La utilización de códigos bidimensionales con una mayor capacidad de almacenamiento, va a permitir capturar de manera automática toda la información contenida en el código de identificación, incluidos el nº de lote y la fecha de caducidad.
Si el centro asistencial utilizara otro tipo de programas informáticos en procesos relacionados con medicamentos, deberían igualmente adaptarse a la nueva estructura de codificación. Tal es el caso de:
- Sistemas automatizados de las unidades de hospitalización.
- Sistemas de elaboración de medicamentos.
- Reenvasadoras.
- Otros.
Preparación de las bases de datos de medicamentos
Las bases de datos de medicamentos que se utilicen en los servicios de farmacia deberían contener la información de los medicamentos que deberían ser verificados:
- Medicamentos sometidos a prescripción, excepto los relacionados en el Anexo 1 del Reglamento Delegado 2016/161.
- Medicamentos que no requieren receta médica para su dispensación, que estén incluidos en el Anexo 2 del Reglamento Delegado 2016/161.
- Medicamentos a los cuales las autoridades sanitarias españolas hayan ampliado el ámbito de aplicación del identificador único o de los dispositivos contra las manipulaciones.
- Medicamentos que las autoridades competentes hayan pedido como muestras, de conformidad con la normativa española.
- Los medicamentos que se utilicen en investigación o medicamento auxiliar autorizado.
- Medicamentos extranjeros con dispositivos de seguridad e identificador único.
Formación del personal
Se debe prever la formación específica al personal de los servicios de farmacia sobre los nuevos procesos que se incluirán en sus rutinas definidas de trabajo.
Otras consideraciones para los servicios de farmacia de centros asistenciales
La verificación de los dispositivos de seguridad y desactivación del identificador único de cada medicamento podrá suponer:
- Reducir el riesgo de entrada de medicamentos falsificados en los almacenes de los mismos, en el caso de que la verificación tenga lugar en el momento de la recepción.
- favorecer la gestión mecanizada de las caducidades y número de lotes de los medicamentos.
Además, se debería tener en cuenta que desde los servicios de farmacia, en los últimos años, se ha trabajado e invertido muchos esfuerzos y recursos en la seguridad y la trazabilidad clínica de la utilización de medicamentos en los centros asistenciales.
Con el objeto de maximizar los esfuerzos y la inversión para la puesta en marcha del Reglamento Delegado 2016/161 a futuro se podría tener en cuenta lo siguiente:
- Implantar soluciones que permitan automatizar la identificación del medicamento en su acondicionamiento primario mediante el código de producto. Esto permitiría que pudiera ser escaneado en cada paso del proceso de elaboración, dispensación y administración de medicamentos al paciente para evitar errores de medicación.
- Implantar soluciones para productos biológicos y hemoderivados que permitan la inclusión del lote y la caducidad en la identificación del medicamento para realizar la trazabilidad hasta pacientes obligatoria. Ello permitiría una retirada eficiente y efectiva en caso de alarma sanitaria.
- Crear un marco de colaboración global industria-distribución-farmacia para poner en valor acciones tomadas por cada una de las partes que ponen en riesgo la seguridad del paciente.


