Voclosporina en nefritis lúpica
 Nº471
Nº471
Resumen
Voclosporina es un nuevo inhibidor de la calcineurina de estructura prácticamente idéntica a su predecesor ciclosporina A, pero más potente que esta y con un régimen posológico más flexible que no hace necesaria la monitorización de sus niveles plasmáticos. Mediante la inhibición dosis-dependiente de calcineurina, voclosporina inhibe reversiblemente la función de los linfocitos T, incluida la producción y liberación de citocinas: entre otras acciones, bloquea la expresión de IL-2 y otras respuestas inmunitarias mediadas por células T, lo que se traduce en la estabilización –inhibición de apoptosis– de los podocitos a nivel renal. En base a ello, el medicamento ha sido aprobado en la UE para el tratamiento por vía oral (dos veces al día, separadas al menos 8 h entre sí) de pacientes adultos con nefritis lúpica (NL) activa de clase III, IV o V (incluidas las clases mixtas III/V y IV/V) en combinación con micofenolato de mofetilo.
La eficacia de voclosporina por vía oral se ha estudiado en dos ensayos clínicos prospectivos, controlados y de fase 3: el estudio principal AURORA-1 (N= 357), aleatorizado (1:1), doble ciego, multicéntrico y de grupos paralelos, que incluyó a pacientes con nefritis lúpica de clases III o IV (asociadas o no a clase V) o de clase V pura, y el estudio de extensión AURORA-2, con pacientes que habían completado el primero y aceptaron enrolarse en el segundo.
En el estudio AURORA-1, voclosporina se mostró significativamente superior a placebo en términos de la variable principal, una medida compuesta de respuesta renal a las 52 semanas que incluye un límite de proteinuria (predictor de la función renal a largo plazo): la tasa de respuesta completa fue del 41% en el grupo de voclosporina frente al 23% con placebo, con una magnitud de la diferencia de 18,3 puntos porcentuales que puede considerarse moderada. Sin embargo, no se hallaron diferencias reseñables entre tratamientos con respecto a su impacto en la calidad de vida relacionada con la salud.
Por su parte, el estudio AURORA-2 –con diseño doble ciego y de brazos paralelos de voclosporina (n= 116) y placebo (n= 100)–, cuyo objetivo primario fue evaluar la seguridad y tolerabilidad del fármaco durante un periodo de tratamiento total de 36 meses, no ofrece una comparación verdaderamente aleatoria y sus resultados de eficacia deben considerarse descriptivos. Al final del estudio, se verificó respuesta renal completa en el 51% de los pacientes tratados con voclosporina vs. 39% con placebo, aunque este aumento de 12 puntos no alcanzó significación estadística.
El perfil de seguridad de voclosporina está en línea con lo conocido para otros inhibidores de calcineurina, como ciclosporina. Así, en tratamientos de 1 año casi todos los pacientes notifican eventos adversos, siendo los más frecuentes vs. placebo las infecciones (62% vs. 55%) y las reacciones adversas digestivas (45% vs. 35%), mayoritariamente leves-moderados en intensidad. Entre los graves (que afectan al 23% de quienes reciben el nuevo fármaco vs. 19% con placebo) predomina la aparición de infecciones (10%), el daño renal agudo (3%) y la hipertensión (2%), que conducen a una tasa de interrupción del tratamiento no desdeñable (13%).
Voclosporina es el primer inhibidor de calcineurina disponible en España con indicación específica en NL, una enfermedad grave que se asocia a un riesgo alto de enfermedad renal en estadio terminal y de mortalidad, frente a la cual ya hay opciones farmacológicas eficaces. Se trata de un medicamento sin novedad en el plano mecanístico que permitirá el control de la proteinuria (indicativo de reducción del daño renal) y aportará un beneficio clínico moderado con un perfil de seguridad aceptable, y que ya está incluido en varias guías clínicas nacionales e internacionales como alternativa terapéutica en NL, siempre adicionado a micofenolato y glucocorticoides en pacientes con funcionalidad renal no muy deteriorada.
En cualquier caso, no parece que vaya a suponer una modificación de la terapéutica actual, en línea con las consideraciones emitidas por agencias reguladoras como la francesa o la alemana, que establecen que voclosporina no supone una mejora suficiente en el tratamiento de su indicación o que no hay pruebas sólidas de un beneficio extra con su adición a micofenolato respecto del tratamiento estándar.
Aspectos fisiopatológicos
El lupus eritematoso sistémico (en adelante, LES) es referido habitualmente entre las diversas enfermedades autoinmunes sistémicas, esto es, se trata de una patología crónica y debilitante provocada por una reacción anómala del sistema inmunitario del paciente frente a estructuras normales del propio organismo y capaz de afectar a varios órganos y/o tejidos, con amplia heterogeneidad en su presentación clínica (Figura 1).
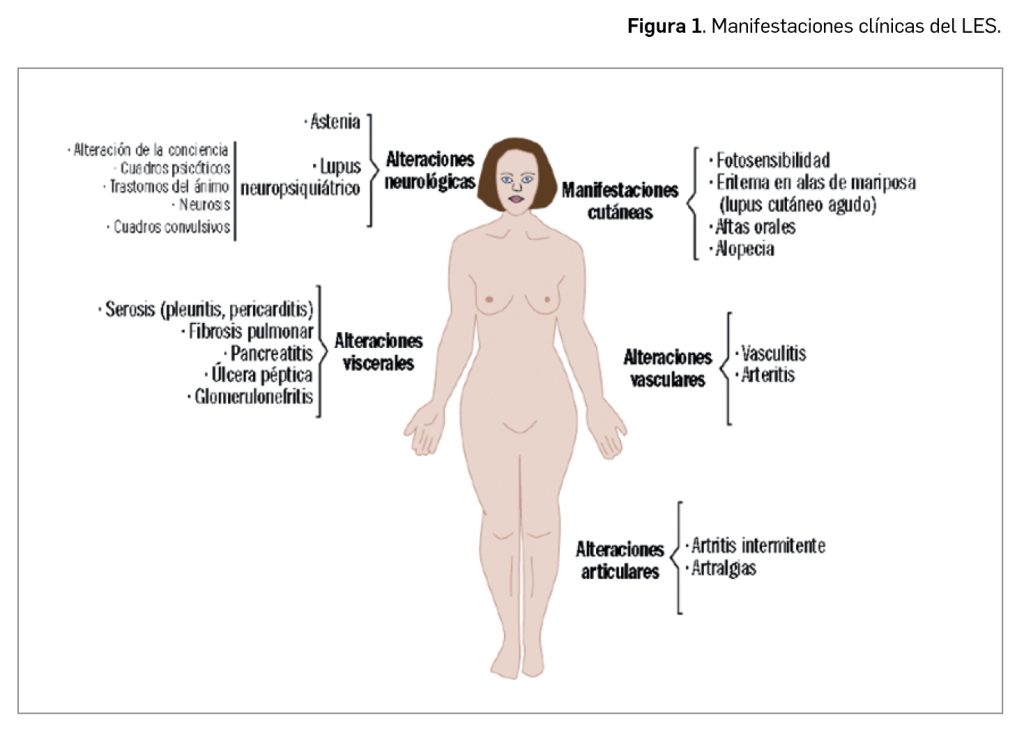
LES son las cutáneas, pero también son muy comunes la astenia y las artralgias; incluso pueden aparecer con alta frecuencia una artritis intermitente (afecta especialmente a las manos, pero también a otras articulaciones) y una alteración visceral dispersa que puede afectar a cualquier órgano, desde el riñón, en forma de glomerulonefritis, hasta el sistema nervioso central o los aparatos cardiovascular, pulmonar o digestivo.
La prevalencia del LES es notablemente superior en mujeres, aunque con diferencias entre grupos de edad, lo que hace presumir que al menos hasta cierto grado existe en la etiopatogenia de la enfermedad un componente hormonal relacionado con los estrógenos. Además, la enfermedad suele tener una presentación bimodal: la mayoría de los casos se da en torno a los 30 años y otro pico menor en torno a los 55 años. Se estima que la enfermedad afecta a alrededor de 100 000 personas en España (85% mujeres) y solo el 3-5% de los pacientes con LES cuenta con otros miembros familiares afectados.
El pronóstico de la enfermedad, cuya evolución depende fundamentalmente de la afectación aguda (peor cuanto más precoz) y crónica (daño acumulado)1, ha cambiado sustancialmente en las últimas décadas: si bien la supervivencia a los 5 años desde el diagnóstico rondaba el 50% en 1955, actualmente alcanza el 95% a los 5 años y el 93% a los 10 años.
Para un mayor conocimiento sobre los criterios que dirigen el diagnóstico diferencial2 de la enfermedad y otros aspectos clínicos, incluidas las opciones de abordaje farmacológico disponibles frente al LES, se recomienda consultar otro artículo recientemente publicado en Panorama Actual del Medicamento (Caballero, 2023). A grandes rasgos, para alcanzar el objetivo terapéutico de reducir el número y la duración de los brotes (evitar el daño agudo con un control del proceso inflamatorio crónico que minimice los efectos deletéreos a largo plazo) y atenuar la pérdida y/o destrucción de tejidos con la menor toxicidad posible suele recurrirse a antiinflamatorios no esteroideos, corticosteroides, inmunosupresores clásicos (azatioprina, metotrexato, ciclofosfamida, etc.), inmunomoduladores (como la hidroxicloroquina), y, en los casos moderados o graves, a fármacos biológicos tales como belimumab o el más recientemente introducido anifrolumab.
Entre las principales complicaciones –más graves– de la enfermedad sobresale la nefritis lúpica (en adelante, NL), que acontece en casi un tercio de los pacientes (31%), quienes tendrán un mayor riesgo de afectación grave de la funcionalidad renal a largo plazo: puede provocar lesiones crónicas en los riñones y determina que los pacientes con NL tengan un riesgo hasta 6 veces mayor de mortalidad respecto a sujetos sanos. Puede llegar a afectar a hasta la mitad de los pacientes adultos con LES, con un predominio eminentemente femenino (85%) y una media de edad al diagnóstico de unos 28 años en nuestro país. En Europa, algunos estudios epidemiológicos han estimado una prevalencia de NL de entre 0,4 y 1,4 por cada 10 000 habitantes, habiéndose descrito una amplia variabilidad epidemiológica según regiones y razas o etnias, con mayor probabilidad de padecerla (también con mayor gravedad de sus complicaciones), por ejemplo, entre las personas con LES de raza negra (afroamericanos) e hispanos y menor entre personas de raza blanca/caucásica (10-20%).
Desde el punto de vista clínico, la NL comprende un amplio espectro de lesiones vasculares, glomerulares y tubulointersticiales. El daño renal a menudo se traduce en proteinuria (signo patognomónico) y/o hematuria de muy distintos grados3, asociadas a una funcionalidad disminuida del órgano que se evidencia en un aclaramiento renal y una tasa de filtración glomerular estimada (TFGs) patológicamente disminuidas. De hecho, se estima que un 10-30% de los pacientes con NL desarrollan nefropatía en estadio terminal, que se asocia con un riesgo de mortalidad aumentado en > 25 veces respecto a la población general.
Se ha establecido una clasificación internacionalmente aceptada de 6 clases o estadios de NL en función de su severidad4, que determina su pronóstico y tratamiento. En cualquier caso, la evolución típica de la NL se caracteriza por periodos de quiescencia de la enfermedad en que se intercalan reagudizaciones activas que provocan una pérdida acumulativa de nefronas y un deterioro progresivo de la función renal. Si bien la supervivencia a 10 años puede ascender desde el entorno del 50% hasta el 95% si se consigue la remisión completa de la NL (reducciones de la proteinuria por debajo de 0,5-0,7 g/24 h se asocian con mejoras en la supervivencia renal), entre 1 y 3 de cada 10 pacientes con NL progresan a enfermedad renal terminal al cabo de los 10 años desde el diagnóstico.
El enfoque actual de tratamiento de la NL se ha mantenido prácticamente sin cambios durante los últimos 10 años y se dirige a mejorar la supervivencia, preservar a largo plazo la función renal, prevenir los brotes de la enfermedad, minimizar la toxicidad del tratamiento y mejorar la calidad de vida del paciente. Se suele buscar una reducción rápida de la proteinuria (implica daño renal), pues, si no se resuelve, el daño renal se vuelve permanente. Las reducciones de la proteinuria por debajo de 0,5-0,7g/24h se asocian con mejoras en la supervivencia renal.
El abordaje estándar se basa en la administración de dosis altas de inmunosupresores: en concreto, de corticosteroides combinados con el uso fuera de indicación de otros fármacos como micofenolato de mofetilo, ciclofosfamida o azatioprina5. Hasta ahora, los inhibidores de calcineurina comercializados en España (tacrólimus y ciclosporina) se usaban excepcionalmente en caso de intolerancia o refractariedad a los anteriores, bien solos o combinados con otros inmunosupresores, pero requieren de la monitorización de sus niveles plasmáticos, por el riesgo de hipertensión y de efectos vasomotores renales agudos como toxicidades más frecuentes. Además, siempre que no existan contraindicaciones de uso, en todos los pacientes se recomienda adicionar la hidroxicloroquina, que es capaz de reducir el riesgo de exacerbaciones renales y mejora la supervivencia, y también terapia nefroprotectora con fármacos bloqueantes del sistema renina-angiotensina y/o fármacos anti-aldosterona. Más recientemente (2021) se ha aprobado en la UE belimumab para su uso en combinación con terapias inmunosupresoras de base para el tratamiento de pacientes adultos con NL activa.
En cuanto a las estrategias terapéuticas, hasta hace poco se diferenciaba categóricamente entre las fases de inducción (con dosis altas de corticoides más ciclofosfamida o micofenolato) y de mantenimiento (con dosis más bajas de inmunosupresores para mejorar la tolerabilidad, evitando la ciclofosfamida), pero hoy en día ese concepto está más en debate, usándose los tratamientos de forma continuada en ambas fases. A pesar de que las opciones disponibles han reducido la morbimortalidad de la NL, hasta la mitad de los afectados no consigue un control completo de la enfermedad y evoluciona a una afectación renal terminal, por lo que es deseable disponer de nuevos tratamientos que sean más dirigidos y seguros, permitiendo mitigar la conocida toxicidad a largo plazo de los regímenes de tratamiento estándar a base de corticoides y otros inmunosupresores6.
Acción y mecanismo
Voclosporina es un nuevo inhibidor dosis-dependiente de la calcineurina, más potente que su antecesor ciclosporina7. Habida cuenta de que la calcineurina es una fosfatasa dependiente de calcio/calmodulina (cuya actividad determina un aumento de los niveles de Ca2+ intracelular) necesaria para la inducción de la producción y proliferación de linfocinas en los linfocitos T, se comprende que la actividad inhibitoria de voclosporina sobre esa enzima se traduce en un efecto inmunosupresor: voclosporina inhibe la proliferación de linfocitos, la producción de citocinas y la expresión de antígenos de superficie para la activación de linfocitos T. En base a ello, el medicamento ha sido aprobado para el tratamiento por vía oral (dos veces al día, separadas al menos 8 h entre sí) de pacientes adultos con nefritis lúpica (NL) activa de clase III, IV o V (incluidas las clases mixtas III/V y IV/V) en combinación con micofenolato de mofetilo.
Algunos estudios han sugerido que la inhibición de la calcineurina se puede traducir en un efecto protector en los podocitos8 renales a través de la estabilización del citoesqueleto y la inhibición de la apoptosis de estas células. Por el contrario, aunque con cierta actividad, no parece que induzca una prolongación del intervalo QT del electrocardiograma clínicamente relevante.
También se ha postulado que voclosporina presenta ciertas ventajas respecto a los otros inhibidores de calcineurina –ciclosporina y tacrólimus–, referidas fundamentalmente a un balance farmacocinético/farmacodinámico predecible que permite un régimen posológico más flexible sin necesidad de monitorizar sus niveles plasmáticos, una mayor potencia inhibitoria sobre la calcineurina (2-4 veces mayor que la ciclosporina A) y un perfil metabólico mejorado que potencialmente resulta en una menor incidencia de efectos adversos (EMA, 2022).
Aspectos moleculares
El nuevo principio activo, de estructura peptídica, tienen un complejo nombre químico, el de ciclo{[(6E)-(2S,3R,4R)-3-hidroxi-4-metil-2-(metilamino)-6,8-nonadienoil]-L-2-aminobutiril-N-metil-glicil-N-metil-L-leucil-L-valil-N-metil-L-leucil-L-alanil-D-alanil-N-metil-L-leucil-N-metil-L-leucil-N-metil-L-valil}, que se corresponde con la fórmula C63H111N11O12 y un peso molecular relativo de 1214,6 g/mol.
La estructura de voclosporina es prácticamente idéntica a la de ciclosporina (Figura 2), salvo por una modificación en la región del aminoácido 1, la cual se cree que cambia su unión a la calcineurina, aumenta su potencia inhibitoria y altera su perfil de metabolismo9. En cualquier caso, no se considera un profármaco, ni un enantiómero, ni un complejo ni una sal de ciclosporina.
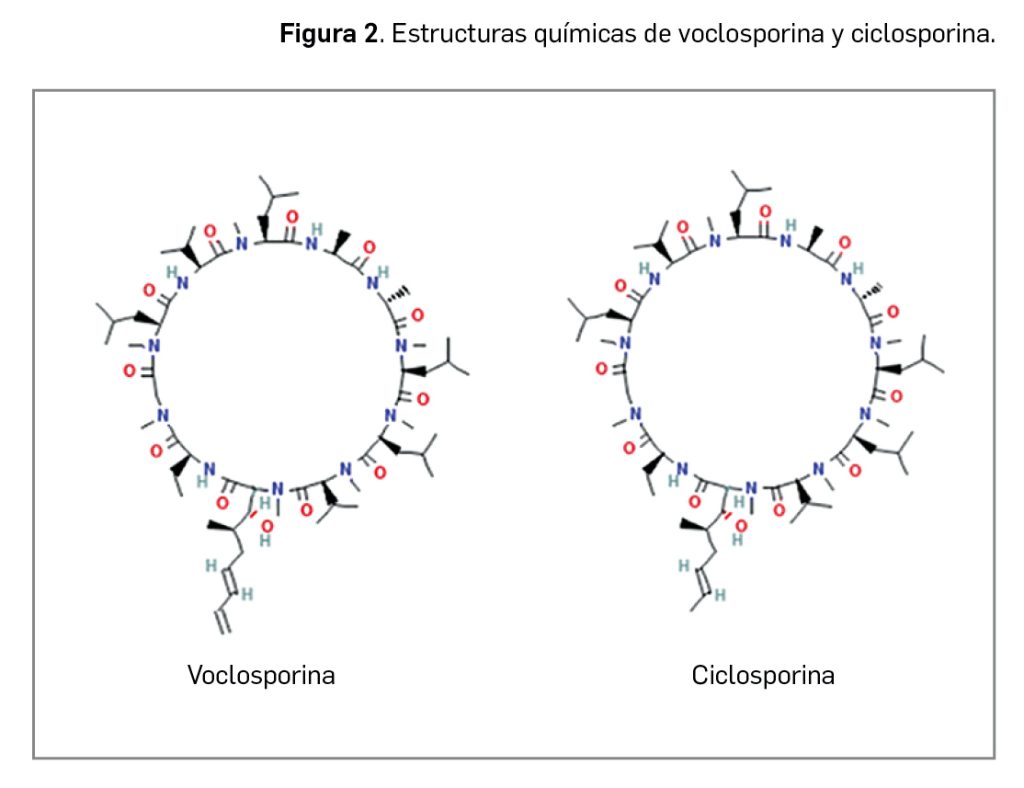
La molécula de voclosporina, como la de ciclosporina, exhibe estereoisomería por la presencia de hasta 12 centros quirales y un doble enlace C=C. El principio activo, que consiste en una mezcla de isómeros E (trans) y Z (cis), se presenta como un sólido de color blanco o blanquecino, prácticamente insoluble en agua (en cambio, ampliamente soluble en diversos solventes orgánicos); en su forma hidrato cristalina tiene un carácter ligeramente higroscópico.
Eficacia y seguridad clínicas
La eficacia y seguridad de voclosporina por vía oral han sido contrastadas en dos ensayos clínicos prospectivos, controlados y de fase 3: el estudio principal AURORA-1, que incluyó a pacientes con nefritis lúpica de clases III o IV (asociadas o no a clase V) o de clase V pura, y el estudio de extensión AURORA-2, con pacientes que habían completado el primero y aceptaron enrolarse en el segundo.
El diseño de AURORA-1 fue aleatorizado (1:1), doble ciego, multicéntrico, multinacional (142 centros de 27 países) y de grupos paralelos, con el objetivo de comparar el tratamiento con voclosporina (23,7 mg dos veces al día) frente a un placebo equivalente durante un periodo de 52 semanas, pudiéndose suspender o realizar ajustes posológicos de la pauta por motivos de seguridad o descensos pronunciados de la función renal. De forma complementaria, todos los pacientes recibieron el estándar de tratamiento inmunosupresor10 y se permitió el uso de hidroxicloroquina cuando estuviera indicado. Se incluyeron un total de 357 pacientes con diagnóstico de LES y NL activa –confirmado por biopsia renal– que necesitaban altas dosis de glucocorticoides, pero se excluyeron aquellos con una función renal basal muy deteriorada (tasa de filtración glomerular < 45 ml/min/1,73 m2), los que estaban en diálisis, recibían ciertos inmunosupresores (inhibidores de calcineurina o biológicos) o quienes padecían determinadas patologías cardiovasculares, hepáticas u otras autoinmunes.
Las características demográficas y clínicas de los sujetos enrolados estaban bien equilibradas en los dos grupos de tratamiento, sobresaliendo las siguientes: edad media de 33 años (rango 18-72), una mayoría de mujeres (88%; 82% en edad fértil), una mayoría de raza blanca (36%) o asiática (31%), un peso promedio de 67 kg y una mediana de tiempo desde el diagnóstico de LES y de NL de 5 y 2 años, respectivamente. Además, prácticamente todos los pacientes habían sido pretratados para NL en algún momento (94% con corticoides, 67% con hidroxicloroquina y 63% con micofenolato), solo un 2% estaba sin tratamiento específico, y, en concreto, más de la mitad recibía corticoides (80%) o micofenolato (55%) en el momento de su inclusión.
La variable principal de eficacia fue la respuesta renal completa al final del periodo de estudio, entendida esta como: un cociente proteína/creatinina (en adelante, CPC) en orina de ≤ 0,5 mg/mg, una tasa de filtrado glomerular estimada (en adelante, TFGe) de ≥ 60 ml/min/1,73m2 o que empeoraba < 20% con respecto al valor basal, no haber recibido medicación de rescate para la NL y tampoco haber recibido > 10 mg de prednisona durante ≥ 3 días seguidos o 7 en total en los últimos 2 meses del periodo de tratamiento. Los resultados divulgados del análisis por intención de tratar ponen de manifiesto que dicho objetivo es alcanzado por más pacientes en el grupo de voclosporina respecto a placebo (Rovin et al., 2021). Además, el fármaco también fue superior a placebo en términos de las variables secundarias, entre las que destacan el tiempo hasta alcanzar el objetivo de CPC, la respuesta renal completa a la semana 24 o la respuesta parcial (reducción del 50% del CPC en orina frente al basal) a las semanas 24 y 52 (Tabla 1).
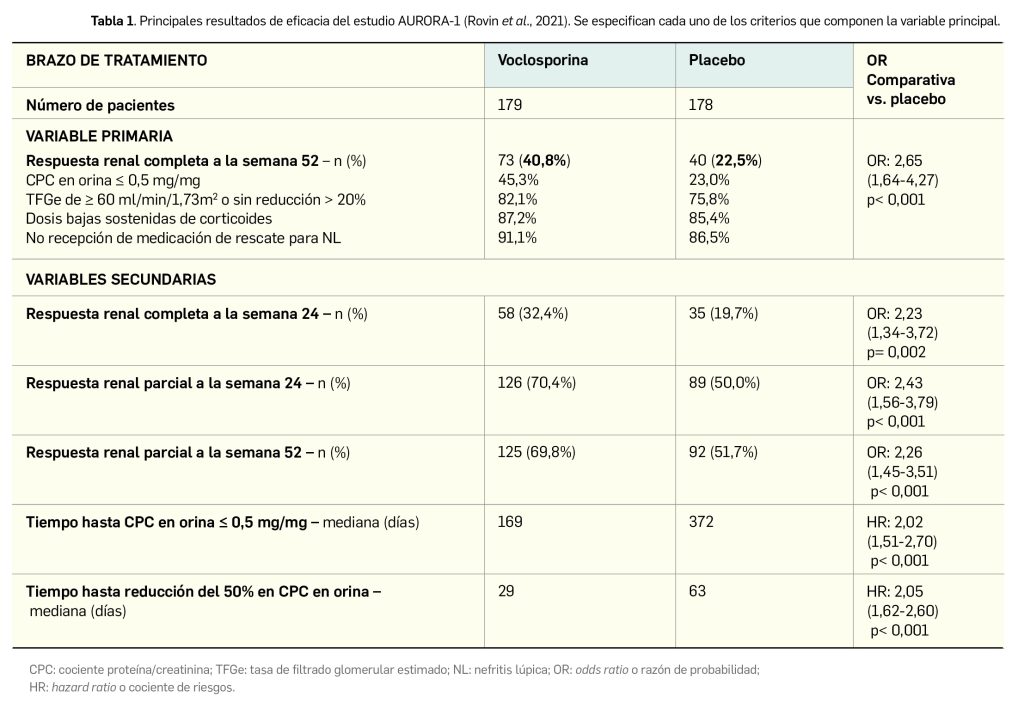
Cabe destacar que el 87% de los pacientes (n= 309) completaron el periodo de 1 año de tratamiento (91% en el grupo de voclosporina y 83% en el grupo placebo). De modo interesante, se observó que una amplia mayoría (> 80%) lograba una reducción de la dosis de corticosteroides orales a ≤ 2,5 mg/día en la semana 24, manteniéndose esa alta proporción (> 75% de los pacientes) hasta la semana 52. Pese a que se habían predefinido una serie de análisis por subgrupos –según factores como edad, sexo, raza, uso de fármacos, etc.–, el ensayo no dispuso de la potencia suficiente para detectar diferencias estadísticamente significativas entre subgrupos11. Tampoco se hallaron diferencias reseñables entre tratamientos con respecto a su impacto en la calidad de vida relacionada con la salud, según los resultados del cuestionario SF-36 y de los dominios relacionados con la salud de la escala validada LupusPRO a las 24 y 52 semanas.
Por otro lado, el ensayo de soporte AURORA-2 fue en realidad un estudio de continuación durante un máximo de 24 meses adicionales para evaluar eficacia y seguridad de voclosporina en hasta 216 pacientes que completaron las 52 semanas del estudio anterior. Tuvo también un diseño doble ciego y constó de dos brazos paralelos de voclosporina (n= 116) y placebo (n= 100), con el objetivo primario de evaluar la seguridad y tolerabilidad del fármaco durante un periodo de tratamiento total de 36 meses, siendo las variables de eficacia objetivos secundarios.
Una amplia proporción (> 85%) de los pacientes enrolados en AURORA-2 completó los 3 años de tratamiento con voclosporina, y la mayoría de ellos (76% con voclosporina y 78% con placebo) se mantuvo con dosis bajas de corticoides al final de ese periodo. Si se considera que al inicio de esta fase de extensión presentaban respuesta renal el 53% y el 34% de los pacientes enrolados en los grupos de voclosporina y placebo, respectivamente, se puede concluir que la eficacia del fármaco es sostenida en el tiempo, aunque no se ven grandes diferencias respecto a placebo: al final del estudio AURORA-2, tras 3 años de tratamiento, el 72% de los pacientes tratados con voclosporina y el 65% de los tratados con placebo continuaban presentando respuesta renal, con tasas de respuesta completa del 51% y 39%, respectivamente, en cada uno de esos grupos (OR= 1,74; IC95% 1,00-3,03; p= 0,051; la diferencia no alcanzó significación estadística para la tasa de respuesta completa). No hubo tampoco diferencias reseñables entre grupos en cuanto a la funcionalidad renal medida por TFGe a lo largo de los 3 años de tratamiento total.
Por último, la seguridad de voclosporina ha sido bien caracterizada con datos derivados de 2666 sujetos expuestos al fármaco en su desarrollo clínico, 365 de ellos con NL, de los que 116 lo han recibido durante más de 1 año.
En el ensayo AURORA-1, el que aporta la evidencia más robusta, una amplia mayoría de pacientes con NL tratados notificó algún evento adverso, en una proporción ligeramente superior al grupo placebo (88%). Destaca por su frecuencia la incidencia de infecciones (62% vs. 55% con placebo; urinarias, de vías respiratorias superiores, herpes zóster y gastroenteritis, mayoritariamente) y los trastornos digestivos (45% vs. 35%); en comparación con placebo, predominaron con el fármaco la reducción de la TFGe (26% vs. 9%), la hipertensión (19% vs. 9%; tiende a igualarse su incidencia con el tiempo), la diarrea (19% vs. 13%), la cefalea (15% vs. 8%), la anemia (12% vs 6%) y la tos (11% vs. 2%). La mayoría de los eventos adversos con el fármaco fueron leves-moderados, si bien la proporción de eventos graves no es desdeñable (23% vs. 19% con placebo, de mayor severidad con voclosporina), destacando los relacionados con infecciones (10%) y con el daño renal agudo (3% vs. 1%), como la hipertensión (2% vs. 0,4%). La tasa de interrupciones del tratamiento por motivos de seguridad fue similar en ambos brazos (13%), sobre todo por disminución marcada de la TFGe (3,7% con voclosporina).
En tratamientos más largos de 1 año (datos de AURORA-2), el perfil de seguridad de voclosporina parece similar a lo comentado, manteniéndose una importante incidencia de insuficiencia renal aguda o enfermedad renal crónica (28% vs. 18%, graves en 2% vs. 5%), aunque la mayoría no se relacionaron con el tratamiento y no parecen indicar un efecto crónico a nivel renal del fármaco. En todo caso, se recomienda una estrecha supervisión de la función renal durante su uso para evaluar la necesidad de ajustes posológicos. Durante el periodo máximo de 3 años de tratamiento, se registraron 3 muertes como consecuencia de eventos adversos (dos por COVID-19 y una por embolia pulmonar), todas ellas en el grupo placebo.
Aspectos innovadores
Voclosporina es un nuevo inhibidor de la calcineurina de estructura prácticamente idéntica a su predecesor ciclosporina A, pero más potente que esta y con un régimen posológico más flexible que no hace necesaria la monitorización de sus niveles plasmáticos. Mediante la inhibición dosis-dependiente de calcineurina, voclosporina inhibe reversiblemente la función de los linfocitos T, incluida la producción y liberación de citocinas: entre otras acciones, bloquea la expresión de IL-2 y otras respuestas inmunitarias mediadas por células T, lo que se traduce en la estabilización –inhibición de apoptosis– de los podocitos a nivel renal. En base a ello, el medicamento ha sido aprobado en la UE para el tratamiento por vía oral (dos veces al día, separadas al menos 8 h entre sí) de pacientes adultos con nefritis lúpica (NL) activa de clase III, IV o V (incluidas las clases mixtas III/V y IV/V) en combinación con micofenolato de mofetilo.
Su aprobación se sustenta en la demostración de eficacia fundamentalmente en el estudio pivotal AURORA-1 (N= 357), cuyo diseño –aleatorizado, doble ciego, multicéntrico y de grupos paralelos– fue considerado adecuado por la EMA, aunque con ciertos matices en cuanto a la definición de la variable principal de eficacia y la duración del seguimiento. La ausencia de comparación directa con un tratamiento activo frente a la NL (en especial, otro inhibidor de calcineurina como tacrólimus) es una limitación notable, como también lo es la falta o escasez de evidencia respecto a su uso en combinación con otros tratamientos inmunosupresores distintos del MMF o su empleo en mayores de 65 años o mujeres embarazada12 o lactantes (AEMPS, 2023).
En cualquier caso, voclosporina se mostró significativamente superior a placebo en términos de la variable principal, una medida compuesta de respuesta renal a las 52 semanas que incluye un límite de proteinuria (predictor de la función renal a largo plazo): la tasa de respuesta completa fue del 41% en el grupo de voclosporina frente al 23% con placebo, con una magnitud de la diferencia de 18,3 puntos porcentuales que puede considerarse moderada, siendo el número de pacientes que es necesario tratar (NNT) de 5. Pero se debe subrayar que solo el criterio de reducción de la proteinuria es el factor que cumple significación estadística entre los dos brazos y determina esa diferencia, no así el relativo a la tasa de filtración glomerular, las dosis de corticoides o la necesidad de terapia de rescate, muy similares entre los brazos de tratamiento.
Los resultados de las variables secundarias respaldan el beneficio estadísticamente significativo pero moderado del uso de voclosporina respecto a placebo. La respuesta renal completa a la semana 24 fue del 32% con el fármaco y del 20% con placebo (diferencia de 12,7 puntos; NNT= 8), la respuesta renal parcial tras 6 meses y 1 año crece aproximadamente 20 puntos porcentuales con el nuevo fármaco (desde el 50-52% con placebo hasta el 70%), y el tiempo hasta el objetivo de proteinuria (CPCo ≤ 0,5 mg/mg y reducción del 50% en el valor basal de CPCo) se reduce aproximadamente a la mitad, lo que se puede considerar clínicamente relevante. No obstante, no se vieron diferencias reseñables en las escalas de calidad de vida, no pudiéndose concluir que los cambios en variables clínicas se traduzcan en mejoras de la calidad de vida de los pacientes con NL.
Por su parte, el estudio AURORA-2 no ofrece una comparación verdaderamente aleatoria y sus resultados de eficacia deben considerarse descriptivos, si bien proporciona datos valiosos que sugieren que el beneficio con voclosporina se mantiene en periodos de al menos 3 años de tratamiento continuado.
Al final del estudio, se verificó respuesta renal completa en el 51% de los pacientes tratados con voclosporina, aunque el aumento de 12 puntos frente a placebo (respuesta completa del 39%) no alcanzó significación estadística, sin cambios tampoco destacables en la funcionalidad renal medida por la TFGe.
El perfil de seguridad de voclosporina está en línea con lo conocido para otros inhibidores de calcineurina, como ciclosporina, y se caracteriza por una mayoría de eventos adversos –ligeramente más incidentes que con placebo– de carácter reversible y que responden a modificaciones de la pauta de tratamiento. Así, en tratamientos de 1 año casi todos los pacientes notifican eventos adversos, siendo los más frecuentes las infecciones (62% vs. 55%) y las reacciones adversas digestivas (45% vs. 35%), mayoritariamente leves-moderados en intensidad. Entre los graves (que afectan al 23% de quienes reciben el nuevo fármaco vs. 19% con placebo) predomina la aparición de infecciones (10%), el daño renal agudo (3%) y la hipertensión (2%), que conducen a una tasa de interrupción del tratamiento no desdeñable (13%). El limitado seguimiento de quienes reciben voclosporina (máximo de 3 años) no permite descartar riesgos derivados de su uso a largo plazo, como el potencial de malignidad, nefrotoxicidad irreversible y neurotoxicidad, que deben definirse en futuros estudios, pues pueden ser especialmente relevantes en el contexto de una enfermedad crónica y progresiva que requiere de tratamientos prolongados.
En relación con su posicionamiento en el arsenal terapéutico, no se dispone de comparaciones directas de voclosporina con otros fármacos aprobados para tratar la NL. En cuanto a comparaciones indirectas, de escasa robustez inherente, se han divulgado resultados de dos metaanálisis en red que lo comparan con belimumab, por un lado, y con micofenolato de mofetilo o con éste más tacrólimus, por otro. El primero de ellos comparó la respuesta renal completa tras 2 años de tratamiento con belimumab (43% vs. 32% con placebo; p= 0,03; NNT= 9) con la respuesta tras 1 año con voclosporina en su estudio pivotal; pese a haber diferencias notables en la definición de la variable de eficacia, la población de pacientes y tratamientos concomitantes entre estudios, no se vieron cambios estadísticamente significativos en la tasa de respuesta (Tice et al., 2021). Otro metaanálisis (Lee et al.; 2021) con datos de hasta 936 pacientes de 4 ensayos clínicos halló resultados estadísticamente superiores de remisión renal completa a los 6 meses con las combinaciones de voclosporina+micofenolato de mofetilo y de tacrólimus+micofenolato de mofetilo respecto a las monoterapias con ciclofosfamida o con micofenolato de mofetilo. Sin diferencias sustanciales entre las combinaciones de dos fármacos (OR= 1,43), la probabilidad de ser clasificado como el tratamiento más eficaz fue para la combinación con tacrólimus, si bien la terapia dual con voclosporina parece más segura (OR= 0,55). También con importantes limitaciones, este estudio no permite concluir sobre la superioridad de voclosporina sobre tacrólimus en cuanto a eficacia o seguridad.
A la vista de todo lo anterior, estamos ante el primer inhibidor de calcineurina disponible en España con indicación específica en NL (ciclosporina y tacrólimus tienen indicación en trasplantes y en otras patologías autoinmunes), una enfermedad grave que se asocia a un riesgo alto de enfermedad renal en estadio terminal y de mortalidad, frente a la cual ya hay opciones farmacológicas eficaces. Se trata de un medicamento sin novedad en el plano mecanístico que permitirá el control de la proteinuria (indicativo de reducción del daño renal) y aportará un beneficio clínico moderado con un perfil de seguridad aceptable, y que ya está incluido en varias guías clínicas nacionales (Rojas-Rivera et al., 2023) e internacionales como alternativa terapéutica en NL, siempre adicionado a micofenolato y glucocorticoides en pacientes con funcionalidad renal no muy deteriorada. En cualquier caso, no parece que vaya a suponer una modificación de la terapéutica actual, en línea con las consideraciones emitidas por ciertas agencias reguladoras de países de nuestro entorno, como la francesa o la alemana, que establecen que voclosporina no supone una mejora suficiente en el tratamiento de su indicación o que no hay pruebas sólidas de un beneficio extra con su adición a micofenolato de mofetilo respecto del tratamiento estándar.

Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica Lupkynis® (voclosporina). 2022. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/1221678001/FT_1221678001.html.pdf.
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de voclosprina (Lupkynis®) en nefritis lúpica. IPT-191/V1/24102023. 2023. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/2023/IPT-191-Lupkynis-voclosporina-nefritis-lupica.pdf.
-
- Aringer M, Costenbader K, Daikh D, Brinks R, Mosca M, Ramsey-Goldman R et al. 2019 European League Against Rheumatism/American College of Rheumatology Classification Criteria for Systemic Lupus Erythematosus. Arthritis Rheumatol. 2019; 71(9): 1400-112. DOI: 10.1002/art.40930.
-
- Caballero Portero P. Anifrolumab (Saphnelo®) en lupus eritematoso sistémico. Panorama Actual Med. 2023; 47(466): 904-11.
-
- European Medicines Agency (EMA). Lupkynis®. European Public Assessment Report (EPAR). 2022. EMA/681286/2022. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/lupkynis-epar-public-assessment-report_en.pdf.
-
- Lee YH, Song GG. A network meta-analysis of randomized controlled trials comparing the effectiveness and safety of voclosporin or tacrolimus plus mycophenolate mofetil as induction treatment for lupus nephritis. Z Rheumatol. 2023; 82(7): 580-6. DOI: 10.1007/s00393-021-01087-z.
-
- Rojas-Rivera JE, García-Carro C, Ávila AI, Espino M, Espinosa M, Fernández-Juárez G et al. Consensus document of the Spanish Group for the Study of the Glomerular Diseases (GLOSEN) for the diagnosis and treatment of lupus nephritis. Nefrologia (Engl Ed). 2023; 43(1): 6-47. DOI: 10.1016/j.nefroe.2023.05.006.
-
- Rovin BH, Teng YKO, Ginzler EM, Arriens C, Caster DJ, Romero-Diaz J et al. Efficacy and safety of voclosporin versus placebo for lupus nephritis (AURORA 1): a double-blind, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2021; 397(10289): 2070-80. DOI: 10.1016/S0140-6736(21)00578-X.
-
- Tice JA, Mandrik O, Thokala P, Fotheringham J, Agboola F, Herron-Smith S et al. Voclosporin and Belimumab for Lupus Nephritis: Effectiveness and Value; Evidence Report. Institute for Clinical and Economic Review. 2021. Disponible en: https://icer.org/wp-content/uploads/2020/11/ICER_Lupus-Nephritis_Final-Evidence-Report_05182022.pdf.
1 El mantenimiento de la inflamación crónica parece inducir la presencia acelerada de daño ateromatoso en las arterias, independientemente de la presencia de otros factores de riesgo vascular clásicos (hipertensión, diabetes, tabaquismo, colesterol, etc.). También son importantes en el pronóstico las complicaciones infecciosas, tanto por el uso de fármacos inmunosupresores como por la pérdida de las estructuras defensivas primarias por efecto de la propia enfermedad (las alteraciones de la piel pueden favorecer las infecciones cutáneas, la presencia de hematuria y la proteinuria puede favorecer las infecciones urinarias, etc.). Incluso se ha descrito que la raza negra y latina y la situación socioeconómica baja tienen repercusión en el peor pronóstico de estos pacientes.
2 Los criterios diagnósticos más ampliamente aceptados y usados son los recogidos en el documento elaborado por la European Alliance of Associations for Rheumatology (EULAR) y el American College of Rheumatology (ACR) (Aringer et al., 2019).
3 Las manifestaciones de la NL van desde proteinuria mínima y hematuria microscópica asintomáticas hasta la proteinuria de rango nefrótico, con hipertensión grave, edema periférico e insuficiencia renal.
4 La clasificación de la Sociedad Internacional de Nefrología y la Sociedad de Patología Renal (ISN/RPS) establece 6 clases o estadios, de mayor gravedad a mayor numeración. Las clases III y IV son las de pronóstico más grave, de tipo proliferativo, siendo la clase IV, en general, la más prevalente y asociada con el mayor riesgo de progresión a enfermedad renal terminal; ambas requieren tratamiento agresivo con corticoides e inmunosupresores. Por su parte, la clase V o membranosa puede aparecer en solitario o asociada a las clases III y IV, y se caracteriza por la aparición de depósitos de inmunocomplejos y por proteinuria de rango nefrótico. Las clases I y II son las más leves y no suelen requerir terapia inmunosupresora, mientras que los pacientes con NL clase VI se pueden considerar candidatos a trasplante renal.
5 La actualización de 2019 de las recomendaciones de la Liga Europea contra el Reumatismo/Asociación Renal Europea-Asociación Europea de Diálisis y Trasplantes (EULAR/ERA-EDTA) para el tratamiento de la NL recoge la conveniencia de un tratamiento inicial con agentes inmunosupresores (micofenolato 2,3 g/día o ciclofosfamida intravenosa en dosis bajas de 500 mg cada 2 semanas para un total de 6 dosis) en combinación con corticoides en pacientes con NL de clase III, IV y V. Si hay mejoría inicial, se recomienda un mantenimiento posterior con micofenolato (1,2 g/día) o azatioprina (2 mg/kg/día), considerando belimumab como terapia complementaria. En todo caso, el documento reconoce que no hay evidencia de alta calidad para guiar el tratamiento, en especial en pacientes con factores pronósticos adversos de tipo clínico o histológico.
6 Por ejemplo, el uso de ciclofosfamida, sobre todo a largo plazo, se asocia con una notable toxicidad, que incluye la infertilidad irreversible y la toxicidad embriofetal; por ello, desde finales del siglo pasado se prefería su uso durante periodos cortos (3 a 6 meses), solo en inducción y preferiblemente a dosis bajas. Por todo ello, se suele preferir el uso de micofenolato de mofetilo, que tampoco está exento de toxicidad: por su teratogenicidad, en mujeres en edad fértil que deseen quedarse embarazadas se optará por la azatioprina.
7 Ciclosporina A ejerce sus efectos inhibitorios sobre la calcineurina –y, en consecuencia, sobre la función de los linfocitos T– mediante su unión a la ciclofilina. El complejo que se forma por esa unión (ciclosporina-ciclofilina) es capaz de inhibir la actividad serina-treonina fosfatasa (dependiente de calcio y calmodulina) de la calcineurina. Adicionalmente, el fármaco ejerce otras acciones, como la inhibición de varios factores de transcripción necesarios para la inducción de diversas citocinas (como IL-2, IFN-γ, IL-4 o GM-CSF), todo lo cual se traduce en una reducción de la inflamación sistémica, que permite tratar la glomerulonefritis asociada a LES.
8 Los podocitos son células epiteliales especializadas adheridas a la membrana basal glomerular, que constituyen una parte esencial en la barrera de filtración y previenen la pérdida de las proteínas séricas por la orina.
9 Voclosporina se metaboliza predominantemente por el CYP3A4, por lo que su administración concomitante con inhibidores potentes del CYP3A4 está contraindicada, y su dosis debe reducirse cuando se coadministra con inhibidores moderados del CYP3A4. Tampoco se recomienda su uso conjunto con inductores moderados o potentes del CYP3A4.
10 Se consideró terapia estándar la administración conjunta de micofenolato de mofetilo o MMF (2 g/día) y corticosteroides (máximo 1 g de metilprednisolona intravenosa durante los días 1 y 2, seguido de un esquema de reducción progresiva de dosis oral durante 4 meses). Los sujetos que recibían MMF antes de la aleatorización continuaron recibiéndolo sin interrupción, pero aquellos en tratamiento previo con azatioprina o micofenolato sódico cambiaron a MMF al iniciar el estudio.
11 Solo se vieron indicios de una eficacia más importante –en términos de la variable principal– de voclosporina entre pacientes que usaban micofenolato de mofetilo en el inicio respecto a los que no, lo cual no se ha podido confirmar en otros estudios de soporte (AEMPS, 2023).
12 Voclosporina se utiliza de forma concomitante con micofenolato de mofetilo, cuyo potencial teratogénico es conocido, por lo que es difícil que se puedan obtener nuevos datos.



