Glucarpidasa en toxicidad por metotrexato
 Nº472
Nº472
Resumen
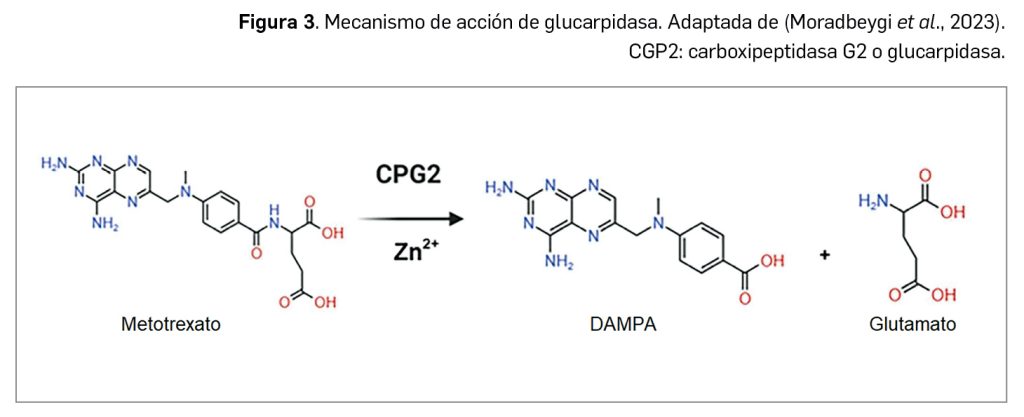
Glucarpidasa es un nuevo fármaco detoxificante para el tratamiento con metotrexato consistente en una enzima recombinante que cataliza la ruptura del carboxilo terminal (o extremo C-terminal) en residuos de glutamato procedentes del ácido fólico y sus análogos, incluyendo el metotrexato, produciendo derivados inactivos de tipo pteroato, como el ácido 2,4-diamino-N10-metilpteroico (DAMPA). En base a este mecanismo de acción, glucarpidasa ha sido autorizada en un medicamento designado como huérfano, con indicación en la reducción de la concentración tóxica de metotrexato plasmático en adultos y niños (de 28 días y mayores) con retraso en la eliminación de metotrexato o en riesgo de toxicidad por metotrexato.
La evidencia más robusta respecto a la eficacia clínica de glucarpidasa deriva de un metaanálisis de cuatro estudios de diseño abierto, multicéntrico, de un solo grupo y en un marco de uso compasivo en pacientes con disfunción renal y retraso en la eliminación de metotrexato tras recibir una dosis alta del fármaco para el tratamiento de distintos tipos de cáncer –con poblaciones heterogéneas en cuanto a sus características de sexo y edad entre los distintos estudios–. El objetivo principal de estos estudios fue determinar la proporción de pacientes que alcanzaba una RCI (reducción clínicamente importante) de la concentración plasmática de metotrexato (≤ 1 μmol/l). Los resultados revelan que esta RCI fue alcanzada por el 62 % de los pacientes para los que se dispone de una determinación de la concentración de metotrexato por HPLC, tras un tiempo mediano de 15 min desde la administración de glucarpidasa; la reducción mediana en ese punto fue de casi el 99 % de la concentración basal de metotrexato. Un análisis de sensibilidad confirmó que el efecto del fármaco es rápido, acusado y sostenido durante más de 24 h, aunque se observaron repuntes en cerca de un 20 % de los pacientes.
Si bien el tratamiento con glucarpidasa se asocia con una elevada frecuencia de eventos adversos (81 %), los datos relativos a la seguridad del fármaco no han arrojado aspectos de especial preocupación: la mayor parte de los eventos observados tras su infusión se corresponden con los derivados de la toxicidad propia del metotrexato, tales como estomatitis y náuseas (26 %), vómitos (25 %) o diarrea (16 %). No obstante, sí se han considerado relacionados con glucarpidasa otros como parestesia (2 %) y eventos similares, como hipoestesia, sensación de hormigueo o rubefacción, así como reacciones de hipersensibilidad, por lo general leves o moderadas.
Glucarpidasa es el primer fármaco autorizado con capacidad para reducir de manera profunda y rápida la concentración plasmática de metotrexato como consecuencia de un novedoso mecanismo de acción basado en la escisión del carboxilo terminal del fármaco, produciendo metabolitos inactivos. Sin embargo, este efecto no se produce a nivel intracelular, por lo que con frecuencia no desdeñable, de alrededor del 20 % de los pacientes, se producen repuntes en el nivel plasmático de metotrexato; también se debe tener en cuenta que el mecanismo de acción de glucarpidasa interfiere en el efecto de las alternativas más empleadas como rescate, la leucovorina y el levofolinato cálcico. Por tanto, aunque glucarpidasa aporta un beneficio clínico relevante para los pacientes en tratamiento con dosis altas de metotrexato, presenta limitaciones que reducen su impacto efectivo sobre la terapéutica estándar del manejo de la toxicidad asociada a este fármaco.
Aspectos fisiopatológicos
El ácido fólico es un compuesto esencial para la síntesis de ADN. La incapacidad del ser humano para sintetizar ácido fólico de novo dota a éste del carácter de vitamina y hace que se deba obtener obligatoriamente de la dieta. La forma biológicamente activa del ácido fólico es el tetrahidrofolato o ácido tetrahidrofólico (en adelante, THF), la cual se sintetiza a partir del ácido fólico obtenido de los alimentos: ese ácido fólico de la dieta sufre una primera reacción de reducción a ácido dihidrofólico (FH2) mediante la acción de la enzima dihidrofolato reductasa, la misma enzima que cataliza el siguiente paso reductor hasta el THF. En condiciones normales, el ácido fólico se encuentra almacenado en el citoplasma celular bajo la forma de poliglutamato, mientras que el ácido fólico funcional tiene solo un resto de ácido glutámico formando parte de la molécula.
La misión biológica fundamental del THF es participar en procesos donde es necesario aportar grupos metilo (–CH3), como ocurre en la síntesis de algunas bases nucleicas, un proceso crítico en numerosos tipos celulares de rápido crecimiento. En concreto, está implicado en la síntesis de dTMP (2’-deoxitimidina-5-fosfato) a partir de dUMP (2’-deoxiuridina-5-fosfato) (Figura 1); asimismo, facilita la activación biológica de la vitamina B12 encontrada en las fuentes naturales (cobalaminas), transformándola en sus formas coenzimáticas.
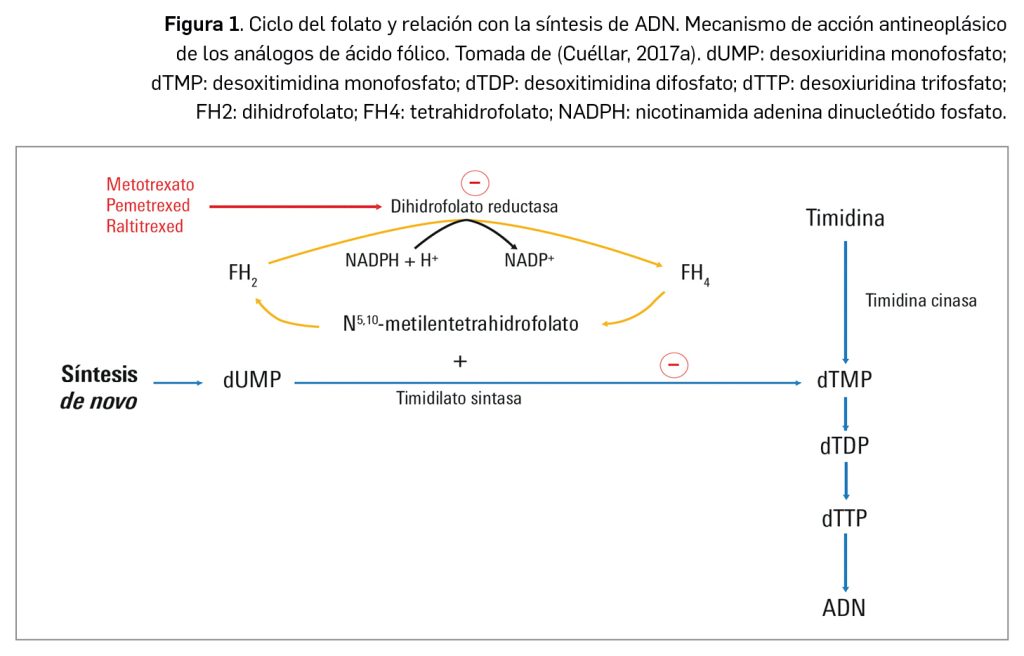
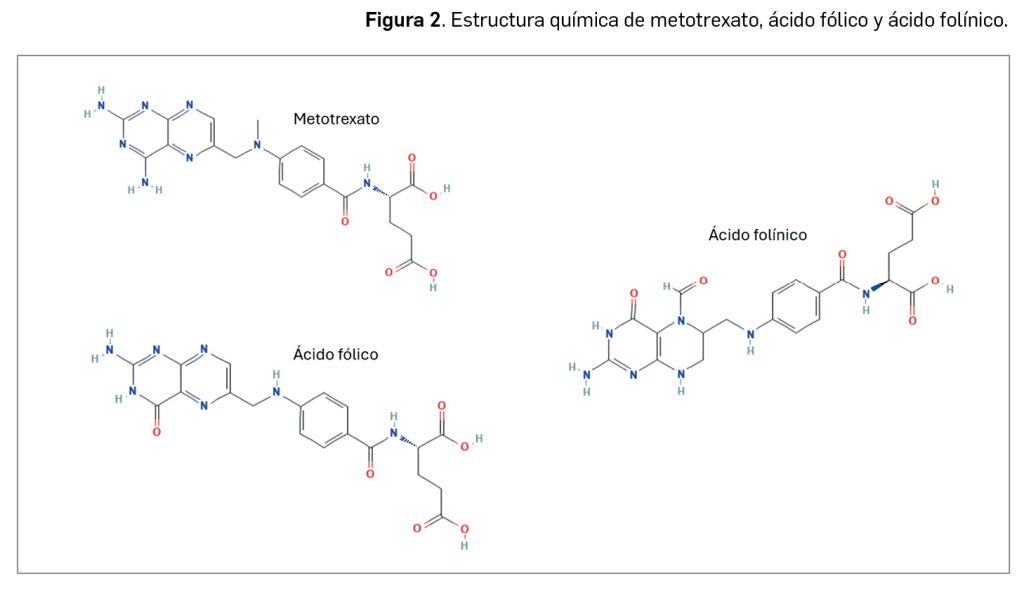
El metotrexato (Figura 2) es un análogo del ácido fólico que inhibe selectivamente la enzima dihidrofolato reductasa al competir con el dihidrofolato; de hecho, el metotrexato tiene más afinidad por la enzima que el propio sustrato natural. Presenta un grupo metilo (–CH3) anclado en el átomo N10, que es el principal responsable del efecto bloqueante de la dihidrofolato reductasa, al actuar como señuelo del auténtico FH2. El resultado es la formación de un complejo ternario estable entre metotrexato, la enzima y el NADPH, que actúa como cofactor de la reacción.
El efecto citotóxico del metotrexato está directamente relacionado con su concentración y el tiempo de exposición de las células tumorales al mismo. El objetivo del tratamiento con este fármaco es detener la proliferación celular de aquellos tejidos con tasas de división elevadas, una característica típicamente –aunque no exclusiva– de los tumores. Este tipo de antineoplásicos, denominados antimetabolitos1, se emplean preferentemente2 en cuadros neoplásicos caracterizados por una alta tasa de proliferación celular, particularmente de aquellos tipos celulares que duplican su material genético (en el proceso de división celular) por vía de la síntesis de novo de los nucleótidos. Esto ocurre especialmente en muchos de los cánceres hema-tológicos, como leucemias y linfomas.
Desde el punto de vista de su farmacocinética, el metotrexato presenta la particularidad de poder ser administrado por vía oral, aunque su biodisponibilidad por esta vía es variable y dependiente de la dosis; también puede administrarse por vía intramuscular, intratecal o intravenosa. La eliminación es mayoritariamente renal, lo que se relaciona con una las principales fuentes de efectos adversos asociados a su uso: la nefrotoxicidad, de ahí que sea tan importante mantener las condiciones de diuresis y pH de la orina adecuadas. Precisamente, la ausencia de un amplio metabolismo hepático determina una eliminación relativamente rápida (en caso de que no haya insuficiencia renal), con valores de semivida de eliminación que oscilan entre las 2 y las 7 horas.
El efecto antiproliferativo inespecífico del metotrexato se traduce, además, en numerosos efectos adversos sobre otros tejidos y órganos que fisiológicamente presentan altas tasas de reposición celular (epitelio digestivo, dermis y epidermis, órganos sexuales, células sanguíneas, etc.). De la misma manera que este mecanismo de acción determina que la mayoría las indicaciones terapéuticas de los antimetabolitos sean neoplasias hematológicas, el perfil de seguridad de la mayoría de estos productos se caracteriza por una importante toxicidad hematológica, principalmente mielotoxicidad, anemia y trombocitopenia. Asimismo, la administración intratecal de metotrexato incrementa el riesgo de cefalea, fiebre, vómitos, meningismos, parestesias o paresias, además de mielosupresión.
En la utilización crónica a dosis bajas por vía oral, lo más característico es la hepatotoxicidad, manifestada por una elevación de los valores de transaminasas y de bilirrubina y que, a largo plazo, puede acabar en cirrosis. La toxicidad pulmonar es excepcional, pero puede aparecer con cualquier vía de administración; no parece relacionada con la dosis y no se reduce con la administración de ácido folínico. La principal toxicidad diferida es el riesgo de una leucoencefalopatía necrotizante –sobre todo si se utiliza de manera simultánea la vía intravenosa, la intratecal y la radioterapia craneal– que puede llegar a producir una demencia progresiva, coma y la muerte del enfermo.
La administración a dosis altas por vía parenteral requiere una hidratación adecuada (desde 12 h antes de la infusión hasta 36 h después), alcalinización de la orina, monitorización de los niveles séricos de metotrexato y un rescate adecuado con ácido folínico desde 24 h después de la infusión hasta conseguir unos niveles séricos no tóxicos del metotrexato. La hidratación y la alcalinización son fundamentales para evitar la precipitación del metotrexato en el túbulo renal, que puede provocar una insuficiencia renal aguda.
Existe consenso en la comunidad científica en torno a la idea de que el rescate con ácido folínico reduce la toxicidad hematológica y digestiva de metotrexato, permitiendo la administración a dosis altas que, de otro modo, serían letales (Cuéllar, 2017b). Es preciso subsayar que los antimetabolitos del ácido fólico, como el metotrexato, son también antagonistas del ácido folínico y, en contrapartida, éste puede neutralizar los efectos de este tipo de antineoplásicos cuando se empleen en dosis elevadas o cuando la respuesta tóxica sea mayor de lo tolerable.
Actualmente se utilizan en con propósito de detoxificación de dosis altas de metotrexato el folinato cálcico o la leucovorina cálcica, que es una mezcla racémica de los estereoisómeros D– y L– del folinato: hay que subrayar que solo el L–folinato o levofolinato es el esteroisómero biológicamente activo, por lo que cuando se usa directamente levofolinato cálcico se requiere la mitad de la dosis que de leucovorina. Tanto la leucovorina como el levofolinato pueden usarse por vía intravenosa o por vía oral. El tratamiento de rescate frente a la toxicidad por metotrexato debe comenzar a las 24 h de su infusión y mantenerse hasta que los niveles en sangre del metotrexato sean indetectables. Estos fármacos son muy bien tolerados y sus efectos secundarios son excepcionales, habiéndose descrito con baja frecuencia alergia o fiebre posterior a la infusión.
Si bien la toxicidad asociada al uso de metotrexato se considera una condición rara en la Unión Europea, los tratamientos disponibles no son suficientes en todos los casos para reducir o controlar en magnitud suficiente los efectos tóxicos del fármaco, por lo que es deseable la llegada de nuevas herramientas farmacológicas que permitan un mejor abordaje.
Acción y mecanismo
Glucarpidasa es un nuevo fármaco detoxificante para el tratamiento con metotrexato consistente en una enzima bacteriana recombinante con actividad exopeptidasa dependiente de zinc, que cataliza la ruptura del carboxilo terminal (extremo C-terminal) en residuos de glutamato procedentes del ácido fólico y sus análogos, incluyendo el metotrexato (Figura 3), produciendo como subproducto de la reacción derivados inactivos de tipo pteroato, como el ácido 2,4-diamino-N10-metilpteroico (DAMPA). Con base en este mecanismo de acción, glucarpidasa ha sido autorizada, en un medicamento designado como huérfano, con indicación en la reducción de la concentración tóxica de metotrexato plasmático en adultos y niños (de 28 días y mayores) con retraso en la eliminación de metotrexato o en riesgo de toxicidad por metotrexato.
Conviene tener presente que, ya que tanto DAMPA como glutamato son metabolizados por el hígado, glucarpidasa proporciona una ruta alternativa para la eliminación de metotrexato en pacientes con disfunción renal durante tratamiento con altas dosis del fármaco. El mecanismo de acción de glucarpidasa implica también la inactivación del ácido folínico, así como de su metabolito activo 5-metiltetrahidrofolato, cuando se utiliza como tratamiento de rescate para evitar la toxicidad asociada a dosis altas de metotrexato, por lo que se debe espaciar la administración de ácido folínico en un intervalo de 2 h antes y después de administrar glucarpidasa.
Aspectos moleculares
Como se ha avanzado en el apartado anterior, glucarpidasa es una enzima recombinante de origen bacteriano con actividad exopeptidasa dependiente de zinc que hidroliza el grupo C-terminal en residuos de glutamato procedentes del ácido fólico, derivados y análogos como el metotrexato.
La enzima está compuesta por una secuencia de 390 residuos de aminoácidos, con un peso de aproximadamente 41,4 KDa para la forma monomérica, cuya fórmula molecular es C1950H3157N543O599S7. Debido a su gran tamaño molecular, no atraviesa la membrana celular y, por tanto, no contrarresta los efectos antineoplásicos intracelulares de metotrexato.
Cada vial del medicamento contiene una cantidad nominal de 1000 unidades de glucarpidasa, producida en células de Escherichia coli mediante tecnología de ADN recombinante.
Eficacia y seguridad clínicas
Su eficacia y la seguridad han sido evaluadas en cuatro estudios de diseño abierto, multicéntrico, de un solo grupo y en un marco de uso compasivo en pacientes con disfunción renal y retraso en la eliminación de metotrexato tras recibir una dosis alta del fármaco3. El objetivo principal de todos ellos fue determinar la proporción de pacientes que alcanzaba una concentración plasmática de metotrexato ≤ 1 μmol/l (reducción clínicamente importante, en adelante RCI).
La evidencia más robusta disponible respecto a la eficacia de glucarpidasa procede de un metaanálisis de estos cuatro estudios presentado en el EPAR del medicamento (EMA, 2022), con datos de 476 pacientes que recibieron al menos una dosis del fármaco. De ellos, 169 pacientes constituyeron la llamada población HPLC, por disponerse del dato de concentración plasmática de metotrexato obtenido por cromatografía líquida de alta eficacia (HPLC son las siglas en inglés de esta técnica), considerado como gold standard para esta determinación.
A nivel sociodemográfico y respecto a las características basales de los pacientes se observan ciertas diferencias entre los cuatro estudios que pudieron condicionar los niveles plasmáticos basales de metotrexato. Por ejemplo, esos niveles antes de la administración de glucarpidasa eran mayores en los pacientes jóvenes debido a que la prevalencia de osteosarcoma era mayor en este grupo de edad, y las dosis de metotrexato administradas como tratamiento también fueron mayores; además, los pacientes con disfunción renal y/o hepática presentaron de media niveles de metotrexato basales más altos. En cuanto al uso del fármaco, la dosis mediana de glucarpidasa solo varió ligeramente entre los distintos estudios (49,5-50,0 U/kg), aunque con un rango total de entre 9,8 y 100,0 U/kg. El intervalo de tiempo mediano entre la administración de metotrexato y la primera dosis de glucarpidasa fue de 3 días, y el 70 % de los pacientes de la población HPLC recibió una única dosis, el 27 % recibió 2 dosis y el 3 % recibió 3 dosis.
Los resultados revelan que el 61,5 % de los pacientes de la población HPLC alcanzó una RCI del nivel de metotrexato tras un tiempo mediano de 15 min tras la administración de glucarpidasa (cuando la reducción mediana de la concentración de metotrexato era del 98,8 % en los pacientes respondedores4), aunque con importantes diferencias entre los estudios: la tasa de RCI alcanzó el 85,7 % (IC95 % 68,5-94,3 %) en el estudio 001, el 54,8 % (IC95 % 44,2-65,0 %) en el estudio 002, el 66,7 % (IC95 % 48,8-80,8 %) en el estudio 003, y el 51,9 % (IC95 % 34,0-69,3 %) en el estudio 006 (AEMPS, 2024).
Adicionalmente, se llevó a cabo un análisis de sensibilidad más restrictivo con los datos de los pacientes a quienes se les hubiera determinado la concentración de metotrexato tanto hasta 2 h después de la primera dosis de glucarpidasa como al menos 24 h después de esta dosis. Este análisis confirmó el efecto inmediato y sostenido del fármaco, con un 56,0 % de pacientes que alcanzaron una RCI. También se analizaron los repuntes5 en la concentración de metotrexato, detectados en el 19,4 % de la población HPLC tras un tiempo mediano de 64 h; en el 59 % de los pacientes que experimentaron un repunte, éste fue de ≤ 2 μmol/l.
De cara a analizar el perfil toxicológico de glucarpidasa, se dispone de datos de 489 pacientes que recibieron al menos una dosis y en los cuales se realizó un seguimiento mediano de 20 días (población principal de seguridad); de ellos, el 75 % de los pacientes recibió una única dosis, el 23 % recibió dos dosis y el 2 % recibió tres dosis. La mayor parte de los pacientes tratados con el nuevo fármaco experimentó al menos un evento adverso (81 %), y casi un tercio (31 %) reportó al menos un evento adverso grave, correspondiendo la mayoría con efectos adversos conocidos al emplear dosis altas de metotrexato, tales como estomatitis y náuseas (26 % cada uno), vómitos (25 %), diarrea (16 %) e incremento de creatinina en sangre (10 %). Entre los graves, los más frecuentes fueron los trastornos de tipo renal (6 %), estomatitis (4 %) y recuento anormal de neutrófilos (3 %).
Cabe destacar que solo el 11 % de los pacientes notificó algún evento que se consideró relacionado con la administración de glucarpidasa, de los cuales los más comunes fueron parestesia (2,0 %) o eventos similares, como hipoestesia, sensación de hormigueo en la piel o sensación de calor, todos ellos con una frecuencia inferior al 1 % de los pacientes. También se observaron reacciones de hipersensibilidad de tipo I (2,6 %) y de tipo III (1,2 %), como rubefacción, eritema, dermatitis alérgica o rash, por lo general de intensidad leve o moderada; los considerados graves –hipertensión e hipersensibilidad– tuvieron una frecuencia inferior al 2 %. Por otro lado, la inmunogenicidad6 del fármaco no parece afectar a su seguridad.
En la población de seguridad se registraron 74 fallecimientos (15 %), de los cuales 39 ocurrieron durante los 30 primeros días post-administración del fármaco, sin diferencias entre los que recibieron una o dos dosis.
Aspectos innovadores
Glucarpidasa es un nuevo fármaco detoxificante para el tratamiento con metotrexato consistente en una enzima recombinante que cataliza la ruptura del carboxilo terminal (o extremo C-terminal) en residuos de glutamato procedentes del ácido fólico y sus análogos, incluyendo el metotrexato, produciendo derivados inactivos de tipo pteroato, como el ácido 2,4-diamino-N10-metilpteroico (DAMPA). El medicamento, designado como huérfano, ha sido autorizado para su uso hospitalario por vía intravenosa con indicación en la reducción de la concentración tóxica de metotrexato plasmático en adultos y niños (de 28 días y mayores) que presentan retraso en la eliminación de metotrexato o en riesgo de toxicidad por metotrexato.
La evidencia de eficacia que ha sustentado su aprobación en la UE deriva de un metaanálisis de cuatro estudios de diseño abierto, multicéntrico, de un solo grupo y en un marco de uso compasivo7 en pacientes con disfunción renal y retraso en la eliminación de metotrexato tras recibir una dosis alta del fármaco para el tratamiento de distintos tipos de cáncer, con poblaciones heterogéneas en cuanto a sus características de sexo y edad entre los distintos estudios.
Se observó que la infusión de glucarpidasa permitió que un 62 % de los pacientes de los que se había medido el dato de concentración plasmática de metotrexato por HPLC alcanzara una RCI –reducción clínicamente importante, variable principal– de esos niveles (≤ 1 μmol/l) tras una mediana de 15 min desde la administración; el descenso de la concentración de metotrexato alcanzó casi el 99 % respecto a la basal. Un análisis de sensibilidad confirmó que el efecto de glucarpidasa es rápido, acusado y sostenido durante más de 24 h. Pese a que se pueden ver repuntes de los niveles de metotrexato en cerca de un 20 % de los pacientes, esos repuntes son esperables por las características farmacocinéticas del metotrexato y fueron por lo general de pequeña magnitud (más de la mitad de < 2 μmol/l y solo en un paciente fue de > 10 μmol/l).
Con respecto a la seguridad, aunque el tratamiento con glucarpidasa se asocia con una elevada frecuencia de eventos adversos (81 %), los datos disponibles no arrojan aspectos de especial preocupación, teniendo en cuenta que la mayor parte de los eventos observados tras su administración se corresponden con los derivados de la toxicidad propia del metotrexato, tales como estomatitis y náuseas (26 %), vómitos (25 %) o diarrea (16 %).
No obstante, sí se han considerado relacionados con glucarpidasa otros como parestesia (2 %) y eventos similares, como hipoestesia, sensación de hormigueo o rubefacción, así como reacciones de hipersensibilidad, por lo general leves o moderadas, por lo que todo apunta a un perfil toxicológico aceptable y manejable para el nuevo fármaco.
A la vista de todo lo anterior, se acepta que la capacidad de glucarpidasa de reducir de manera rápida y sustancial la concentración de metotrexato es de importante relevancia clínica si se tienen en consideración los efectos tóxicos de este fármaco, que se asocian en buena medida tanto a la magnitud como a la duración de la exposición y pueden llegar a poner en riesgo la vida del paciente cuando se emplea en dosis altas. Por su mecanismo de acción, glucarpidasa puede superar las limitaciones propias del mecanismo de acción de las alternativas de rescate hasta ahora disponibles –leucovorina y levofolinato cálcico–, los cuales, aunque reducen la toxicidad asociada a ciertos órganos, especialmente la toxicidad hematológica, no siempre resultan efectivas para prevenir los efectos nocivos sobre otros órganos y tejidos, como el aparato digestivo o el riñón.
En cualquier caso, tanto leucovorina como levofolinato se consideran actualmente como tratamiento de elección para reducir la toxicidad asociada a dosis altas de metotrexato y el propio mecanismo de glucarpidasa puede interferir en la eficacia de estos fármacos al metabolizarlos de modo similar a metotrexato, por lo que no pueden ser utilizados de manera simultánea en un mismo paciente.
En definitiva, glucarpidasa es el primer fármaco autorizado con capacidad para reducir de manera profunda y rápida la concentración plasmática de metotrexato como consecuencia de un novedoso mecanismo de acción basado en la escisión de la molécula de metotrexato. Sin embargo, este efecto no se produce a nivel intracelular (por su gran tamaño molecular no atraviesa las membranas celulares), lo cual es a la vez una ventaja y un inconveniente: no contrarresta los efectos antineoplásicos intracelulares de metotrexato, pero, en una proporción no desdeñable de pacientes (alrededor del 20 %) se pueden producir repuntes de sus niveles plasmáticos. Habida cuenta de que no se puede emplear de forma concomita a las opciones más usadas en el rescate ante niveles potencialmente tóxicos de metotrexato (leucovorina y levofolinato cálcico), el beneficio clínico que aporta para los pacientes en tratamiento con dosis altas de metotrexato (de especial interés en casos de insuficiencia renal) presenta limitaciones que pueden reducir su impacto efectivo sobre la terapéutica estándar del manejo de la toxicidad asociada a este fármaco.

Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica de Voraxaze® (glucarpidasa). 2024. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1211586001/FT_1211586001.html.
-
- Cuéllar Rodríguez S. Antineoplásicos antimetabolitos. En: Trastornos oncológicos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2017a. p. 61-78.
-
- Cuéllar Rodríguez S. Otros fármacos empleados en el tratamiento y diagnóstico del cáncer. En: Trastornos oncológicos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2017b. p. 177-218.
-
- European Medicines Agency (EMA). Voraxaze®. European Public Assessment Report (EPAR). 2022. EMA/CHMP/751047/2021. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/voraxaze-epar-public-assessment-report_en.pdf.
-
- Moradbeygi F, Ghasemi Y, Farmani AR, Hemmati S. Glucarpidase (carboxypeptidase G2): Biotechnological production, clinical application as a methotrexate antidote, and placement in targeted cancer therapy. Biomed Pharmacother. 2023; 166: 115292. DOI: 10.1016/j.biopha.2023.115292.
1 Los antimetabolitos antineoplásicos son fármacos de estructura similar a la de los componentes del metabolismo intermedio celular, cuyo uso por la célula produce alteraciones en el normal proceso de síntesis de ácidos nucleicos, provocando un bloqueo de esos procesos esenciales hasta un grado en que el deterioro de la maquinaria celular conlleva a su apoptosis. Estos compuestos ejercen su acción sobre la fase S del ciclo celular y, especialmente, sobre células con una alta tasa de proliferación, como las hematológicas.
2 Por su acción especialmente marcada sobre los leucocitos, algunos de estos antimetabolitos de bases nucleicas están también indicados en cuadros patológicos de tipo autoinmune (artritis reumatoide, lupus sistémico, etc.) o en trasplante de órganos o de tejidos, como preventivo de las reacciones de rechazo del órgano/tejido trasplantado o como preparación –eliminación de los clones neoplásicos– antes del trasplante de médula ósea.
3 En el estudio 001 se incluyó a pacientes de 18 años o mayores con leucemia linfoblástica aguda, linfoma no Hodgkin o tumores sólidos tratados con metotrexato. En los estudios 002 y 003 participaron pacientes oncológicos de cualquier edad en tratamiento con metotrexato. Y en el estudio 006 se incluyeron pacientes de cualquier edad con osteosarcoma u otro tipo de tumor tratados con metotrexato.
4 Durante los 3 días siguientes a la administración de glucarpidasa se observó un ligero incremento de la concentración de metotrexato, explicable dadas las características farmacocinéticas del fármaco.
5 Definidos como un incremento > 1 μmol/l de la concentración de metotrexato y al menos dos veces superior al nadir posglucarpidasa.
6 Se dispone de datos relativos a la presencia de anticuerpos anti-glucarpidasa en 205 pacientes, con datos positivos en 43 (21,0 %). En 22 de ellos se detectó la presencia de anticuerpos neutralizantes (11 %). La incidencia de eventos adversos fue similar en pacientes sin anticuerpos anti-glucarpidasa (59,7 %) y con anticuerpos (62,5 %).
7 El diseño de los estudios en los que se ha evaluado la eficacia de glucarpidasa presenta limitaciones que han condicionado su autorización en circunstancias excepcionales. Aunque los datos disponibles de eficacia y seguridad son indicativos de un balance beneficio-riego positivo, estos pueden considerarse parciales, por lo que se requiere de estudios clínicos prospectivos con un diseño optimizado (doble o triple ciego, controlados y aleatorizados), que ofrezcan un mayor grado de evidencia.



