Tezepelumab en asma grave
 Nº471
Nº471
Resumen
Tezepelumab es un nuevo anticuerpo monoclonal de tipo IgG2λ dirigido de manera específica a la linfopoyetina estromal tímica (TSLP), impidiendo que ésta interaccione con su receptor heterodimérico (TSLPR): ese bloqueo evita que la TSLP ejerza sus acciones fisiológicas, entre las que se encuentran la inducción de inflamación asociada a una reacción alérgica por activación de los mastocitos y la inducción de la liberación de quimiocinas por los monocitos. En base ello, tezepelumab ha sido autorizado con indicación en el tratamiento de mantenimiento adicional –por vía subcutánea y periodicidad mensual– en adultos y adolescentes a partir de 12 años con asma grave que no están adecuadamente controlados a pesar de la administración de corticosteroides inhalados a dosis altas en combinación con otro medicamento para el tratamiento de mantenimiento.
Su eficacia clínica como tratamiento de la exacerbación del asma fue evaluada en un único estudio pivotal de fase 3 y adecuado diseño (aleatorizado, doble ciego, controlado con placebo), de 52 semanas de duración, donde demostró una superioridad estadística sobre placebo en la reducción de la frecuencia anualizada de ataques graves de asma (variable primaria), que fue del 56% (RR: 0,44; p< 0,001). El beneficio fue mayor en los pacientes con niveles basales > 300 eosinófilos/μl (70% vs. 41% con niveles inferiores) y, entre las principales variables secundarias, el fármaco también fue mejor que placebo en el cambio respecto al nivel basal de la puntuación en distintos cuestionarios relativos al manejo de la enfermedad. Sin embargo, los hallazgos de otro estudio multicéntrico de fase 3 y parecido diseño, en que se evaluó la eficacia del fármaco en la reducción de la dosis necesaria de corticoides orales, ponen de manifiesto que la diferencia entre tezepelumab y placebo no fue estadísticamente significativa (OR: 1,28; p= 0,434), pese a la tendencia numéricamente favorable.
Por otro lado, su perfil de seguridad parece aceptable, siendo la mayor parte de los eventos detectados de intensidad leve o moderada y clínicamente manejables. Un análisis agrupado de los eventos adversos de los estudios con tezepelumab en la pauta aprobada reveló una incidencia de eventos adversos ligeramente inferior en comparación con placebo (75% vs. 77%), siendo los más comunes con el nuevo fármaco: nasofaringitis (20% vs. 19%), infecciones del tracto respiratorio superior (9% vs. 13%), dolor de cabeza (8% en ambos grupos) y asma (7% vs. 16%). Se debe tener presente que la disponibilidad de datos tras un periodo de uso prolongado (> 1 año) es muy limitada, por lo que los estudios poscomercialización deberán analizar algunos riesgos potenciales como los eventos cardiacos y el riesgo de neoplasias.
En definitiva, tezepelumab cuenta con un novedoso mecanismo de acción que, además de asociarse con un positivo perfil de eficacia en la reducción del riesgo de ataques graves de asma y con un perfil de seguridad aparentemente benigno, permite tratar potencialmente a cualquier paciente con asma grave, con independencia de las características fenotípicas de su enfermedad. Por tanto, se posicionará como una innovadora alternativa para los pacientes con asma grave e inadecuada respuesta a otros tratamientos de mantenimiento con indicaciones limitadas a determinados supuestos clínicos, como inflamación de tipo 2 (dupilumab) o eosinofilia (benralizumab y mepolizumab).
Aspectos fisiopatológicos
La versión 5.3 de la Guía Española para el Manejo del Asma1 define el asma como una enfermedad inflamatoria crónica de las vías respiratorias, en cuya patogenia intervienen diversas células y mediadores de la inflamación, condicionada en parte por factores genéticos y que cursa con hiperreactividad bronquial y una obstrucción variable al flujo aéreo, total o parcialmente reversible, ya sea por la acción medicamentosa o espontáneamente (GEMA, 2023). Esa reversibilidad de las manifestaciones es precisamente la principal característica diferencial con otras enfermedades crónicas del sistema respiratorio, como la enfermedad pulmonar obstructiva crónica (EPOC).
Se trata de un problema de salud de elevada prevalencia y, aunque las formas graves de la enfermedad solo suponen el 10% de todos los casos, tiene importantes implicaciones en la esperanza y calidad de vida de las personas afectadas, generando un importante consumo de recursos sanitarios y notables costes sociales. Según la OMS, el asma es la séptima enfermedad más prevalente en el mundo, con cerca de 235 millones de afectados; la cifra de afectados en Europa ronda los 29 millones. Además, supone la quinta causa de muerte en países desarrollados. En España, la prevalencia de síntomas asmáticos se ha mantenido constante en los niños de 13-14 años, mientras que ha sufrido un aumento significativo en el grupo de 6-7 años. En adultos, la prevalencia es inferior a la de países anglosajones y centroeuropeos: se estima que en nuestro país sufren asma aproximadamente el 5% de los adultos y el 10% de niños.
El asma en adultos suele clasificarse, según la gravedad, en cuatro categorías: intermitente, persistente leve, persistente moderada y persistente grave. En los niños se definen dos patrones principales: asma episódica (ocasional o frecuente) y asma persistente (este último siempre considerado como grave). En todos los casos, las manifestaciones clínicas características del asma son: i) obstrucción bronquial reversible, manifestada como episodios recurrentes de disnea, sibilancias, opresión torácica y tos (sobre todo, de noche o de madrugada), que responden a la medicación broncodilatadora; ii) inflamación, por infiltración de la mucosa por eosinófilos activados, descamación de células epiteliales y engrosamiento de la membrana basal por incremento de los depósitos de colágeno y fibronectina; e iii) hiperreactividad bronquial, que se traduce en broncoconstricción, hipersecreción de moco, tos y vasodilatación con extravasación (y el consecuente edema con mayor infiltración de células inflamatorias).
En realidad, el asma no es una enfermedad única, sino un síndrome que comparte manifestaciones similares en apariencia, pero ligadas a diversos mecanismos celulares y biomoleculares. Ha pasado de ser considerada una reacción de hipersensibilidad de tipo I (broncoespasmo desencadenado por la liberación de mediadores tras la desgranulación del mastocito al producirse la reacción alérgeno-IgE específica) a ser interpretada en la actualidad como un proceso inflamatorio crónico de las vías aéreas puesto en marcha por una serie de fac-tores desencadenantes entre los destacan determinadas actividades profesionales, ejercicio físico, infecciones, fármacos (betabloqueantes y AINE, en particular el ácido acetilsalicílico), reflujo gastroesofágico y ciertos factores emocionales.
Sin embargo, con mucho, el factor más frecuentemente desencadenante del asma es la alergia y los alérgenos más comúnmente involucrados en su patogénesis son proteínas de los reinos animal y vegetal, como los procedentes de los ácaros (Dermatophagoides pteronyssinus y D. farinae), los de pólenes (gramíneas), los de árboles (Corylus avellana, Olea sp.), de hongos (Alternaria sp., Aspergillus sp.) o de animales (epitelios y fluidos de gato, perro, etc.).
El asma alérgico comienza con la sensibilización: en individuos con predisposición genética y ante determinadas condiciones ambientales (infección viral, humo de tabaco, etc.), se produce la interacción del antígeno con las células dendríticas y la posterior activación de linfocitos T, que generan citocinas inductoras de la diferenciación y activación de eosinófilos (IL-5), de la expresión de receptores de la IgE en mastocitos y eosinófilos (IL-4), de la expresión en el epitelio de receptores que atraen a los eosinófilos (IL-4) y de la producción y liberación de IgE por células B. Una reexposición al alérgeno produce un episodio agudo o ataque de asma, que generalmente consiste en 2 fases: i) la fase inmediata se caracteriza por la aparición de un espasmo en el músculo liso bronquial como consecuencia de la interacción del antígeno con el mastocito que había expresado y fijado la IgE a sus receptores en la sensibilización, liberando principalmente histamina y leucotrienos C4 y D4 (LTC4 y LTD4), responsables del broncoespasmo; también se liberan otros mediadores (prostaglandina D2, neurocinina A, LTB4) que provocan una migración de células inflamatorias –eosinófilos y monocitos– hacia esa zona anatómica; ii) la fase tardía o respuesta diferida ocurre en un tiempo variable desde la exposición inicial al antígeno (6-8 horas), suele ser nocturna, y es claramente la progresión de una reacción inflamatoria iniciada en la primera fase que conlleva un acúmulo local de eosinófilos; se piensa que los gránulos de los eosinófilos infiltrantes liberan mediadores citotóxicos que afectan al epitelio respiratorio ciliado (Figura 1). En resumen, las principales células inflamatorias implicadas en el asma son los eosinófilos, los linfocitos T y los mastocitos.
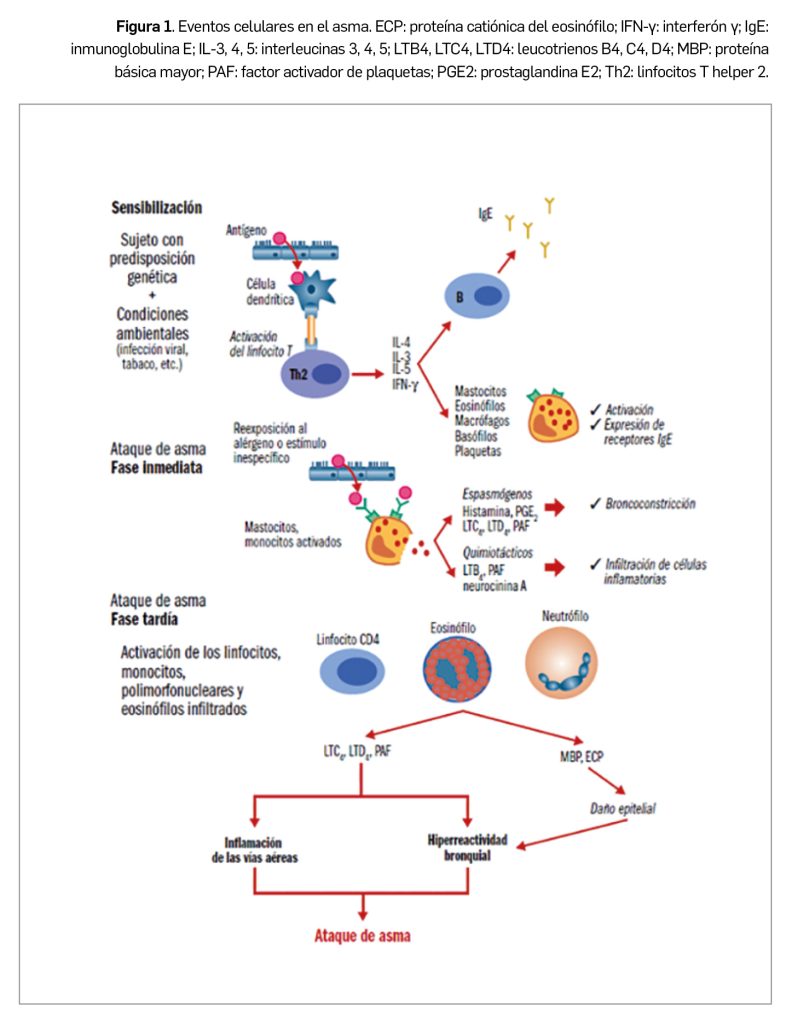
En el ataque de asma se produce un desacoplamiento en la relación ventilación-perfusión con un aumento del gradiente alveolo-arterial de oxígeno, lo cual implica la disminución de la presión parcial de O2 en sangre y, si la ventilación alveolar no aumenta lo suficiente (el trabajo respiratorio no compensa el aumento de la resistencia y la carga elástica pulmonar ni la menor eficiencia contráctil del diafragma), un aumento de la presión parcial de CO2. En suma, la hipoxemia suele ser moderada y responde favorablemente al aumento de la concentración de oxígeno inspirado. La intensidad de las exacerbaciones es variable, cursando en ocasiones con síntomas leves e indetectables por el paciente y en otras con episodios muy graves que ponen en peligro su vida.
Por la relación existente entre el asma y la atopia, se ha descrito que hasta el 35% de las personas con asma grave sufren dermatitis atópica y hasta la mitad de los afectados de DA padecen asma. Ambas patologías se engloban dentro de las llamadas enfermedades mediadas por inflamación tipo 2. Durante muchos años el asma fue considerada como una patología mediada por una respuesta inmunitaria adaptativa, pero cada vez hay más pruebas de que la inmunidad innata también ejerce un rol importante en las distintas vías implicadas en la fisiopatología de la enfermedad.
Las respuestas inflamatorias tipo 2 en el asma –predominantes en la mayoría de casos– son iniciadas por citocinas como la IL-25, IL-33 o TSLP, llamadas alarminas, secretadas tras la exposición a contaminantes, infecciones o alérgenos. Concretamente, TSLP es una citocina con capacidad para activar a los mastocitos y que promueve la liberación de quimiocinas procedentes de los monocitos que inducen el reclutamiento de células T.
Esas citocinas activan a las células presentadoras de antígenos (dendríticas y NK) para inducir la respuesta inmunitaria adaptativa Th2. Una vez activas, las células Th2 migran hacia el epitelio y la mucosa subepitelial de la vía aérea, donde secretan las citocinas tipo 2, IL-5 e IL-13, que ejercen un papel crucial en la patogénesis y el desarrollo de muchas características de la enfermedad. Además, las alarminas también activan directamente a las células linfoides innatas pulmonares tipo 2 (CLI-2) para que secreten una gran cantidad de IL-5 e IL-13. Una vez estimuladas, esas CLI-2 pulmonares producen pequeñas cantidades de IL-4, aunque no está claro si esto representa una interacción entre los mecanismos inmunitarios innatos y adaptativos.
En consecuencia, las citocinas tipo 2 promueven el reclutamiento de células efectoras (mastocitos, basófilos y eosinófilos) y median la producción de IgE por las células B, un aumento de los niveles de FeNO (fracción exhalada de óxido nítrico) y un incremento de los niveles séricos de periostina. La inflamación eosinofílica en las vías aéreas y la síntesis de IgE son, pues, eventos centrales en el asma tipo 2 y en la patogénesis de las exacerbaciones (Robinson et al., 2017).
Con respecto al tratamiento del asma, su objetivo principal es alcanzar y mantener el control de la enfermedad lo antes posible, además de prevenir las exacerbaciones2 y la obstrucción crónica al flujo aéreo, para reducir al máximo su mortalidad.
No obstante, la finalidad inmediata del tratamiento de una crisis es preservar la vida del paciente revirtiendo la obstrucción al flujo aéreo y la hipoxemia (si está presente) de la forma más rápida posible, y posteriormente instaurar o revisar el plan terapéutico para prevenir nuevas crisis. El tratamiento en la exacerbación leve debe incluir la administración de broncodilatadores agonistas β2-adrenérgicos de acción corta (SABA), glucocorticoides orales y oxígeno (si es necesario). Los SABA inhalados son los fármacos broncodilatadores más eficaces y rápidos en el tratamiento de la crisis asmática. Si en las primeras 2 h se constata una evolución favorable (desaparición de síntomas, volumen espiratorio forzado en el primer segundo o VEF1 > 80% del teórico o del mejor valor personal del paciente) y ésta se mantiene durante 3-4 h, no son necesarios más tratamientos. Pero en pacientes no controlados con combinaciones inhaladas de corticosteroides y SABA administradas a demanda, puede recurrirse a combinaciones similares con agonistas β2 de acción prolongada (LABA), como salmeterol, formoterol, vilanterol, etc.
En el tratamiento de mantenimiento a largo plazo del asma se distinguen varios escalones terapéuticos de complejidad creciente, que deben individualizarse en base a la respuesta y el nivel de control que manifieste el paciente, siendo necesaria una evaluación clínica periódica para determinar si se cumplen los objetivos clínicos. En todos los escalones de tratamiento, los corticosteroides inhalados (CSI) son de elección para el control a largo plazo del asma, a dosis crecientes según la gravedad del cuadro asmático, y empleándose junto con un LABA en los casos más graves. Además, a estos puede asociarse tiotropio (anticolinérgico) y/o un antagonista de los receptores de leucotrienos (montelukast) y/o administrar corticosteroides orales (CSO) si la gravedad de la patología así lo recomienda. En todos los escalones se pueden administrar a demanda agonistas β2-adrenérgicos de acción corta.
El uso de glucocorticoides sistémicos (CSO) acelera la resolución de las exacerbaciones. Excepto en crisis muy leves, deben administrarse siempre, especialmente si: a) no se consigue una reversión de la obstrucción de las vías respiratorias con SABA; b) el paciente estaba tomando ya CSO; c) el paciente no controlado ha probado sin éxito otras opciones terapéuticas; d) existen antecedentes de exacerbaciones previas que requirieron CSO.
Aunque son moderadamente eficaces para el control de la mayoría de los casos de enfermedad moderada-grave, es importante señalar que el uso prolongado de corticoides sistémicos suele asociarse con efectos adversos en diversos órganos, en ocasiones severos, por lo que existe una necesidad de desarrollar tratamientos que puedan emplearse con anterioridad en pacientes cuya patología no es tan grave como para requerir corticoterapia sistémica, previniendo los riesgos de ésta.
En esa línea, los anticuerpos monoclonales han abierto recientemente un importante capítulo en el tratamiento de mantenimiento del asma grave. Básicamente, los fármacos biológicos ya autorizados contemplan las siguientes vías inmunofarmacológicas:
- El bloqueo de la producción o actividad de la IL-5 (que también juega un papel relevante en la inflamación de tipo 2, sobre todo promoviendo la liberación de eosinófilos desde la médula ósea): benralizumab, mepolizumab y reslizumab. Están autorizados como tratamiento adicional en pacientes adultos con asma grave no controlada eosinofílica.
- Impedir la unión de la IgE a sus receptores en los mastocitos y basófilos (inhibiendo la reacción de hipersensibilidad y la cascada inflamatoria): omalizumab. Ha sido autorizado como tratamiento adicional en asma alérgica persistente grave mediada por IgE.
-Bloqueo de la señalización molecular mediada por la interacción entre la IL-4 y su receptor de tipo I (IL-4Rα/γc) y la señalización de IL-4 e IL-13 a través del receptor de tipo II (IL-4Rα/IL-13Rα): dupilumab. Se encuentra autorizado con indicación en el tratamiento de mantenimiento del asma grave con inflamación de tipo 2 con eosinofilia y/o FeNO elevada3.
Es preciso recordar que el asma grave no controlada se define como aquella que persiste mal controlada4 a pesar de recibir tratamiento con una combinación de CSI a dosis elevadas junto con un LABA en el último año, o bien CSO durante al menos 6 meses del mismo periodo. En nuestro medio, la prevalencia de pacientes con asma grave no controlada es aproximadamente del 4% del total de la población asmática (algunos autores hablan de falta de control en hasta el 45% de pacientes con asma grave). Entre ellos, el asma eosinofílica –caracterizada por la presencia de altos niveles de eosinófilos en biopsias bronquiales y esputo a pesar de dosis altas de corticosteroides– representa aproximadamente el 25% de los casos (y el 40-60% de todos los casos de asma).
Finalmente, la inmunoterapia con alérgenos específicos es un tratamiento de mantenimiento indicado en el asma alérgica bien controlada, siempre que se haya demostrado una sensibilización mediada por la Ig E frente a aeroalérgenos comunes, y se utilicen extractos bien estandarizados.
Acción y mecanismo
Tezepelumab es un nuevo anticuerpo monoclonal de tipo IgG2λ dirigido de manera específica a la linfopoyetina estromal tímica (TSLP), impidiendo que esta alarmina interaccione con su receptor heterodimérico (TSLPR). El bloqueo de la TSLP por parte de tezepelumab impide que ésta ejerza sus acciones, entre las que se encuentran la inducción de inflamación asociada a una reacción alérgica por activación de los mastocitos y la inducción de la liberación de quimiocinas por parte de los monocitos. En base a este mecanismo, tezepelumab ha sido autorizado en la UE con indicación en el tratamiento de mantenimiento adicional, en una inyección por vía subcutánea cada 4 semanas, en adultos y adolescentes a partir de 12 años con asma grave que no están adecuadamente controlados a pesar de la administración de corticosteroides inhalados a dosis altas en combinación con otro medicamento para el tratamiento de mantenimiento.
La elevada afinidad de tezepelumab por la TSLP se ha podido comprobar en estudios in vitro, en los que la afinidad por la TSLP humana estuvo en el rango sub-nanomolar (KD = 15,8 pM).
Aspectos moleculares
Tezepelumab es un nuevo anticuerpo monoclonal humano de tipo IgG2λ que bloquea específicamente la TSLP, impidiendo que ésta se una a su receptor (TSLPR). Se produce en línea celular de ovario de hámster chino (CHO) mediante la tecnología del ADN recombinante. Su peso molecular es de aproximadamente 147 KDa (144 KDa para la molécula sin glicosilar).
Eficacia y seguridad clínicas
La eficacia y la seguridad clínicas de tezepelumab como tratamiento de mantenimiento en la prevención de la exacerbación del asma han sido evaluadas en dos ensayos clínicos, de los cuales se consideró pivotal un estudio de fase 3, aleatorizado (1:1), doble ciego, controlado con placebo en el que el fármaco (dosis de 210 mg) se administró por vía subcutánea cada 4 semanas a 1061 pacientes con asma grave no adecuadamente controlado durante un periodo total de tratamiento de 52 semanas (estudio NAVIGATOR). El objetivo principal fue la eficacia del nuevo fármaco en términos del cambio en la tasa anualizada de ataques de asma respecto a placebo, mientras que entre los objetivos secundarios clave se consideraron el cambio respecto al periodo basal en la VEF1 antes de administrar un broncodilatador, y el cambio en la puntuación de los cuestionarios validados AQLQ(S)+125, ACQ-66 y Asthma Symptom Diary7 (ASD).
Los pacientes incluidos debían tener entre 12 y 80 años, un historial de asma de al menos 1 año, con un tratamiento establecido durante > 3 meses de una dosis media o alta de un corticoide inhalado (equivalente a ≥ 500 μg de propionato de fluticasona) y al menos otro tratamiento adicional de mantenimiento (por ejemplo, un LABA, un antagonista del receptor de leucotrienos o teofilina). Se excluyeron pacientes con otras enfermedades pulmonares de importancia, como EPOC o fibrosis quística, y con otras enfermedades graves no controladas. Sus características demográficas y clínicas basales estuvieron adecuadamente distribuidas entre los dos grupos de tratamiento: destaca una edad media de 49,5 años, una mayoría de mujeres (64%) y de raza blanca (62%), así como un valor de VEF1 antes de administrar un broncodilatador (pre-BD VEF1) similar en ambos grupos: 1830 l en el de tezepelumab y de 1851 l en el de placebo.
Según los resultados publicados del estudio pivotal (Menzies-Gow et al., 2021), tezepelumab redujo de manera estadísticamente significativa la proporción de ataques graves de asma en un 56% respecto a placebo (razón de tasas o rate ratio: 0,44; IC95% 0,37-0,53; p< 0,001); distintos análisis de sensibilidad sustentan este resultado. Tal reducción de la frecuencia de crisis fue superior (del 70%) en aquellos pacientes con niveles basales de eosinófilos más altos (> 300 células/μl) respecto a los que mostraban niveles inferiores (41%). Además, la proporción de pacientes que no experimentó ningún ataque grave de asma durante el periodo de 52 semanas fue superior en el brazo de tezepelumab (54,2% vs. 38,6%; OR: 1,93; IC95% 1,51-2,47).
En relación con las variables secundarias, tezepelumab también obtuvo resultados estadísticamente significativos a su favor frente a placebo tras 1 año de tratamiento:
- Los pacientes tratados con el fármaco experimentaron un incremento de 0,23 l en el valor de pre-BD VEF1, frente a un aumento de 0,10 l con placebo (diferencia: +0,13 l; IC95% 0,08-0,18; p< 0,001).
- En la puntuación del cuestionario AQLQ(S)+12, tezepelumab indujo una mejora superior a placebo (+1,48 vs. +1,14 puntos), con una diferencia media estimada por mínimos cuadrados de +0,33 puntos (IC95% 0,20-0,47; p< 0,001). El 78% de los pacientes tratados con el nuevo fármaco vs. el 72% de los que recibieron placebo experimentaron una mejora clínicamente significativa, de ≥ 0,5 puntos respecto a la puntuación basal (razón de probabilidad u odds ratio: 1,36; IC95% 1,02-1,82).
- Respecto a la puntuación del ACQ-6, tezepelumab la redujo en mayor medida que placebo (-1,53 vs. -1,20), con una diferencia de -0,33 puntos (IC95% -0,46, -0,20; p< 0,001). La tasa de respuesta clínicamente significativa (≥ 0,5 puntos respecto a la puntuación basal) también fue superior en el grupo de tezepelumab: 86% vs. 77% (OR: 1,99; IC95%: 1,43-2,76).
- Tezepelumab también se asoció con una mejora en la puntuación del cuestionario ASD en comparación con placebo (-0,70 vs. -0,59 puntos), con una diferencia de -0,11 puntos entre grupos (IC95% -0,19, -0,04; p= 0,004).
Estos positivos resultados se ven apoyados por los del estudio PATHWAY de búsqueda de dosis (Corren et al., 2017), un ensayo de fase 2b, aleatorizado, doble ciego y controlado con placebo, también de 52 semanas de duración y en pacientes con asma grave inadecuadamente controlado, en el que se utilizó la misma variable principal que en el pivotal. De nuevo, tezepelumab indujo una reducción estadísticamente significativa del riesgo de ataques graves de asma en comparación con placebo, del 71%, 62% y 66% para las dosis mensuales de 210 mg y 70 mg y la dosis bisemanal de 280 mg, respectivamente (p< 0,001 en los tres casos).
Adicionalmente, se presentaron los hallazgos de un ensayo de soporte en el que se estudió la eficacia y la seguridad de tezepelumab en su pauta aprobada a fin de reducir la necesidad de administrar corticoides por vía oral en adultos. Este estudio SOURCE fue un fase 3, aleatorizado, doble ciego, controlado con placebo y multicéntrico, que aleatorizó (1:1) a 150 pacientes que recibían previamente una dosis de entre 7,5 y 30 mg de prednisona o prednisolona (u otro corticoide en una dosis equivalente) para recibir tezepelumab o placebo durante 48 semanas. Sus resultados (Wechsler et al., 2022) revelan una asociación de tezepelumab con una probabilidad numéricamente superior de conseguir una reducción de la dosis requerida de corticoides orales, pero que no alcanzó significación estadística frente a placebo (OR: 1,28; IC95% 0,69-2,35; p= 0,434).
De cara al análisis de seguridad, se dispone principalmente de los datos de 1336 participantes aleatorizados a los grupos de tezepelumab 210 mg/4 semanas (n= 665) o placebo (n= 669) que recibieron al menos una dosis; la duración media de la exposición al fármaco experimental fue de 350 días, con el 93% de los pacientes que fueron tratados al menos 48 semanas. En ese contexto, la incidencia de eventos adversos fue similar en ambos grupos, incluso ligeramente superior en el de placebo (74,6% vs. 76,5%). Las reacciones adversas más comunes entre quienes recibieron tezepelumab fueron: nasofaringitis (19,5% vs. 19,1% con placebo), infecciones del tracto respiratorio superior (9,3% vs. 13,3%), dolor de cabeza (7,8% vs. 7,5%) y asma (7,4% vs. 15,7%). Aunque no se dispone de datos agrupados relativos a la intensidad de estos eventos, en el estudio pivotal la incidencia de eventos adversos graves fue menor con el fármaco (6,6% vs. 11,1% con placebo).
Las infecciones graves han sido consideradas en el EPAR como un evento de especial interés, si bien su incidencia fue en general baja en ambos grupos (≈2%); no se reportaron casos de infecciones oportunistas ni de infestaciones por helmintos. Respecto a otros posibles eventos graves –que en general presentaron una incidencia ligeramente superior en los pacientes que recibieron placebo (8,6% vs. 13,0%)–, en los estudios clínicos no ocurrió ningún caso de anafilaxia o reacciones alérgicas graves asociadas a tezepelumab, siendo la frecuencia de eventos de hipersensibilidad similar en ambos grupos de tratamiento (≈8,5%). De forma similar, la incidencia de anticuerpos anti-fármaco fue baja tanto en el estudio pivotal (1,9% con tezepelumab y 3,8% con placebo) como en el estudio de soporte (2,2% vs. 9,4%), sin prácticamente describirse anticuerpos neutralizantes (un solo caso en cada grupo del estudio pivotal); en cualquier caso, nada apunta a que la inmunogenicidad altere el perfil de seguridad benigno de tezepelumab.
Aspectos innovadores
Tezepelumab es un nuevo anticuerpo monoclonal dirigido de manera específica frente a la linfopoyetina estromal tímica (TSLP), a la que se une e impide que interaccione con su receptor heterodimérico (TSLPR). El bloqueo de la TSLP evita que esta citocina ejerza sus acciones fisiológicas: reduce así la inducción de inflamación asociada a una reacción alérgica por activación de los mastocitos y la liberación de quimiocinas por parte de los monocitos. En base a este mecanismo, el medicamento ha sido autorizado con indicación en el tratamiento –por vía subcutánea– de mantenimiento adicional en adultos y adolescentes a partir de 12 años con asma grave que no están adecuadamente controlados a pesar de la administración de corticosteroides inhalados a dosis altas en combinación con otro medicamento para el tratamiento de mantenimiento.
Su eficacia clínica fue contrastada principalmente en un estudio pivotal de adecuado diseño (fase 3, aleatorizado, doble ciego, controlado con placebo y 52 semanas de duración) que tuvo por objetivo principal evaluar el cambio en la tasa anualizada de ataques de asma. Sus resultados evidencian una superioridad estadística de tezepelumab sobre placebo al reducir la frecuencia de ataques graves de asma en un 56% (RR: 0,44; p< 0,001), mostrando un beneficio incluso mayor en los pacientes con altos niveles basales de eosinófilos (> 300/μl), en quienes esa reducción alcanza el 70% (vs. 41% en pacientes con niveles inferiores). Asimismo, más de la mitad de los pacientes tratados con el fármaco estuvo libre de crisis graves de asma durante el año de tratamiento (54% vs. 39% con placebo). En las principales variables secundarias de eficacia, consistentes en el cambio en la puntuación en distintos cuestionarios relativos al manejo de la enfermedad respecto al nivel basal, tezepelumab también fue superior a placebo.
Adicionalmente, los resultados del estudio de soporte PATHWAY (de fase 2b, aleatorizado, doble ciego y controlado con placebo) sustentan la eficacia de tezepelumab mostrada en el estudio pivotal: se vio una reducción estadísticamente significativa del riesgo de ataques graves de asma del 71% respecto a placebo con la dosis mensual aprobada de 210 mg (p< 0,001).
Si bien no se dispone de comparaciones directas con otros tratamientos biológicos indicados en el manejo de mantenimiento del asma moderada-grave (lo que representa una limitación de la evidencia disponible), se han llevado a cabo algunas comparaciones indirectas –con menor robustez intrínseca– que sugieren que tezepelumab parece contar con una eficacia similar a dupilumab y superior a mepolizumab y benralizumab en la reducción del riesgo de ataques agudos. Por ejemplo, un metaanálisis (Nopsopon et al., 2023) reveló que tezepelumab se asocia con menor riesgo de exacerbación del asma respecto a benralizumab (riesgo relativo o RR: 0,63) y con un mayor grado de mejoría en VEF1 respecto a mepolizumab y benralizumab, mientras que la eficacia respecto a la mejora en pre-BD VEF1 fue similar a dupilumab. En esa línea, otra revisión sistemática y metaanálisis (Pitre et al., 2023) puso de manifiesto que tezepelumab y dupilumab se asocian con un menor riesgo de exacerbaciones frente a placebo, de magnitud similar (33% para tezepelumab y 32% para dupilumab). Tampoco hubo diferencias significativas entre tezepelumab y dupilumab en otro metaanálisis (Ando et al., 2022) en la mejora de la tasa anualizada de ataques de asma y en los niveles de pre-BD VEF1, aunque tezepelumab sí fue superior a dupilumab en el subgrupo de pacientes con menor recuento de eosinófilos (< 150 células/μl) (RR: 0,53).
En términos de conveniencia, la administración por vía subcutánea es también la empleada en el caso de benralizumab, mepolizumab o dupilumab. La pauta de administración cada cuatro semanas no difiere sustancialmente de las indicadas con estos otros tratamientos: las tres primeras dosis de benralizumab se administran también cada cuatro semanas y, posteriormente, cada ocho; mepolizumab se administra cada cuatro semanas; y dupilumab se administra cada dos semanas.
Por otra parte, la eficacia de tezepelumab en la reducción de la necesidad de corticoides por vía oral se evaluó en pacientes adultos en un estudio fase 3 de adecuado diseño (aleatorizado, doble ciego, controlado con placebo y multicéntrico): se hizo patente una tendencia numéricamente favorable, pero sin significación estadística frente a placebo en la reducción de la dosis de corticoides orales recibida (OR: 1,28; p= 0,434), por lo que no se puede concluir que haya un beneficio en ese sentido con tezepelumab.
En cuanto a los aspectos de seguridad del nuevo fármaco, su perfil toxicológico parece bien definido y aceptable, en línea con otros anticuerpos monoclonales usados en asma grave: se reportó una frecuencia de eventos adversos similar –e incluso ligeramente inferior– a placebo (75%) y una mayoría de ellos de intensidad leve o moderada y clínicamente manejables. En su pauta aprobada, los eventos adversos más comunes asociados a tezepelumab fueron nasofaringitis (20% vs. 19% con placebo), otras infecciones del tracto respiratorio superior (9% vs. 13%), dolor de cabeza (8%) y asma (7% vs. 16%). De modo interesante, los considerados graves fueron escasos (9%) y menos frecuentes que con placebo (13%). El plan de gestión de riesgos incluido en el EPAR no ha identificado ningún riesgo de importancia, pero se destacan como riesgos potenciales –en relación con el mecanismo de acción del fármaco– la posibilidad de infecciones graves (aunque tuvieron una baja incidencia general en ambos grupos, en torno al 2%), de eventos cardiacos graves y de desarrollo de neoplasias, pues se debe tener en cuenta que la disponibilidad de datos de uso prolongado (> 1 año) es muy limitada.
En definitiva, tezepelumab es un nuevo fármaco biológico con un mecanismo de acción que inaugura una ruta terapéutica en asma. Aunque persisten algunas incertidumbres relativas a su uso a largo plazo en el marco de una enfermedad crónica, se asocia a un perfil de seguridad benigno y a una eficacia mayor que placebo en la reducción del riesgo de ataques de asma en tratamientos de al menos 1 año, permitiendo tratar potencialmente a cualquier paciente con asma grave con independencia de las características fenotípicas de su enfermedad. A expensas de la publicación de su IPT, todo apunta a que se va a posicionar como una nueva alternativa para los pacientes con asma grave que tengan una inadecuada respuesta a otros biológicos de mantenimiento, como dupilumab, benralizumab o mepolizumab, los cuales tienen indicaciones limitadas a supuestos clínicos como demostración de inflamación de tipo 2 (dupilumab) o eosinofilia (benralizumab y mepolizumab), pero no parece que vaya a mejorar los resultados clínicos de dupilumab.

Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica de Tezspire® (tezepelumab). 2024. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1221677001/FT_1221677001.html.
-
- Ando K, Fukuda Y, Tanaka A, Sagara H. Comparative Efficacy and Safety of Tezepelumab and Other Biologics in Patients with Inadequately Controlled Asthma According to Thresholds of Type 2 Inflammatory Biomarkers: A Systematic Review and Network Meta-Analysis. Cells. 2022; 11(5): 819. DOI: 10.3390/cells11050819.
-
- Corren J, Parnes JR, Wang L, Mo M, Roseti SL, Griffiths JM et al. Tezepelumab in Adults with Uncontrolled Asthma. N Engl J Med. 2017; 377(10): 936-46. DOI: 10.1056/NEJMoa1704064.
-
- European Medicines Agency (EMA). Tezspire®. European Public Assessment Report (EPAR). 2022. EMA/682391/2022. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/tezspire-epar-public-assessment-report_en.pdf.
-
- GEMA. Guía Española para el Manejo del Asma. Versión 5.3. 2023. Disponible en: https://www.semg.es/index.php/consensos-guias-y-protocolos/399-gema-5-3-guia-espanola-para-el-manejo-del-asma.
-
- Menzies-Gow A, Corren J, Bourdin A, Chupp G, Israel E, Wechsler ME et al. Tezepelumab in Adults and Adolescents with Severe, Uncontrolled Asthma. N Engl J Med. 2021; 384(19): 1800-09. DOI: 10.1056/NEJMoa2034975.
-
- Nopsopon T, Lassiter G, Chen ML, Alexander GC, Keet C, Hong H et al. Comparative efficacy of tezepelumab to mepolizumab, benralizumab, and dupilumab in eosinophilic asthma: A Bayesian network meta-analysis. J Allergy Clin Immunol. 2023; 151(3): 747-55. DOI: 10.1016/j.jaci.2022.11.021.
-
- Pitre T, Jassal T, Angjeli A, Jarabana V, Nannapaneni S, Umair A et al. A comparison of the effectiveness of biologic therapies for asthma: A systematic review and network meta-analysis. Ann Allergy Asthma Immunol. 2023; 130(5): 595-606. DOI: 10.1016/j.anai.2022.12.018.
-
- Robinson D, Humbert M, Buhl R, Cruz AA, Inoue H, Korom S et al. Revisiting Type 2-high and Type 2-low airway inflammation in asthma: current knowledge and therapeutic implications. Clin Exp Allergy. 2017; 47(2): 161-75. DOI: 10.1111/cea.12880.
-
- Wechsler ME, Menzies-Gow A, Brightling CE, Kuna P, Korn S, Welte T et al. Evaluation of the oral corticosteroid-sparing effect of tezepelumab in adults with oral corticosteroid-dependent asthma (SOURCE): a randomised, placebo-controlled, phase 3 study. Lancet Respir Med. 2022; 10(7): 650-60. DOI: 10.1016/S2213-2600(21)00537-3.
1 La GEMA es la guía de práctica clínica del asma basada en la evidencia científica de referencia mundial en español. Aglutina la colaboración de 17 sociedades científicas y otras organizaciones afines, y probablemente constituye el consenso de mayor magnitud efectuado en España sobre una enfermedad.
2 Los ataques o crisis de asma son episodios agudos o subagudos caracterizados por un aumento progresivo de uno o más de los síntomas típicos (disnea, tos, sibilancias y opresión torácica) acompañados de una disminución del flujo espiratorio (VEF1). Según la rapidez de instauración, existen dos tipos de crisis: las de instauración lenta (normalmente en días o semanas, por una infección respiratoria o mal control de la enfermedad) y las de instauración rápida (en < 3 h, por un broncoespasmo causado por inhalación de alérgenos, fármacos, alimentos o estrés emocional). Deben identificarse bien por tener causas, patogenia y pronóstico diferentes.
3 Dupilumab también cuenta con indicación en dermatitis atópica, rinosinusitis crónica con poliposis nasal, prurigo nodular y esofagitis eosinofílica.
4 La falta de control se determina por cualquiera de estas características: a) inadecuado control de los síntomas: test de control del asma (ACT) 1,5 puntos; b) exacerbaciones graves frecuentes: ≥ 2 exacerbaciones graves o haber recibido ≥ 2 ciclos de CSO de ≥ 3 días cada uno en el año anterior; c) ≥ 1 hospitalización por exacerbación grave, ingreso en UCI o ventilación mecánica en el año anterior; d) limitación crónica al flujo aéreo: VEF1< 80% tras el uso de un broncodilatador.
5 AQLQ(S)+12 es la versión estandarizada del cuestionario de calidad de vida en pacientes de 12 o más años con asma (Asthma Quality of Life Questionnaire) y permite medir el impacto del asma en la vida diaria de los pacientes a partir de 32 ítems puntuados del 1 (mayor impacto en la calidad de vida) al 7 (menor impacto). Las puntuaciones más altas indican una mejor calidad de vida.
6 El ACQ-6 (Asthma Control Questionnaire – 6) es un cuestionario de 5 preguntas que miden la gravedad de la enfermedad con una escala de 0 (ningún impacto o síntoma) a 6 (mayor impacto o gravedad del síntoma). La puntuación final es la suma de las obtenidas en el cuestionario dividida entre 5, de modo que una puntuación inferior a 0,75 es indicativa de un control adecuado del asma, puntuaciones entre 0,75 y 1,50 indican un control parcial de la enfermedad y las puntuaciones superiores a 1,50 indican un control inadecuado.
7 El diario de síntomas del asma (ASD, Asthma Symptom Diary) permite al paciente anotar cada día los síntomas experimentados asociados a la enfermedad, tales como tos, jadeos, afectación de la actividad rutinaria, despertares nocturnos o estado de ánimo general. La puntuación total será la media de la puntuación en 10 ítems valorados entre 0 y 4. Una puntuación más alta indica peor control del asma.



