Lasmiditán y rimegepant en migraña
 Nº471
Nº471
Resumen
Lasmiditán es un nuevo fármaco antimigrañoso con actividad agonista del receptor de 5-hidroxitriptamina 1F (5-HT1F) del sistema trigémino vascular, cuya activación inicia una cascada de señalización intracelular que provoca la inhibición de la actividad de la adenilato ciclasa. Se diferencia de los “triptanes” en que no presenta actividad agonista sobre los receptores vasoactivos 5-HT1B y 5-HT1D, por lo que su eficacia antimigrañosa se relaciona con la inhibición de la actividad de las neuronas del trigémino, sin provocar vasoconstricción.
El medicamento ha sido autorizado en la UE con indicación en el tratamiento agudo de la fase de cefalea de los ataques de migraña, con o sin aura en adultos, siendo el primero con ese mecanismo de acción. Su eficacia se contrastó en 3 estudios pivotales de fase 3 y adecuado diseño (aleatorizado, doble ciego y controlado con placebo), en los que, como tratamiento de una única crisis, lasmiditán fue superior a placebo en la proporción de pacientes sin dolor de cabeza a las 2 h, si bien la magnitud de esta diferencia fue bastante modesta: entre 7 y 21 puntos porcentuales según la dosis. Como tratamiento de hasta 4 crisis de migraña, la diferencia en alivio del dolor con lasmiditán respecto a placebo fue de 20 puntos porcentuales. Pese a la moderada eficacia, presenta un buen perfil de seguridad: la frecuencia de eventos adversos fue superior con el fármaco (56% vs. 34% con placebo), pero los más frecuentemente asociados al tratamiento son manejables, como mareo (25%), somnolencia (10%), parestesia (9%), fatiga (8%) y náuseas (7%). A tenor de los resultados de comparaciones indirectas –siempre sujetas a un menor grado de evidencia que las de tipo directo–, lasmiditán parece inferior en eficacia a los triptanes, por lo que a priori se posiciona como una alternativa en pacientes en que estos estén contraindicados o no sean eficaces.
Por su parte, rimegepant es un antagonista selectivo del receptor del péptido CGRP, el cual se relaciona con la generación de vasodilatación cerebral y la transmisión de las señales dolorosas asociadas a la migraña. Así, el medicamento ha sido autorizado con indicación en el tratamiento agudo de la migraña con o sin aura en adultos; y tratamiento preventivo de la migraña episódica en adultos que presentan al menos 4 crisis de migraña al mes. Su eficacia como tratamiento del ataque agudo se examinó en tres estudios pivotales de fase 3 de similar diseño –doble ciego, aleatorizado, controlado con placebo y multicéntrico–, donde una única dosis oral del fármaco aumentó significativamente la proporción de pacientes sin dolor a las 2 h desde la administración (estaba en torno al 20%), con diferencias respecto a placebo de entre 5 y 10 puntos porcentuales. En esa terapia aguda, la incidencia de eventos adversos fue baja y solo ligeramente superior a placebo (11% vs. 9%), siendo las náuseas (2% vs. 1%) y las infecciones urinarias (1% vs. 0,3%) los eventos más comunes. Por otro lado, como tratamiento preventivo administrado en días alternos, rimegepant redujo el número medio de días mensuales con migraña en 4,3 días, si bien la diferencia respecto a placebo fue de tan solo 0,8 días. En ese uso profiláctico, la incidencia de eventos adversos fue también similar a placebo (36%), destacando las infecciones del tracto respiratorio superior (8%), nasofaringitis (7%) y dolor de espalda (4%).
Se trata, pues, del primer antagonista oral de CGRP y tiene como principal ventaja la doble indicación en prevención y tratamiento agudo del dolor asociado a la migraña, aunque la evidencia disponible sugiere un beneficio clínico modesto. El uso profiláctico podría resultar más interesante, aunque la pauta de administración en días alternos puede mermar la adherencia y, en esta indicación, el medicamento únicamente se encuentra financiado como 4ª línea de tratamiento en pacientes con entre 8 y 14 días de migraña moderada a grave al mes. Por tanto, al menos a corto plazo no parece que vaya a suponer un importante cambio en la terapéutica de la migraña.
Aspectos fisiopatológicos
El término cefalea hace referencia al dolor localizado en la cabeza, incluida la cara. Cuando es frecuente e intensa, impide el desarrollo de las actividades profesionales, sociales y familiares, reduce enormemente la calidad de vida y tiene un elevado coste para el sistema sanitario y la sociedad. Por su parte, la migraña es el tipo de cefalea primaria más frecuente en la práctica clínica habitual –supone algo más del 50% de los casos consultados en unidades especializadas en cefalea– y mejor estudiado: se define como un trastorno paroxístico con gran carga genética y se caracteriza por la aparición de crisis de dolor de cabeza recurrente e intenso que suelen durar entre 4 y 72 horas si no se tratan o se tratan sin éxito. Las crisis de migraña se producen en personas cons-titucionalmente predispuestas, de forma recurrente, y se desencadenan en el hipotálamo (parte del cerebro responsable de la regulación hormonal, los ciclos de sueño, el hambre y la temperatura corporal), favorecidas o no por factores desencadenantes. Se define como estatus migrañoso a una crisis característica de migraña con duración superior a las 72 horas, que a menudo se relaciona con el abuso de fármacos.
Desde el punto de vista de su epidemiología, la migraña tiene una prevalencia aproximada del 12% en la población general, siendo del 17% en mujeres y del 6,5% en hombres; la prevalencia suele ser máxima entre los 30 y los 50 años de edad. En España, se ha descrito específicamente una prevalencia que oscila entre un 7% para los varones y un 16% para las mujeres, y las cifras se mantienen estables desde hace décadas. No obstante, algunos datos apuntan a que esta patología está altamente infradiagnosticada (solo un 30-40% de pacientes recibe la atención médica necesaria) y puede afectar a más de 5 millones de personas en España (casi 1 millón en su forma crónica).
El dolor asociado a la esta enfermedad neurológica suele ser, de forma característica, unilateral (localizado en un lado o mitad de la cabeza), aunque a veces tiene localización bilateral, de intensidad moderada-grave, de carácter pulsátil (“latido dentro de la cabeza”), que empeora con el esfuerzo físico, se asocia a náuseas y vómitos, y se acompaña de fotofobia y fonofobia (hipersensibilidad a la luz y al ruido, respectivamente).
Se distinguen dos grandes subtipos de migraña: migraña con aura (20% de las migrañas) y migraña sin aura (80%). El aura se caracteriza por una serie de síntomas que se originan en el cerebro, duran entre unos pocos minutos y una hora, se resuelven de forma espontánea y generalmente preceden a la crisis de dolor. Los síntomas de aura más frecuentes (>90% de casos) son los trastornos visuales, como visión borrosa y la aparición de luces o líneas brillantes en el campo visual, pero algunos pacientes también experimentan dificultades para hablar, confusión u hormigueos en diferentes partes del cuerpo.
En cuanto a la frecuencia de los episodios de cefalea, la migraña se ha clasificado tradicionalmente como episódica, caracterizada por menos de 15 días de cefalea al mes (la migraña episódica con presencia de aura es la que se considera migraña clásica), o crónica, cuando se reportan 15 días o más de cefalea al mes con al menos 8 días de migraña –con o sin aura– durante más de 3 meses. En torno al 2,5% de pacientes con enfermedad episódica progresa a migraña crónica en el curso de 1 año, y la patología crónica en ocasiones remite a episódica (tasa de transición superior al 50% a los 3 años).
El abuso de fármacos, la elevada frecuencia de crisis, la predisposición genética, la alteración de neurorreceptores nociceptivos, factores psicopatológicos y mecanismos de sensibilización central y periférica se han identificado entre los mecanismos de cronificación, que puede suceder en meses o años. No obstante, el pronóstico a largo plazo de la migraña es ampliamente variable, pudiendo reducirse los síntomas gradualmente con el paso de los años o incluso desaparecer completamente, mientas que en otros pacientes pueden continuar con la misma frecuencia y severidad o incluso empeorar y volverse más frecuentes.
El dolor asociado con la migraña aparece cuando se estimulan las aferencias trigeminales de la duramadre; se inicia con perturbaciones en la frecuencia de descarga de las neuronas del tronco cerebral, específicamente en los núcleos del rafe y locus coeruleus. La perturbación de sus neurotransmisores (serotonina y noradrenalina) ocasiona una oleada de oligohemia a nivel cortical que se relaciona con la sintomatología de la migraña: el aura se asocia con la depresión inicial de potenciales corticales, y la inflamación vascular neurogénica, asociada a la estimulación anormal de receptores 5-HT1B y 5-HT1D, ocasiona la sensación dolorosa. Otros síntomas, como las náuseas, se deben a la alteración sobre el centro del vómito, y la fotofobia y la fonofobia a la estimulación anormal de receptores de serotonina corticales.
Paradójicamente, y aunque las molestias parecen originarse en el cerebro, conviene recordar que el propio tejido cerebral carece de receptores del dolor. Por el contrario, las estructuras extracraneales (piel, mucosas, músculos, arterias, venas y periostio) e intracraneales (duramadre y vasos sanguíneos intracraneales) sí son sensibles al dolor, recibiendo inervación del nervio trigémino y de fibras procedentes de las dos primeras ramas cervicales (Figura 1). Además, las fibras parasimpáticas y simpáticas también contribuyen a la inervación de las estructuras intracraneales. El estímulo doloroso se transmite hacia el núcleo espinal del trigémino a nivel del tronco del encéfalo y, posteriormente, hacia el tálamo y el córtex cerebral.
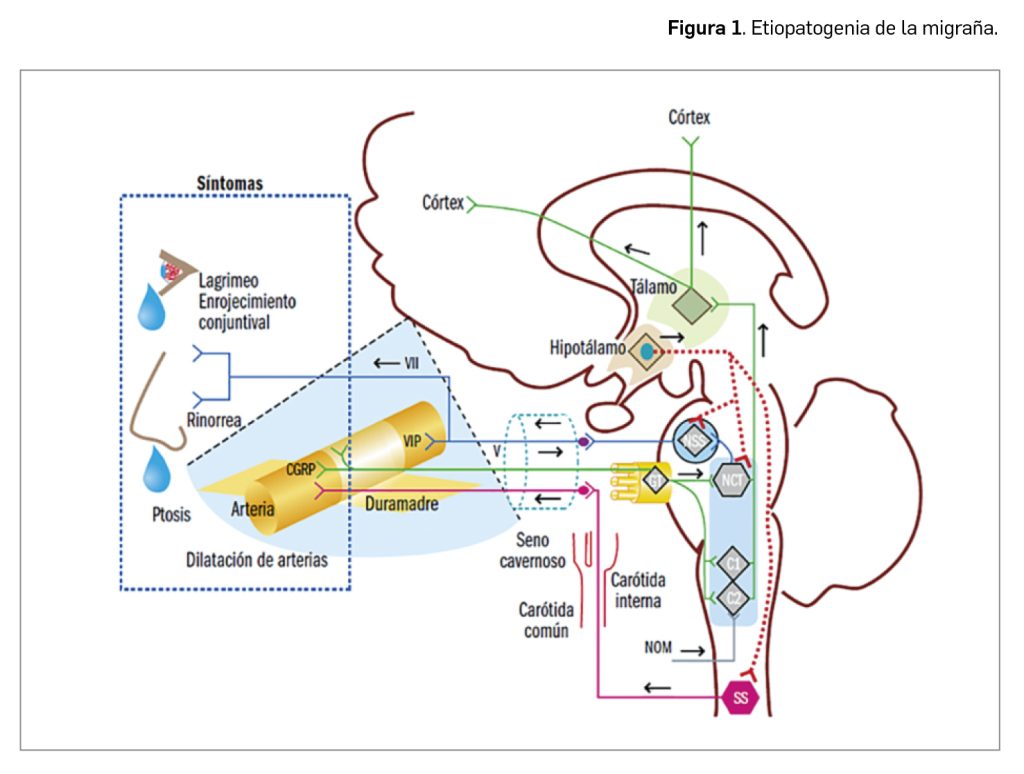
El nervio trigémino (V) transmite las sensaciones dolorosas de la piel, la duramadre y los vasos sanguíneos. Después de hacer sinapsis en el ganglio trigeminal (GT), conecta con el núcleo caudal del trigémino (NCT). Las aferencias perivasculares del trigémino pueden activarse de forma antidrómica y liberar péptido relacionado con el gen de la calcitonina (CGRP, por sus siglas en inglés), lo que provoca vasodilatación, pues las fibras nociceptivas trigeminales positivas para CGRP forman un rico plexo en los vasos sanguíneos intracraneales. El NCT y los segmentos medulares C1-C2 conforman el complejo trigémino cervical que tiene conexiones con el nervio occipital mayor (NOM), el hipotálamo y el núcleo salivar superior (NSS). La conexión entre el sistema trigeminal y el parasimpático facial se produce al nivel del NSS y constituye el denominado reflejo trigémino autonómico. Las fibras parasimpáticas del nervio facial (VII) alcanzan los vasos sanguíneos, donde liberan péptido intestinal vasoactivo (VIP) de efecto vasodilatador y causan la sintomatología autonómica parasimpática (enrojecimiento conjuntival, lagrimeo, rinorrea).
Aunque no se conocen en detalle las causas de la migraña o de la susceptibilidad a presentar episodios migrañosos, aproximadamente un 70% de las personas que la sufren tiene antecedentes familiares, lo que sugiere una causa genética del trastorno que posiblemente implica numerosos genes, haciendo que las manifestaciones sean muy variables. Sea como fuere, lo que sí parece contrastado es que existen una serie de desencadenantes del dolor que provocan alteraciones en el hipotálamo que hacen que, desde allí, se envíen señales hacia el tronco cerebral, donde se localiza el denominado centro generador de la migraña (núcleos del rafe y locus coeruleus), que pone en marcha los mecanismos responsables del dolor: actúa a través de las fibras nerviosas del nervio trigémino y produce la dilatación e inflamación de los vasos sanguíneos del cerebro (fundamentalmente como efecto de los mediadores vasodilatadores CGRP y VIP) y las estructuras que lo recubren (duramadre), provocando el dolor. Por ello, los fármacos vasoconstrictores alivian la migraña.
El tratamiento sintomático de las crisis de migraña debe realizarse en todos los pacientes, y tiene como objetivo la supresión del dolor y la sintomatología acompañante. Puede realizarse con fármacos no específicos (paracetamol y antiinflamatorios no esteroideos, fundamentalmente), fármacos específicos (triptanes, derivados ergóticos) y fármacos coadyuvantes (como los antieméticos y los procinéticos). Las principales guías clínicas (por ejemplo, de Sociedades Europeas, de la American Academy of Neurology y del Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología) recomiendan en primera línea el uso de triptanes –agonistas selectivos de los receptores de serotonina 5-HT1 (sobre todo, de los subtipos B y D, que participan en la vasoconstricción de vasos sanguíneos cerebrales)– en pacientes con crisis de migraña moderadas o graves y también en las crisis leves que no responden a fármacos no específicos, siempre que no exista contraindicación para su uso. En la actualidad, los derivados ergóticos, como la ergotamina, no se recomiendan en los pacientes migrañosos de novo, fundamentalmente por la menor eficacia respecto a los triptanes y por su perfil de efectos adversos (Díaz et al., 2019).
En pacientes con más de 3 episodios de migraña al mes1 está indicado el tratamiento preventivo, a fin de reducir la cronicidad (reducir la frecuencia de los días de migraña) y mejorar la calidad de vida del paciente, reduciendo el impacto de la migraña en su funcionalidad; se considera una profilaxis eficaz si a los 3 meses de tratamiento se ha alcanzado una reducción al menos del 50% de los ataques mensuales. No obstante, la profilaxis farmacológica debe ser parte de un paradigma de tratamiento multimodal, incorporando también aspectos no farmacológicos como la nutrición, el ejercicio físico o las intervenciones psicológicas, que han demostrado ser beneficiosos para los pacientes con migraña.
De cara a la profilaxis, los fármacos más comúnmente empleados en la UE y recomendados en las guías clínicas son: antiepilépticos (topiramato o valproato), betabloqueantes (propranolol, metoprolol), antidepresivos (amitriptilina), calcioantagonistas (flunarizina) y, por último, la toxina botulínica tipo A2 en casos refractarios o con contraindicación de betabloqueantes y topiramato.
En los últimos años, la investigación clínica se ha orientado hacia el diseño de anticuerpos monoclonales frente al CGRP. Estos novedosos anticuerpos se han mostrado más eficaces que los tratamientos “clásicos” y han abierto nuevos horizontes en la profilaxis de migraña. Así, en 2019 se incorporaron al mercado farmacéutico español erenumab y galcanezumab, dos nuevos anticuerpos monoclonales que muestran actividad antimigrañosa por su capacidad de inhibir los efectos biológicos del neuropéptido CGRP. Mientras que erenumab se une al dominio extracelular del receptor de CGRP, galcanezumab se une específicamente al propio CGRP, pero ambos fármacos previenen, en última instancia, los efectos vasodilatadores y de modulación de las señales nociceptivas mediados por la unión del CGRP a su receptor, fundamentalmente en áreas cerebrales relevantes en la patogénesis de la migraña, como el ganglio del trigémino. En base a ello, ambos medicamentos (Aimovig® y Emgality®), administrados por vía subcutánea una vez al mes, han sido aprobados para la profilaxis de la migraña en adultos con al menos 4 días de migraña al mes. Un año después se produjo la incorporación de fremanezumab (Ajovy®), que comparte mecanismo de acción, vía de administración e indicación autorizada con galcanezumab. La última incorporación fue la de eptinezumab en 2023, otro anticuerpo monoclonal, en este caso dirigido a las formas α y β del CGRP, con datos de eficacia que no parecen diferir sustancialmente de los conocidos para otros anticuerpos monoclonales dirigidos a esta diana (Caballero, 2023).
Se trata de fármacos por lo general bien tolerados, que se asocian a reacciones adversas leves-moderadas y transitorias (con una incidencia de eventos adversos sin grandes diferencias frente a placebo) y a bajas tasas de abandono.
Acción y mecanismo
Lasmiditán es un nuevo fármaco antimigrañoso con actividad agonista del receptor de 5-hidroxitriptamina 1F (5-HT1F), localizado pre y postsinápticamente en el sistema trigémino vascular. La activación de este receptor, para el cual lasmiditán cuenta con alta afinidad y selectividad, inicia una cascada de señalización intracelular que provoca la inhibición de la actividad de la adenilato ciclasa. A diferencia de los fármacos denominados “triptanes”, lasmiditán no presenta actividad agonista sobre los receptores vasoactivos 5-HT1B y 5-HT1D, por lo que su eficacia como tratamiento de la migraña se ha relacionado con la inhibición de la actividad de las neuronas del trigémino sin provocar vasoconstricción. En base a este mecanismo, lasmiditán ha sido autorizado en la Unión Europea con indicación en el tratamiento agudo de la fase de cefalea de los ataques de migraña, con o sin aura en adultos.
La selectividad de lasmiditán por el receptor 5-HT1F se comprobó in vitro mediante el empleo de receptores humanos clonados, con valores de Ki en el rango nanomolar (1,8-2,2 nM). En este sentido, lasmiditán ha mostrado una selectividad aproximadamente 470 veces mayor por los receptores 5-HT1F que por los 5-HT1B y 5-HT1D (Nelson et al., 2010). Adicionalmente, en modelos animales de rata y ratón se ha podido demostrar in vivo la capacidad de lasmiditán para inhibir la nocicepción asociada a la activación trigeminovascular y para bloquear la liberación de CGRP, con dosis de 5 mg/kg.
Por su parte, rimegepant es un antagonista del receptor del CGRP, por el cual presenta una elevada afinidad. La actividad del CGRP, un neuropéptido de 37 aminoácidos, se relaciona con la transmisión aferente de las señales dolorosas asociadas a la migraña, además de provocar vasodilatación. En base a su actividad como antagonista de este receptor, rimegepant ha sido autorizado con indicación en el tratamiento agudo de la migraña con o sin aura en adultos; y tratamiento preventivo de la migraña episódica en adultos que presentan al menos 4 crisis de migraña al mes.
Aspectos moleculares
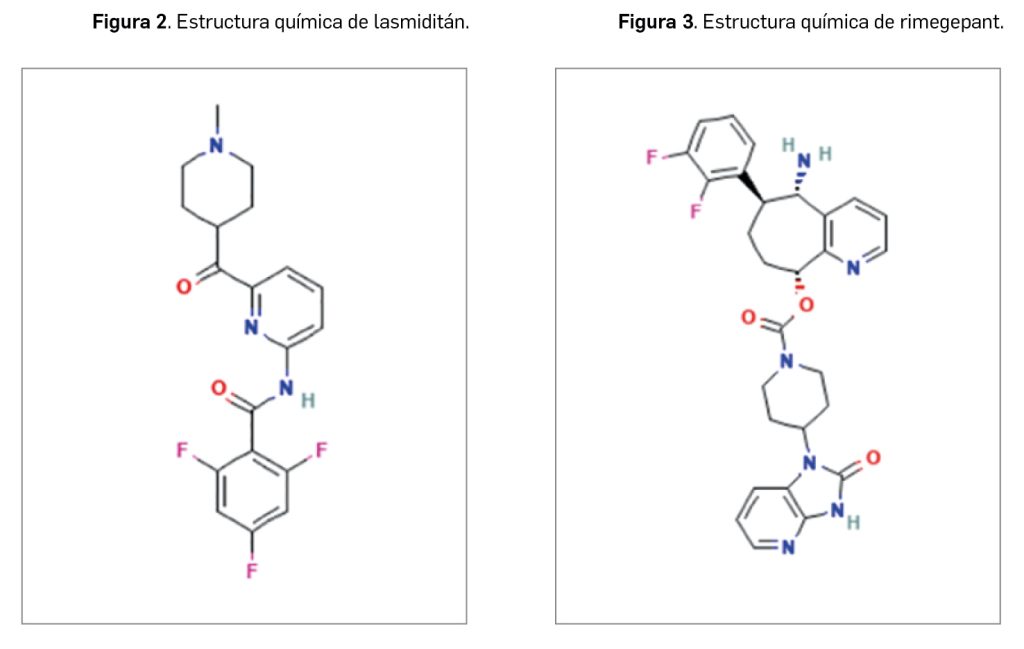
Lasmiditán es un nuevo fármaco con actividad agonista del receptor 5-HT1F de la serotonina que, desde el punto de vista de su estructura química (Figura 2), tiene el nombre de 2,4,6-trifluoro-N-(6-(1-metilpiperidin-4-carbonil)piridin-2-il)benzamida, y se corresponde con la fórmula C19H18F3N3O2 y una masa molecular de 377,4 g/mol. En el medicamento se presenta como la sal lasmiditán hemisuccinato, que en forma pura es un polvo blanco o prácticamente blanco no higroscópico con alta solubilidad en agua.
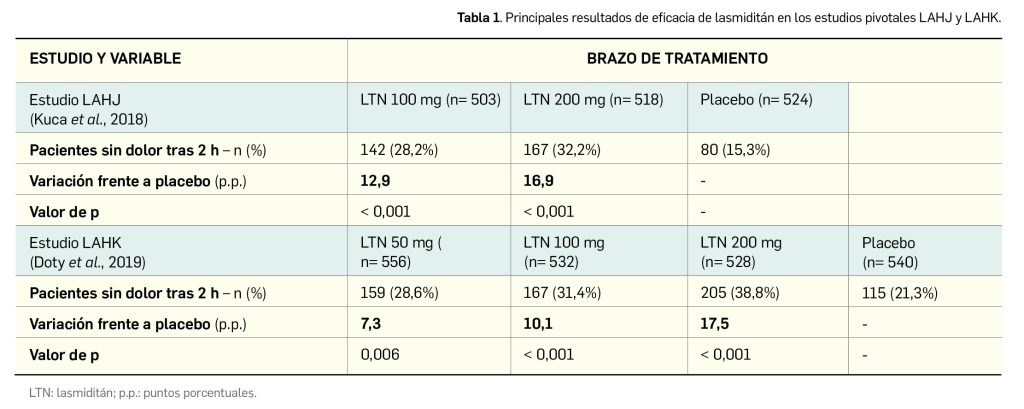
Rimegepant, por su parte, es otra molécula de síntesis química con actividad antagonista selectivo del receptor del CGRP. Estructuralmente (Figura 3), es el (5S,6S,9R)-5-amino-6-(2,3-difluorofenil)-6,7,8,9-tetrahidro-5H-ciclohepta[b]piridin-9-il-4-(2-oxo-2,3-dihidro-1H-imidazo[4,5-b]piridin-1-il)-1-piperidin-1-carboxilato, y comercialmente se formula como hemisulfato sesquihidrato, correspondiéndose con la fórmula molecular C28H28F2N6O3 · 0,5 H2SO4 · 1,5 H2O y un peso molecular de 610,6 g/mol (534,6 g/mol para la base libre).
La sustancia activa es un polvo blanco o blanquecino ligeramente higroscópico, libremente soluble en dimetilsulfóxido y ligeramente soluble en agua; tiene baja solubilidad en agua pero alta permeabilidad.
Eficacia y seguridad clínicas
LASMIDITÁN
La eficacia de lasmiditán como tratamiento agudo de los ataques de migraña ha sido evaluada en tres estudios pivotales de fase 3 aleatorizados, doble ciego y controlados con placebo. En los estudios LAHJ y LAHK se analizó la eficacia como tratamiento de un único ataque, mientras que en el estudio LAIJ lasmiditán se utilizó como tratamiento de hasta 4 crisis. Pero todos ellos tuvieron como variable primaria la proporción de pacientes con ausencia de dolor 2 horas después de la administración. En el caso del estudio LAIJ, debido a sus características de diseño a más largo plazo, se consideró adicionalmente una variable de consistencia de ausencia de dolor a las 2 h de la dosis en al menos 2 de 3 ataques de migraña.
En los estudios pivotales se incluyó a pacientes adultos (edad ≥ 18 años) con entre 3 y 8 ataques de migraña al mes –pero < 15 días de cefalea mensuales– y una puntuación en la escala MIDAS ≥ 113. Por el contrario, se excluyó a pacientes con migraña crónica (15 o más días de cefalea al mes). Los participantes estuvieron adecuadamente distribuidos entre los distintos brazos de tratamiento en función de sus características sociodemográficas y basales en los tres estudios. Destaca que hubo mayoría de mujeres (≈84%), la edad media de los participantes fue de aproximadamente 42 años, con una media de ataques de migraña mensuales de 5,2 y una puntuación MIDAS media de 31,8, indicativa de discapacidad grave; alrededor de una cuarta parte de los participantes utilizaba alguna medicación preventiva para la migraña y un tercio era refractario o presentaba escasa respuesta al último triptán utilizado (LAHJ: 24,3%; LAHK: 32,1%; LAIJ: 39,7%).
Los participantes en los estudios en los que se analizó la eficacia del tratamiento en una única crisis de migraña (LAHJ y LAHK) fueron aleatorizados en proporción 1:1:1 para recibir, por vía oral, lasmiditán 50 mg (solo en el estudio LAHK), lasmiditán 100 mg, lasmiditán 200 mg o placebo como primera dosis, pudiendo repetir la misma dosis como rescate. El tratamiento con lasmiditán se mostró superior a placebo, con una diferencia estadísticamente significativa con todas las dosis estudiadas (Tabla 1). Lasmiditán también se asoció con una reducción estadísticamente significativa de la proporción de pacientes con dolor a las 2 h desde la administración tras el primer ataque en el estudio LAIJ, de acuerdo a los resultados publicados (Ashina et al., 2021). La dosis de 100 mg de lasmiditán redujo en 17,4 p.p. la frecuencia de dolor frente a placebo (p< 0,001), mientras que la dosis de 200 mg la redujo en 20,9 p.p. (p< 0,001). En cuanto a la variable de consistencia, la diferencia vs. placebo en la proporción de pacientes sin dolor en 2 de 3 ataques fue de 10,1 p.p. con lasmiditán 100 mg y de 20,1 p.p. con lasmiditán 200 mg. Finalmente, cabe destacar que la frecuencia del síntoma más molesto (SMM)4 a las 2 h de la dosis –objetivo secundario clave en los estudios LAHJ y LAHK, también evaluado como secundario en el estudio LAIJ– fue significativamente menor en todos los estudios y con todas las dosis evaluadas en comparación con placebo (p< 0,001, excepto para lasmiditán 50 mg en el estudio LAHK, donde p= 0,018): por ejemplo, la diferencia vs. placebo osciló entre 7,3 p.p. con lasmiditán 50 mg y 15,2 p.p. para lasmiditán 200 mg en el estudio LAHK.
Se dispone asimismo de los resultados de un estudio abierto en el que se evaluó la eficacia de lasmiditán a largo plazo (hasta 12 meses) en pacientes que hubieran completado los estudios LAHJ o LAHK. La población de análisis estuvo constituida por 1954 pacientes que trataron con lasmiditán 100 mg o 200 mg un ataque hasta 4 h después del inicio, totalizándose 17 329 ataques de migraña (8844 tratados con lasmiditán 100 mg y 8485 con la dosis de 200 mg). La ausencia de dolor se consiguió en el 26,7% de los que utilizaron la dosis inferior y en el 32,2% de los que utilizaron la dosis de 200 mg (EMA, 2022).
En cuanto al perfil de seguridad de lasmiditán, en el EPAR se han analizado de manera conjunta los datos disponibles para los estudios de fase 2 y 3, agrupando a un total de 6922 pacientes, de los cuales 4861 fueron tratados con lasmiditán y 2061 con placebo. En líneas generales, la frecuencia de eventos adversos reportados en un intervalo de 48 h desde la administración del fármaco fue superior con lasmiditán que con placebo (56,4% vs. 33,5%); también fue mayor la proporción de pacientes que reportó al menos un evento adverso (45,7% vs. 16,9% con placebo), especialmente con las dosis más altas (LTN 50: 33,8%; LTN 100: 45,0%; LTN 200: 51,0%). Los eventos adversos más frecuentes (≥ 5%) en los pacientes que recibieron el fármaco fueron: mareo (25,0%), somnolencia (9,5%), parestesia (9,3%), fatiga (7,6%) y náuseas (6,8%).
En cualquier caso, la mayoría de reacciones adversas fueron leves-moderadas en severidad: solo 9 pacientes tratados con lasmiditán reportaron algún evento grave (0,2%) frente a 2 con placebo (0,1%). Se documentaron 6 casos de síndrome serotoninérgico en pacientes que habían recibido lasmiditán, 2 de ellos calificados como graves, aunque con recuperación completa en todos los casos. No se reportó ningún fallecimiento durante los estudios y la tasa de discontinuación del tratamiento por eventos adversos fue también baja, aunque más común en los pacientes que recibieron lasmiditán (1,0% vs. 0,1% con placebo), siendo las causas más frecuentes los mareos (n= 13) y vértigo (n= 4).
RIMEGEPANT
La eficacia y la seguridad clínicas de rimegepant como tratamiento del ataque agudo de migraña se ha evaluado en tres estudios pivotales de fase 3 de similar diseño –doble ciego, aleatorizado, controlado con placebo y multicéntrico– en pacientes que recibieron una única dosis oral de 75 mg de rimegepant o placebo5, con una duración máxima de 11 semanas6. El objetivo principal de estos estudios fue el análisis la variable coprimaria de ausencia de dolor a las 2 h de la administración de la dosis y de ausencia del SMM en este mismo intervalo de tiempo. Algunas variables secundarias principales fueron el alivio del dolor a las 2 h de la administración y el alivio sostenido del dolor entre las 2 y las 24 h siguientes a la administración.
Los estudios enrolaron a pacientes adultos de 18 años o mayores con un historial de al menos 1 año de migraña con o sin aura de inicio antes de los 50 años, con hasta 8 ataques de intensidad moderada o grave en los 3 meses previos al inicio del estudio y menos de 15 días de cefalea al mes en ese mismo periodo (indicativo de migraña crónica); por el contrario, se excluyó a pacientes con antecedentes de migraña basilar o hemipléjica y con comorbilidades cardiovasculares no controladas o de reciente inicio. No se permitió el uso previo o concomitante de ciertos fármacos, como derivados ergóticos (usados ≥ 10 días al mes en los últimos 3 meses), analgésicos no opioides (durante ≥ 15 días al mes en ese mismo periodo, incluidas otras indicaciones diferentes a la migraña) y opioides y paracetamol (hasta 2 días antes de la aleatorización).
Los participantes estuvieron adecuadamente equilibrados de acuerdo a sus características demográficas y clínicas basales entre los dos brazos de tratamiento en cada uno de los estudios y éstas fueron también similares en todos ellos, sobresaliendo una edad media de aproximadamente 40 años, mayoría de mujeres (85-90%) y de raza blanca (75-80%). El SMM más común fue la fotofobia (55-60%), seguido de náuseas (21-28%) y fonofobia (17-20%).
El tratamiento con rimegepant arrojó resultados estadísticamente significativos en comparación con placebo en cada uno de los tres estudios pivotales para las dos variables coprimarias de eficacia (Tabla 2).
Entre las variables secundarias de eficacia, la proporción de pacientes con alivio del dolor 2 h después de la administración de la dosis fue significativamente superior con rimegepant en los tres estudios, con una diferencia absoluta de 10,3 p.p. en el estudio 301 (p= 0,0006), de 15,3 p.p. en el estudio 302 (p< 0,0001) y de 16,1 p.p. en el estudio 303 (p< 0,0001). En el caso de la variable de alivio sostenido del dolor hasta las 24 h post-administración, la diferencia estimada respecto a placebo solo fue estadísticamente significativa en el estudio 303 (10,1%; p< 0,0001).
Por otro lado, se estudió la eficacia y la seguridad clínicas de rimegepant como tratamiento preventivo de la migraña en un estudio pivotal de fase 2/3, aleatorizado, doble ciego, multicéntrico y controlado con placebo (estudio 305)7. La variable principal fue el cambio en el número medio de días con migraña respecto al periodo de observación previo a la aleatorización durante el último mes del periodo doble ciego (semanas 9-12). La proporción de participantes con una reducción de ≥ 50% en el número medio de días de migraña moderada o grave en las semanas 9-12 respecto al periodo de observación y el cambio en el número medio de días con migraña durante la fase doble ciego respecto al periodo basal fueron las principales variables secundarias de eficacia.
Se incluyó en el estudio a pacientes con un historial de al menos un año de migraña con o sin aura, que sufrieron entre 4 y 18 ataques de migraña moderada o grave al mes en los 3 meses previos al inicio del estudio, con ataques de entre 4 y 72 h de duración sin tratamiento y 6 o más días de migraña durante la fase de observación pero no más de 18 días de cefalea durante este periodo. Se permitió el tratamiento de rescate con triptanes en caso de ataque agudo durante la fase doble ciego, pero el uso de triptanes se prohibió en la fase abierta de extensión, pudiendo utilizar en cambio rimegepant como tratamiento de rescate, además de la dosis habitual en días alternos.
Este estudio aleatorizó a 747 en proporción 1:1 para recibir rimegepant 75 mg o placebo en días alternos, de los cuales 695 cumplieron los criterios para ser incluidos en la población final de análisis de eficacia (población por intención de tratar modificada). Grosso modo, los participantes estuvieron adecuadamente distribuidos entre los dos brazos de tratamiento en función de sus características sociodemográficas y clínicas basales. La edad media fue de 40 años, hubo mayoría de mujeres (83%) y de participantes de raza blanca (81%), y el número medio de días con migraña al mes fue de 7,8, con una duración media de las crisis de unas 29 h.
Los resultados divulgados (Croop et al., 2021) revelan una reducción estadísticamente significativa del número medio de días mensuales con migraña al administrar rimegepant vs. placebo de -0,8 días (IC95% -1,46 a -0,20; p= 0,0099). En términos porcentuales, durante las semanas 9-12 del periodo doble ciego rimegepant se asoció con una disminución del 50,3% del número medio de días con migraña respecto al periodo de observación, frente a una reducción del 41,7% con placebo.
En cuanto al objetivo secundario de la proporción de pacientes con reducción de ≥50% del número medio de días de migraña, rimegepant superó a placebo, con una diferencia de 7,6 p.p. (49,1% vs. 41,5%; p= 0,438). El nuevo fármaco también redujo el número medio de días con migraña durante el conjunto del periodo doble ciego, con una diferencia de -0,8 días respecto a placebo (p= 0,0017).
Para caracterizar el perfil de seguridad de rimegepant se dispone de datos de exposición en más de 3800 participantes en estudios de fase 2 y 3, de los cuales 1771 corresponden a los estudios pivotales de fase 3 en dosis única; en su uso profiláctico, hay datos de 527 pacientes con una exposición de al menos 6 meses.
En tratamiento agudo, los eventos adversos fueron ligeramente más frecuentes en los pacientes tratados con rimegepant frente a los que recibieron placebo (10,8% vs. 8,6%). Las reacciones adversas más frecuentes (≥ 0,5%) con el fármaco fueron náuseas (1,5% vs. 0,8% con placebo), infecciones del tracto urinario (0,8% vs. 0,3%) y mareo (0,6% vs. 0,7%). La práctica totalidad fueron leves-moderados, y únicamente se reportó un evento considerado grave (dolor de espalda) entre los pacientes que recibieron rimegepant. Por otra parte, como tratamiento profiláctico, en el periodo doble ciego del estudio 305, la frecuencia de eventos adversos fue similar en los brazos de tratamiento y placebo (35,9% vs. 35,8%), si bien, considerando también la fase de extensión (hasta 64 semanas), la frecuencia de eventos adversos con el fármaco creció hasta el 53,8%: los más comunes en este periodo fueron infecciones del tracto respiratorio superior (7,6%), nasofaringitis (7,0%) y dolor de espalda (4,3%). En cualquier caso, la tasa de discontinuación del tratamiento con rimegepant por eventos adversos tuvo una frecuencia baja en general (3,0%), siendo los principales motivos el mareo (0,3%) y aumento de ALT y AST (0,2%).
Aspectos innovadores
Lasmiditán y rimegepant son dos nuevos fármacos de molécula pequeña y vía de administración oral indicados en el tratamiento de los ataques agudos de migraña. Rimegepant cuenta, adicionalmente, con indicación como tratamiento profiláctico de la migraña.
En primer lugar, lasmiditán es un nuevo antimigrañoso que actúa como un agonista altamente afín y selectivo del receptor de 5-hidroxitriptamina 1F (5-HT1F), localizado en el sistema trigémino vascular y cuya activación inicia una cascada de señalización intracelular que provoca la inhibición de la actividad de la adenilato ciclasa. A diferencia de los triptanes, lasmiditán no presenta actividad agonista sobre los receptores vasoactivos 5-HT1B y 5-HT1D, por lo que su eficacia como antimigrañoso se relaciona con la inhibición de la actividad de las neuronas del trigémino sin provocar vasoconstricción. En base a ello, el medicamento ha sido autorizado en la UE para el tratamiento agudo de la fase de cefalea de los ataques de migraña, con o sin aura en adultos.
Su eficacia como tratamiento agudo de los ataques de migraña se contrastó en tres estudios pivotales de fase 3 y adecuado diseño (aleatorizado, doble ciego y controlado con placebo), dos de ellos lo evaluaron como tratamiento de un único ataque mientras que el tercero investigó el beneficio de lasmiditán como tratamiento de hasta 4 ataques de migraña. Como abordaje de una única crisis, el nuevo fármaco fue estadísticamente superior a placebo en la variable principal –proporción de pacientes con ausencia de dolor 2 h después de la administración– a todas las dosis estudiadas, pero la magnitud de esta diferencia fue en general bastante modesta: de entre 7 y 21 puntos porcentuales frente a placebo, no siendo la tasa de respuesta superior al 40% de los pacientes en ninguna de las dosis estudiadas.
Además, en pacientes sin respuesta, la administración de una segunda dosis como rescate tampoco parece aportar beneficio. Como tratamiento de hasta 4 crisis de migraña –variable de consistencia en el tercer estudio–, la diferencia en alivio del dolor con lasmiditán respecto a placebo fue de hasta 20 puntos porcentuales con la dosis más alta.
Hay que subrayar que la comparación con placebo limita la posibilidad de determinar el potencial beneficio clínico adicional de lasmiditán respecto a los triptanes, considerados actualmente como tratamiento de elección del dolor asociado al ataque agudo de migraña. No obstante, se han llevado a cabo algunos metaanálisis en los que se han establecido comparaciones indirectas entre lasmiditán y otros fármacos (AEMPS, 2023): concretamente, frente a distintos triptanes –almotriptán, eletriptán, rizatriptán, sumatriptán y rizatriptán– lasmiditán obtuvo menor OR (odds ratio o razón de probabilidad) que todos ellos para las variables de ausencia de dolor y alivio del dolor a las 2 h. Respecto de estas variables, lasmiditán se mostró superior a rimegepant en dos metaanálisis con la dosis de 200 mg, aunque rimegepant fue superior en otro de ellos respecto de las variables de ausencia del dolor entre las 2 y 24 h y entre las 2 y 48 h post-administración.
El perfil de seguridad de lasmiditán parece bien caracterizado con los datos de los estudios pivotales y se ha considerado bastante favorable por la EMA. La incidencia de eventos adversos fue superior que con placebo (56% vs. 34%), pero los eventos adversos más frecuentes (≥ 5%) en los pacientes tratados con lasmiditán fueron mayoritariamente leves-moderados y manejables clínicamente, sobresaliendo: mareo (25%), somnolencia (1o%), parestesia (9%), fatiga (8%) y náuseas (7%). Solo un 0,2% de los pacientes tratados con lasmiditán reportó algún evento adverso grave (vs. 0,1% con placebo). Los datos de uso a largo plazo parecen sugerir una tendencia a la disminución del número de eventos adversos experimentados por cada paciente conforme aumentaba el número de dosis administradas como tratamiento de un ataque agudo.
En definitiva, estamos ante el primer agonista selectivo de los receptores 5-HT1F aprobado para el tratamiento del ataque agudo de migraña, pues, aunque el agonismo sobre esos receptores forma parte del mecanismo de acción de algunos triptanes, la eficacia de estos se explica en mayor medida por su efecto sobre los receptores 5-HT1B y 5-HT1D. Esa novedad relativa en el plano mecanístico se acompaña de un buen perfil de seguridad, pero de datos de eficacia que apuntan a ser inferiores a los de los triptanes. Así pues, el nuevo fármaco se posicionará como una alternativa cuando estos estén contraindicados o no hayan resultado eficaces.
Por su parte, rimegepant es un nuevo antagonista del receptor del neuropéptido CGRP, por el cual presenta una elevada afinidad, y cuyo bloqueo se traduce en la inhibición de la transmisión aferente de las señales dolorosas asociadas a la migraña y de la vasodilatación que acontece a nivel cerebral durante las crisis. En base a ello, el medicamento ha sido autorizado con indicación en el tratamiento agudo de la migraña con o sin aura en adultos; y para el tratamiento preventivo en días alternos de la migraña episódica en adultos que presentan al menos 4 crisis de migraña al mes.
Su aprobación se sustentó en la demostración de eficacia en el abordaje del ataque agudo de migraña en tres estudios pivotales de fase 3 y similar diseño (doble ciego, aleatorizado, controlado con placebo y multicéntrico), donde más de 3000 pacientes recibieron una única dosis oral de 75 mg de rimegepant o placebo a fin de medir la ausencia de dolor a las 2 h desde la administración de la dosis y de ausencia del SMM –fotofobia, fonofobia y náuseas– en este mismo intervalo de tiempo (variables coprimarias). Sus resultados revelan un beneficio estadísticamente significativo en comparación con placebo, aunque de limitada magnitud: la proporción de pacientes sin dolor a las 2 h estuvo alrededor del 20%, con un incremento de entre 5 y 10 puntos porcentuales respecto a placebo; y la ausencia del SMM fue más frecuente con rimegepant (en torno al 35-37%) que con placebo, pero la diferencia estimada fue también modesta (8-12 puntos porcentuales). En términos de alivio sostenido del dolor hasta 24 h post-administración, rimegepant solo alcanzó significación estadística en uno de los estudios, con una diferencia estimada de respuesta de 10 puntos frente a placebo.
Tampoco se dispone de comparaciones directas de rimegepant con otros tratamientos empleados en el ataque agudo de migraña, y solo se puede aludir a algunas comparaciones indirectas que, por lo general, lo sitúan como una opción menos eficaz que la mayor parte de los triptanes y dihidroergotamina en el alivio del dolor a las 2 h (AEMPS, 2023).
Como tratamiento profiláctico, el nuevo fármaco redujo en su estudio pivotal el número medio de días mensuales con migraña en 4,3 días, lo que supone una diferencia estadísticamente significativa respecto a placebo, aunque de tan solo 0,8 días, es decir, la disminución del número de días con migraña al mes es menor del 10% del número medio mensual en el periodo basal.
El perfil de seguridad de rimegepant parece, en todo caso, bastante favorable, con una incidencia de eventos adversos baja y solo ligeramente superior a placebo (11% vs. 9%) como tratamiento agudo. Los eventos más comunes con esta pauta de dosis única fueron: náuseas (2% vs. 1% con placebo), infecciones del tracto urinario (1% vs. 0,3%) y mareo (1% en ambos grupos). La incidencia de eventos adversos es mayor cuando se usa como preventivo –en periodos de hasta 64 semanas–, pero también en un rango similar a la observada con placebo (36%). Las reacciones adversas más comunes en ese contexto fueron infecciones del tracto respiratorio superior (8%), nasofaringitis (7%) y dolor de espalda (4%). Aunque bien tolerado de forma general, la seguridad a largo plazo todavía plantea algunas incertidumbres, por ejemplo, respecto a la posibilidad de efecto rebote al discontinuar un tratamiento prolongado.
En resumen, se trata del primer antagonista oral de CGRP, que cuenta entre sus principales ventajas con la doble indicación en prevención y tratamiento agudo del dolor asociado a la migraña, si bien los datos de eficacia en ambas indicaciones son indicativos de un beneficio clínico modesto. El uso profiláctico podría resultar el más interesante, aunque la pauta de administración en días alternos puede comprometer la adherencia (sobre todo en tratamientos prolongados como los requeridos en la prevención de la migraña) y, en esta indicación, el medicamento únicamente se encuentra financiado como cuarta línea de tratamiento en pacientes con entre 8 y 14 días de migraña moderada a grave al mes; tampoco se debe olvidar que en el último lustro se han introducido con ese fin nuevos medicamentos basados en anticuerpos monoclonales –tales como erenumab, galcanezumab, fremanezumab y eptinezumab–, dirigidos también al bloqueo de la vía del CGRP, de administración subcutánea mensual o trimestral. Por tanto, al menos a corto plazo no parece que rimegepant vaya a suponer un importante cambio en la terapéutica de la migraña.


Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica de Rayvow® (lasmiditán). 2024. Disponible en: https:// cima.aemps.es/cima/dochtml/ft/1211587006/FT_1211587006.html.
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica de Vydura® (rimegepant). 2024. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1221645002/FT_1221645002.html.
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de lasmiditán (Rayvow®) en tratamiento agudo de la migraña. IPT-171/V1/18092023. 2023. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/2023/IPT-171-Rayvow-lasmiditan-migrana.pdf.
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de rimegepant (Vydura®) en tratamiento agudo de la migraña y profilaxis de la migraña episódica. IPT-166/V1/18092023. 2023. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos//docs/2023/IPT-166-Vydura-rimegepant-migrana.pdf.
-
- Ashina M, Reuter U, Smith T, Krikke-Workel J, Klise SR, Bragg S et al. Randomized, controlled trial of lasmiditan over four migraine attacks: Findings from the CENTURION study. Cephalalgia. 2021; 41(3): 294-304. DOI: 10.1177/0333102421989232.
-
- Caballero Portero P. Eptinezumab (Vyepti®) en profilaxis de la migraña. Panorama Actual Med. 2023; 47(466): 913-20.
-
- Croop R, Goadsby PJ, Stock DA, Conway CM, Forshaw M, Stock EG et al. Efficacy, safety, and tolerability of rimegepant orally disintegrating tablet for the acute treatment of migraine: a randomised, phase 3, double-blind, placebo-controlled trial. Lancet. 2019; 394(10200): 737-45. DOI: 10.1016/S0140-6736(19)31606-X.
-
- Croop R, Lipton RB, Kudrow D, Stock DA, Kamen L, Conway CM et al. Oral rimegepant for preventive treatment of migraine: a phase 2/3, randomised, double-blind, placebo-controlled trial. Lancet. 2021; 397(10268): 51-60. DOI: 10.1016/S0140-6736(20)32544-7.
-
- Díaz García Ó, Dévora Figueroa C, Díez González LM, Fernández del Pozo de Salamanca MB. Farmacología del sistema nervioso. En: Trastornos neurológicos y neuropsiquiátricos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2019. p. 1-120.
-
- Doty EG, Krege JH, Jin L, Raskin J, Halker Singh RB, Kalidas K. Sustained responses to lasmiditan: Results from post-hoc analyses of two Phase 3 randomized clinical trials for acute treatment of migraine. Cephalalgia. 2019; 39(12): 1569-76. DOI: 10.1177/0333102419859313.
-
- European Medicines Agency (EMA). Rayvow®. European Public Assessment Report (EPAR). 2022. EMA/622555/2022. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/rayvow-epar-public-assessment-report_en.pdf.
-
- European Medicines Agency (EMA). Vydura®. European Public Assessment Report (EPAR). 2022. EMA/CHMP/172260/2022. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/vydura-epar-public-assessment-report_en.pdf.
-
- Kuca B, Silberstein SD, Wietecha L, Berg PH, Dozier G, Lipton RB. Lasmiditan is an effective acute treatment for migraine: A phase 3 randomized study. Neurology. 2018; 91(24): e2222-e2232. DOI: 10.1212/WNL.0000000000006641.
-
- Lipton RB, Conway CM, Stock EG, Stock D, Morris BA, McCormack T et al. Efficacy, safety, and tolerability of rimegepant 75 Mg, an oral CGRP receptor antagonist, for the acute treatment of migraine: results from a double-blind, randomized, placebo-controlled trial, study 301. Headache. 2018; 58(8): 1336-37.
-
- Lipton RB, Croop R, Stock EG, Stock DA, Morris BA, Frost M et al. Rimegepant, an Oral Calcitonin Gene-Related Peptide Receptor Antagonist, for Migraine. N Engl J Med. 2019; 381(2): 142-9. DOI: 10.1056/NEJMoa1811090.
-
- Nelson DL, Phebus LA, Johnson KW, Wainscott DB, Cohen ML, Calligaro DO et al. Preclinical pharmacological profile of the selective 5-HT1F receptor agonist lasmiditan. Cephalalgia. 2010; 30(10): 1159-69. DOI: 10.1177/0333102410370873.
1 No hay un consenso sobre la frecuencia o duración de la cefalea migrañosa que requiera tratamiento profiláctico. De acuerdo con la Sociedad Española de Neurología (SEN), está indicado en pacientes que sufren ≥ 3 crisis de migraña al mes o, en caso de menor frecuencia, en situaciones de especial duración o intensidad, escasa respuesta o intolerancia al tratamiento sintomático, en pacientes que presentan auras prolongadas o con sintomatología basilar, o los que tienen una crisis epiléptica concomitante. Asimismo, estaría indicado cuando existe riesgo de abuso de fármacos o éste ya está presente.
2 La onabotulinumtoxina A actualmente solo está aprobada para pacientes con migraña crónica en algunos países europeos. Cada tratamiento con el fármaco requiere > 30 inyecciones en los músculos de la cabeza y el cuello, y los efectos adversos frecuentes incluyen dolor de cuello, dolor de cabeza, empeoramiento de la migraña, debilidad muscular y ptosis de los párpados.
3 La escala validada MIDAS (Migraine Disability Assessment) considera 4 grados de discapacidad asociada a la migraña, de entre los cuales, el grado 3 (puntuación: 11-20) y el grado 4 (puntuación: > 21) son indicativos de discapacidad moderada y grave, respectivamente.
4 Se consideraron los síntomas asociados de náusea, fonofobia y fotofobia. Para el análisis de esta variable, únicamente se tuvo en cuenta a aquellos pacientes que refirieron alguno de estos síntomas de forma adicional al dolor de la migraña.
5 En los estudios pivotales 301 y 302 los pacientes recibieron la dosis en forma de comprimidos, mientras que en el estudio pivotal 303 se utilizaron comprimidos bucodispersables.
6 El diseño de estos estudios incluyó un periodo de cribado de entre 3 y 28 días, una fase de tratamiento agudo de hasta 45 días para tratar una única crisis de migraña con dolor moderado o grave y una visita de fin de tratamiento 7 días después de la administración de la dosis.
7 El estudio 305 estuvo compuesto por 4 fases: una fase de cribado (observación) de 28 días, un periodo doble ciego de tratamiento de 12 semanas de duración, una fase de extensión abierta de 52 semanas y un seguimiento adicional de seguridad de 8 semanas.



