Roxadustat en anemia asociada a enfermedad renal crónica
 Nº470
Nº470
Resumen
Roxadustat es un novedoso inhibidor de molécula pequeña de la enzima prolil hidroxilasa del factor inducible por hipoxia (HIF), un factor de transcripción que regula la expresión de los genes que intervienen en la eritropoyesis y cuya activación es importante en la respuesta adaptativa a la hipoxia para aumentar la producción de eritrocitos. Habida cuenta de que la actividad de esas enzimas prolil hidroxilasas controlan los niveles intracelulares de HIF mediante su degradación, su inhibición reversible por roxadustat estimula una respuesta eritropoyética coordinada que incluye el aumento de los niveles plasmáticos de EPO endógena, la regulación de las proteínas transportadoras de hierro y la reducción de la hepcidina. El resultado es la mejora de la biodisponibilidad del hierro y el aumento de la producción de hemoglobina (Hb) y de la masa eritrocitaria, en base a lo cual el medicamento ha sido autorizado para el tratamiento por vía oral de adultos con anemia sintomática asociada a ERC (A-ERC).
Se ha evaluado la eficacia de roxadustat en 8 estudios pivotales de fase 3, de duración mínima de 1 año y diferente diseño, con un total de 9637 pacientes con A-ERC, de los cuales más de 5000 han recibido el fármaco; aproximadamente el 50% era dependiente de diálisis (DD) y la otra mitad no tenía dependencia de diálisis (NDD).
En el caso de pacientes NDD, el nuevo fármaco ha demostrado ser superior a placebo en el tratamiento de corrección de la anemia de acuerdo a los resultados combinados de tres estudios: sin necesidad de terapia de rescate, a los 6 meses el 80% de los pacientes tratados con roxadustat alcanza respuesta de hemoglobinemia frente al 9% en el grupo control. De igual modo, roxadustat confirmó en otro estudio su no inferioridad frente a un control activo en esas variables: respuesta en el 90% con roxadustat vs. 78% con darbepoetina alfa a los 6 meses, y aumentos de hemoglobina prácticamente idénticos hasta los 9 meses (en el entorno de +1,8 g/dl). En pacientes DD de inicio reciente (< 4 meses), el fármaco se mostró eficaz para corregir los niveles de hemoglobina en grado similar al de epoetina alfa o darbepoetina alfa: la proporción de pacientes con respuesta tras tratamiento de 6 meses fue del 60% en ambos grupos, sin diferencias significativas en cuanto a los cambios en los niveles de hemoglobina. De forma interesante, también probó su no inferioridad como tratamiento de mantenimiento en pacientes con diálisis estable (> 4 meses) que usaban un estimulante de la eritropoyesis (FEE) y cambiaron a roxadustat: están en niveles objetivo de Hb el 71% de los pacientes a la semana 24 (vs. 68% en el grupo control de uso continuo de FEE).
La aparición de eventos adversos es más frecuente con roxadustat que con placebo o FEE. Las reacciones adversas notificadas con más frecuencia (> 10%) son: hipertensión, eventos trombóticos, diarrea, edema periférico, hipercalemia y náuseas. Los eventos considerados graves, entre los que sobresalen los casos de sepsis, hipercalemia, hipertensión y trombosis venosa, también fueron más frecuentes con roxadustat, lo cual se correlaciona con una mayor tasa de abandonos por motivos de seguridad (7-13%) frente a placebo y FEE.
Con una nuevo mecanismo de acción y una eficacia no inferior a la de los FEE, roxadustat se posicionará como una alternativa en pacientes NDD cuando los FEE no se consideren adecuados, con un perfil toxicológico similar pero asociado a una incidencia algo mayor de eventos adversos. En cambio, no se considerará tal alternativa en población DD, no solo por las incertidumbres relativas a su seguridad, sino porque no muestra ventajas respecto a los FEE en variables relevantes. Su principal ventaja se encuentra en la vía de administración –oral–, aunque su pauta de uso en días alternos puede mermar la adherencia. Por todo lo anterior, no parece que implique una mejora sustancial de la terapéutica estándar, dado que además se carece aún de datos de su uso a largo plazo, lo cual también limita la valoración del beneficio aportado.
Aspectos fisiopatológicos
De acuerdo a la Organización Mundial de la Salud (OMS) se define como anemia aquella afección caracterizada por una disminución del número de glóbulos rojos o de la concentración de hemoglobina dentro de estos. Constituye actualmente una de las causas más frecuentes de consulta clínica, estimándose que alrededor de un 30% de la población mundial padece anemia en diversos grados y por distintas causas, siendo la más común el déficit de hierro.
La hemoglobina es una proteína presente en alta concentración en los eritrocitos que se encarga del transporte de oxígeno hacia los tejidos, así como de llevar el dióxido de carbono desde los tejidos hacia los pulmones para su eliminación mediante la respiración. Estructuralmente, está compuesta por cuatro cadenas de proteínas globulares denominadas globinas, a cada una de las cuales se une un grupo hemo, cuya estructura está conformada por un anillo tetrapirrólico denominado protoporfirina IX, que en su centro une un catión de hierro divalente (Fe2+). Cabe recordar que existen varios tipos de globinas, que se designan con las letras del alfabeto griego. Su variabilidad condiciona, en consecuencia, la existencia de varios tipos de hemoglobina, siendo la hemoglobina A (HbA), que cuenta con dos cadenas α y dos cadenas β (α2β2), la predominante en el adulto (en una proporción aproximada del 97%); en el feto, en cambio, predomina la HbF (α2γ2), que tiene mayor afinidad por el oxígeno y permite el correcto aporte de este gas al feto a través de la sangre materna, reduciéndose sus niveles rápidamente a los pocos días del nacimiento.
Sin embargo, más allá de las formas fisiológicas de la hemoglobina, existen determinadas formas patológicas que presentan una capacidad alterada de transporte de oxígeno o que generan mayor labilidad –inestabilidad– en el eritrocito. Se dan principalmente en los trastornos conocidos como talasemias, enfermedades hereditarias en las que se produce un defecto genético que impide la formación de alguna de las cadenas de la hemoglobina (habitualmente la globina α o la globina β), y, adicionalmente, otros defectos en las cadenas de globina (debidos a mutaciones puntuales en alguno de los genes que las codifican) que se traducen en la síntesis de hemoglobinas inestables.
La anemia, con independencia de su causa1, se manifiesta clínicamente con unos rasgos característicos que son consecuencia tanto de la hipoxia celular como, especialmente, de los mecanismos de compensación que se ponen en marcha en respuesta a tal hipoxia. Así, los síntomas propios del síndrome anémico pueden incluir: fatiga o astenia, debilidad muscular generalizada, intolerancia al esfuerzo, cefalea, acúfenos, vértigos, dificultad para concentrarse y pérdida de memoria, disnea o palpitaciones. Dependiendo de la gravedad y de la causa concreta, estos síntomas pueden aparecer con mayor o menor intensidad y acompañarse o no de signos visibles durante la exploración médica como palidez mucocutánea (piel, conjuntivas, mucosas, lecho ungueal), soplo sistólico en ápex2 o foco pulmonar, taquicardia y/o signos de insuficiencia cardiaca.
Por su parte, la enfermedad renal crónica (en adelante, ERC) se define como un conjunto heterogéneo de patologías que afectan progresiva y negativamente a la estructura y función renal, con una etiopatogenia y expresión clínica variables. Los criterios diagnósticos KDIGO más ampliamente aceptados a nivel internacional describen la ERC como una tasa de filtrado glomerular (en adelante TFG) inferior a 60 ml/min/1,73 m2 o daño renal durante al menos 3 meses, diferenciándose 5 estadios de severidad creciente en adultos según el nivel de TFG: el estadio 1 se relaciona con una TFG normal o aumentada y los estadios 3 a 5 se corresponden con una TFG inferior a 60 ml/min/1,73 m2.
La ERC tiene como principal consecuencia la muerte prematura o la necesidad de tratamiento de reemplazo (diálisis o trasplante renal) en el paciente, y se asocia como una importante reducción de la calidad de vida relacionada con la salud, que es mayor conforme más avanzado es el estadio de la enfermedad. Entre sus causas subyacentes mayoritarias sobresalen la diabetes y la hipertensión en países desarrollados, y las causas de tipo infeccioso, tóxico o desconocido en regiones en vías de desarrollo.
En la actualidad constituye un problema de salud pública de relevancia creciente por la carga que representa para el sistema sanitario. Así, en Europa, la prevalencia media de ERC –en rápido aumento– está entre el 5 y el 11% de la población, si bien en adultos esa frecuencia puede ser mayor (de hasta el 15% en EE.UU.). En España, se ha descrito que la prevalencia global de ERC en los estadios más avanzados (3-5) ronda el 6,8%, con grandes diferencias entre grupos etarios: afecta a aproximadamente el 3% de las personas entre 40 y 64 años y supera el 21% a partir de los 65 años.
La anemia es una complicación frecuente e importante de los pacientes con ERC, cuya causa mayoritaria es la producción inadecuada o insuficiente de eritropoyetina (EPO) endógena a nivel renal (hormona que dirige la diferenciación y maduración de los precursores de la serie roja), aunque en los últimos años se han identificado otros factores que contribuyen su desarrollo, como una respuesta eritropoyética disminuida de la médula ósea por toxinas urémicas y el estado inflamatorio, la disminución de la disponibilidad de hierro para la eritropoyesis y el aumento de los niveles de hepcidina3, una vida media de los hematíes acortada o déficits vitamínicos (vitamina B12 o ácido fólico), entre otros. Puede tener distintas definiciones en cuanto a parámetros clínicos, pero se acepta la del descenso los niveles de hemoglobina por debajo de 12 g/dl en hombres y mujeres posmenopáusicas y por debajo de 11 g/dl en mujeres en edad fértil; otros autores hablan de niveles más restrictivos de < 13-13,5 g/dl en hombres de menos de 70 años y de < 11,5-12 g/dl en mujeres.
La anemia en ERC (en adelante, A-ERC) puede aparecer incluso en estadios precoces (2-3), pero más habitualmente se asocia con estadios más avanzados (sobre todo, en estadio 4, donde ya puede afectar a casi el 60-75% de los pacientes y los casos graves pueden superar el 10%), cuando la TFG se reduce hasta < 60 ml/min/1,73 m2 en hombres y < 40 ml/min/1,73 m2 en mujeres, y suele agravarse conforme progresa la enfermedad, afectando a alrededor del 90% de los pacientes dependientes de diálisis (estadio 5), aunque se han reportado notables diferencias de prevalencia entre países.
La propia anemia y su gravedad se relacionan con una menor calidad de vida y con un aumento del riesgo de hospitalización, de la morbimortalidad (cardiovascular, sobre todo) y progresión de la ERC, y suele asociarse con síntomas como fatiga, dificultad para respirar, trastornos cardiacos (aumento del gasto cardiaco e hipertrofia ventricular izquierda), insomnio y letargo, dolores de cabeza, mareos, falta de concentración y trastornos cognitivos, e incluso con una reducción de la libido y de la capacidad de respuesta inmunitaria (EMA, 2021).
El manejo de la anemia en ERC debe buscar la prevención o el retraso de las consecuencias clínicas asociadas a los niveles disminuidos prolongados de hemoglobina mediante la promoción de la eritropoyesis; se suelen marcar como niveles objetivo de hemoglobinemia entre 10 y 12 g/dl. Sea como fuere, el primer paso será la diferenciación del origen renal de la anemia, debiendo distinguirla de la anemia ferropénica (la más común), con la que en ocasiones puede coexistir, y de otras anemias carenciales (vitamina B12 y ácido fólico).
El tratamiento de la anemia asociada a ERC –dependiente o no de diálisis– se suele iniciar con la suplementación oral con hierro, que no suele ser suficiente por sí sola y se relaciona con posibles problemas de falta de adherencia (por su absorción variable y efectos adversos gastrointestinales), pero es necesaria para evitar la respuesta disminuida a otros fármacos. Si tras descartar o corregir otras causas de anemia el paciente tiene parámetros férricos en valores normales pero la hemoglobina se mantiene baja (< 10 g/dl), el siguiente escalón de tratamiento es la administración de fármacos estimuladores de la eritropoyesis (en adelante, FEE) y, por último, la transfusión de glóbulos rojos4.
En todo caso, por la necesidad de reservar las transfusiones para casos de pérdida severa de sangre, la única opción “realista” para estos pacientes son los FEE, que constituyen actualmente el estándar de tratamiento y cuya selección en la práctica clínica se hace teniendo en consideración tanto los beneficios derivados de una reducción del número de transfusiones de sangre como una valoración de los síntomas de la anemia frente a los riesgos potenciales del uso de los FEE (hipertensión arterial, eventos trombóticos, progresión del cáncer, etc.). En España se dispone actualmente de varios FEE para el tratamiento de la A-ERC, todos ellos formas recombinantes de la hormona EPO humana y con eficacia clínica similar: epoetina alfa (de duración de acción corta), darbepoetina alfa (de acción prolongada), epoetina zeta, metoxipropilenglicol epoetina beta y epoetina beta. Están incluidos en muy diversas presentaciones comerciales de medicamentos con distintas dosis y pautas de uso pero que comparten administraciones parenterales (intravenosa o subcutánea) bastante frecuentes, lo cual puede tener un alto impacto en pacientes y cuidadores por la necesidad de frecuentes hospitalizaciones.
Desde su primera aprobación (1988), el tratamiento con FEE se ha mostrado eficaz para el control de la anemia en pacientes con ERC, aunque su uso requiere de evaluaciones periódicas de los niveles de hierro en los pacientes antes y durante el tratamiento, recurriendo a la suplementación cuando los valores de ferritina sérica son < 100 μg/l o la saturación de transferrina es < 20%. Asimismo, se han descrito ciertos problemas de seguridad cuando se usan los FEE para lograr objetivos ambiciosos de hemoglobinemia (13-15 g/dl), que, si bien serían beneficiosos en el tratamiento de la anemia, se asocian con un aumento del riesgo de eventos adversos cardiovasculares, infarto de miocardio, ictus y mortalidad por cualquier causa que no compensaría sus potenciales ventajas.
En definitiva, los FEE se emplean con éxito en el tratamiento de la A-ERC, pero aún no se ha descrito el objetivo óptimo de hemoglobina que debe alcanzarse, que en la práctica clínica se individualiza en cada paciente (según edad, grado de actividad y comorbilidades asociadas) y suele situarse en niveles de hemoglobina en sangre de entre 10 y 12 g/dl. Además, hay una proporción de pacientes que tienen mala respuesta –o respuesta subóptima– al tratamiento con estos fármacos, que requerirían aumentos de dosis para mantener un nivel estable de hemoglobina (en caso contrario, tendrán un mayor riesgo de mortalidad). Es por ello, que se hace necesario disponer de nuevas terapias que superen estas limitaciones.
Acción y mecanismo
Roxadustat es un novedoso inhibidor de la enzima prolil hidroxilasa del factor inducible por hipoxia (HIF, por sus siglas en inglés), un factor de transcripción que regula la expresión de los genes que intervienen en la eritropoyesis5. Habida cuenta de que la activación de la ruta HIF es importante en la respuesta adaptativa a la hipoxia para aumentar la producción de eritrocitos y de que la actividad catalítica de esas enzimas controla los niveles intracelulares de HIF (al que degradan), su inhibición potente y reversible por roxadustat conduce a la acumulación de HIF funcional que estimula una respuesta eritropoyética coordinada que incluye el aumento de los niveles plasmáticos de EPO endógena, la regulación de las proteínas transportadoras de hierro (aumenta la transferrina sérica) y la reducción de la hepcidina. El resultado es la mejora dosis-dependiente de la biodisponibilidad del hierro y el aumento de la producción de hemoglobina y de la masa eritrocitaria, en base a lo cual el medicamento ha recibido aprobación en la UE para el tratamiento por vía oral de adultos con anemia sintomática asociada a ERC.
HIF es un factor de transcripción heterodimérico que contiene una subunidad α regulada por oxígeno, pues alberga un dominio de degradación dependiente de oxígeno (ODD) que se ve regulado y es hidroxilado por enzimas HIF-prolil hidroxilasas en condiciones de niveles normales de oxígeno a nivel celular. Estas enzimas, cruciales en el mantenimiento del equilibrio entre la disponibilidad de oxígeno y la actividad de HIF, son hidroxilasas de hierro no hemo dependientes de ácido cetoglutárico. Se ha descrito que roxadustat estabiliza transitoriamente las subunidades del factor HIF, lo que conduce a un efecto dosis-dependiente que mimetiza la respuesta natural del organismo a la hipoxia. Los valores de CI50 de roxadustat sobre las diversas isoenzimas investigadas en estudios in vitro se sitúan entre 0,2 y 2,5 µM, y los valores de Ki entre 0,08 y 0,36 µM, indicativos de una elevada afinidad y potencia inhibitoria del fármaco hacia las prolil hidroxilasas.
En estudios preclínicos y clínicos, se ha probado que el nuevo fármaco es capaz de corregir y/o mantener los niveles objetivo de hemoglobina por periodos de hasta 2 años en pacientes con A-ERC no dependientes de diálisis. Su capacidad para potenciar la síntesis endógena de EPO evita la necesidad de generar niveles de EPO circulantes suprafisiológicos que provocarían los tratamientos parenterales con fármacos estimuladores de la eritropoyesis, de igual modo que su efecto activador sobre la expresión de genes implicados en el metabolismo del hierro reduce la necesidad de suplementación con este metal. Adicionalmente, se ha visto en estudios in vivo con modelos animales que un tratamiento con roxadustat reduce los niveles de colesterol desde el estado basal, con independencia del uso de estatinas y otros agentes modificadores de lípidos.
Aspectos moleculares
El nombre químico del nuevo fármaco es el de ácido [[(4-hidroxi-1-metil-7-fenoxiisoquinolin-3-il) carbonil] amino]] acético, que se corresponde con la fórmula C19H16N2O5 y una masa molecular relativa de 352,34 g/mol. Con una estructura derivada de isoquinolina que no presenta estereoisómeros por la ausencia de centros quirales, roxadustat es una N-acilglicina resultante de la condensación del grupo amino de la glicina con el grupo carboxi del ácido 4-hidroxi-1-metil-7-fenoxiisoquinolina-3-carboxílico (Figura 1).
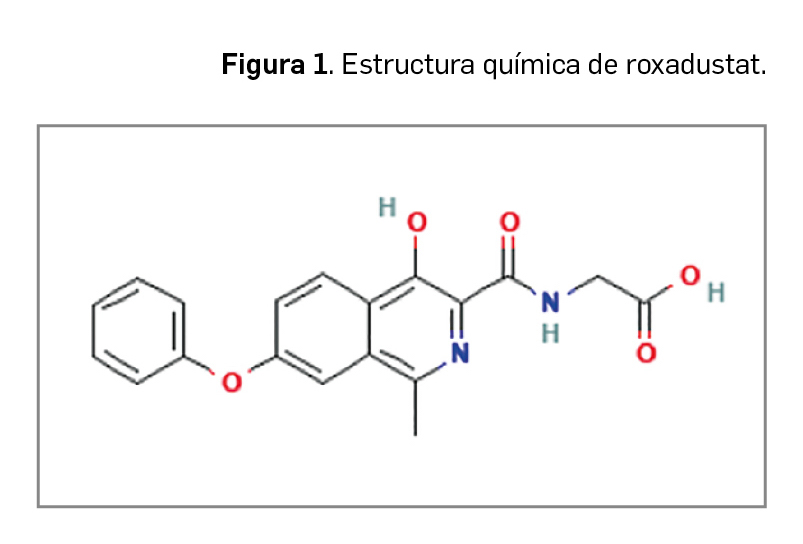
El principio activo se presenta en forma de polvo no higroscópico de color blanco a amarillo.
Los estudios de estructura-actividad de los inhibidores de HIF-prolil hidrolasa, que mimetizan a la molécula de alfa-cetoglutarato, revelan la implicación del anillo de oxiquinolina en la aportación de dos ligandos del hierro y de las “colas ramificadas” en la unión al péptido HIF (Poloznikov et al., 2022).
Eficacia y seguridad clínicas
La eficacia y la seguridad clínicas de roxadustat oral en su indicación y pauta autorizada (70-200 mg 3 veces a la semana, nunca en días consecutivos) han sido adecuadamente contrastadas en 8 ensayos clínicos6 aleatorizados de fase 3, que comparten un diseño multicéntrico, de grupos paralelos y duración mínima de 52 semanas de tratamiento; estos estudios fueron bien abiertos y controlados frente a placebo o bien doble ciego y controlados frente a un comparador activo. Incluyeron tanto pacientes con anemia asociada a ERC (A-ERC) no dependientes de diálisis y sin tratamiento previo con FEE como pacientes dependientes de diálisis, debiéndose haber descartado con anterioridad deficiencias de ácido fólico, vitamina B12 y hierro como causas de la anemia7.
El objetivo de los ensayos fue evaluar la eficacia y seguridad del nuevo fármaco en la corrección de la anemia en pacientes no tratados previamente con FEE (en ese caso la variable primaria fue la proporción de pacientes con respuesta8 durante ≥ 2 visitas consecutivas separadas ≥ 5 días) durante las 24 primeras semanas de tratamiento sin rescate y/o el mantenimiento del efecto antianémico de los FEE en pacientes ya tratados durante al menos 1 año (en los estudios que tuvieron este objetivo, la variable primaria fue el cambio promedio frente al inicio en los niveles de hemoglobina tras 28-36 semanas).
Grosso modo, las características demográficas y clínicas basales de los pacientes estuvieron bien equilibradas entre brazos de tratamiento (roxadustat y control) en todos los ensayos. La mediana de edad se situó en el rango de 55 a 69 años (un 17-31% de los pacientes entre 65 y 74 años, y un 7-35% de ≥ 75 años), la proporción de mujeres osciló entre el 41% y el 61%, y predominaron las razas blanca, afroamericana y asiática. Las causas más comunes de la ERC fueron la nefropatía diabética y la hipertensiva, situándose la mediana de los niveles basales de hemoglobinemia entre 8,6 y 10,8 g/dl.
De los estudios que incluyeron a pacientes no dependientes de diálisis (en adelante, NDD) en estadio 3-5 de su ERC y no pretratados con fármacos estimuladores de la eritropoyesis, tres de ellos fueron doble ciego y controlados con placebo (estudios ALPS, ANFES y OLYMPUS) y uno de ellos fue abierto y controlado con darbepoetina alfa como comparador activo (estudio DOLOMITES). El tratamiento con roxadustat buscaba corregir la anemia y posteriormente mantener el nivel de hemoglobina en el intervalo diana (10-12 g/dl), habida cuenta de que la práctica totalidad de los pacientes presentaba un nivel basal medio de ≤ 10 g/dl. Los criterios de inclusión en cuanto a niveles de ferritina difirieron entre estudios (de > 30 a > 100 ng/ml) y también hubo cierta variabilidad en cuanto al periodo requerido de ausencia de otros tratamientos con FEE (lo más común fue 12 semanas pre-aleatorización).
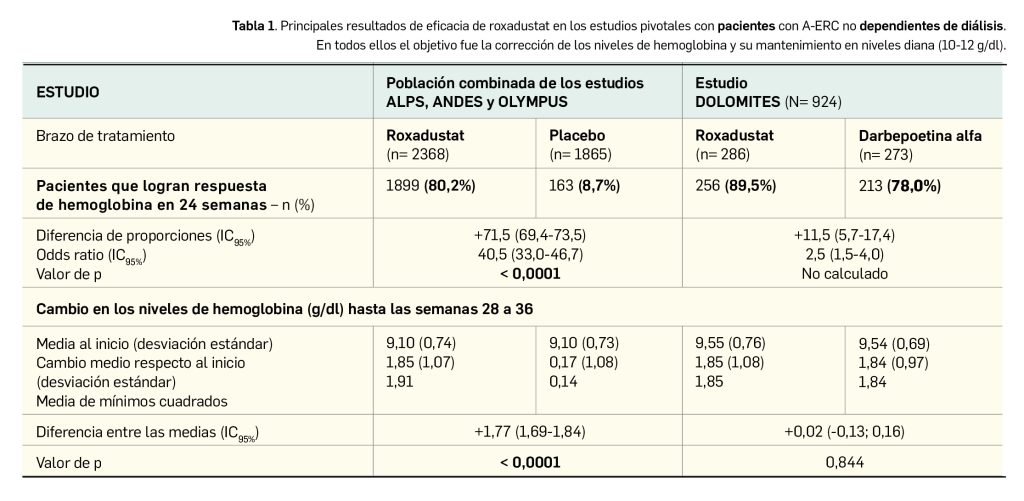
Se han divulgado resultados de los datos combinados de los tres estudios controlados con placebo –ALPS (N= 594), ANDES (N= 916) y OLYMPUS (N= 2760)–, excluyéndose los procedentes del ensayo DOLOMITES (N= 616); en ellos hasta 2386 pacientes con A-ERC fueron tratados con roxadustat y 1884 pacientes recibieron placebo. Se puso de manifiesto que el fármaco fue significativamente más eficaz que placebo en términos de respuesta de hemoglobinemia durante las primeras 24 semanas, con un cambio medio notablemente mayor en los niveles de hemoglobina desde el inicio y hasta las semanas 28 a 36. Se alcanzó un incremento con roxadustat de al menos 1 g/dl en una mediana de tiempo de 4,1 semanas. Igualmente, en la comparativa frente a control activo en el estudio DOLOMITES, roxadustat se mostró no inferior a darbepoetina alfa en la respuesta de hemoglobinemia durante las primeras 24 semanas (Tabla 1).
Por otra parte, según se ha indicado previamente, 4 estudios adicionales investigaron los efectos de la administración de roxadustat en pacientes dependientes de diálisis8 o diálisis peritoneal (en adelante, DD) en el momento basal, todos los cuales fueron abiertos y controlados por comparador activo (epoetina alfa y/o darbepoetina alfa). Sin embargo, tuvieron distintos enfoques u objetivos: corrección de la hemoglobinemia (estudio HIMALAYAS; N= 1039), mantenimiento del nivel de hemoglobina en intervalo diana tras conversión desde terapia previa con FEE (estudios SIERRAS y PYRENEES; N= 740 y 834, respectivamente), o una combinación de ambos enfoques (estudio ROCKIES; N= 2101). En conjunto, 2354 pacientes recibieron roxadustat y 2360, un FEE. Todos ellos debían tener niveles de ferritina de ≥ 100 ng/ml en el momento basal y haber recibido algún FEE por vía parenteral durante al menos las 8 semanas anteriores (excepto en el estudio HIMALAYAS, que excluyó pacientes pretratados en los 3 meses previos).
Los resultados divulgados recogen la demostración de no inferioridad del nuevo fármaco respecto al tratamiento con FEE en el grupo de pacientes con ERC dependientes de diálisis: roxadustat se probó eficaz para alcanzar y mantener los niveles diana de hemoglobinemia hasta las semanas 28 a 36, con independencia del uso previo o no de FEE, y también proporcionó una tasa de pacientes respondedores similar a la del control activo durante las primeras 24 semanas (Tabla 2).
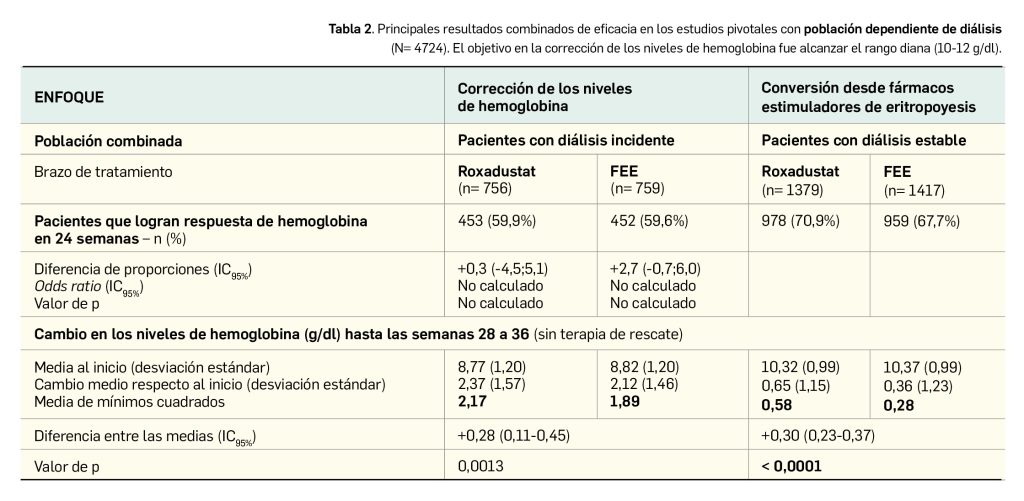
De modo interesante, el tratamiento de corrección en el estudio HIMALAYAS reveló una tasa de respuesta del 88,2% con roxadustat frente al 84,4% con epoetina alfa, con un valor de p que confirmó la no inferioridad entre tratamientos. Asimismo, el tratamiento de corrección en el estudio ROCKIES se tradujo en similares incrementos medios de hemoglobina respecto al inicio en ambos grupos (+0,88 g/dl vs. +0,74; p< 0,001). En las pautas de mantenimiento (conversión desde FEE) evaluadas en los ensayos PYRENEES y SIERRAS, la no inferioridad de roxadustat frente a los FEE parece manifiesta, incluso con tendencia numérica a la superioridad: aumentos de 0,49 vs. 0,21 g/dl de hemoglobina en el primero y 0,63 vs. 0,09 g/dl en el segundo estudio.
Complementariamente, los resultados de las variables secundarias en los 8 estudios tuvieron consistencia y respaldaron los de la variable principal, viéndose, por ejemplo, algunos hallazgos reseñables, como los siguientes:
- Una mayor proporción de pacientes con anemia asociada a ERC y no dependientes de diálisis que recibieron roxadustat alcanzó niveles elevados de hemoglobina (> 12-13 g/dl) respecto a los tratados con placebo y con comparador activo.
- Se vio una menor necesidad de terapia de rescate entre los pacientes del grupo roxadustat frente a placebo (HR: 0,19; reducción de casi el 80% en la población NDD), sin diferencias destacables cuando se comparaba frente a AEE.
- Roxadustat redujo en líneas generales los niveles de hepcidina y ferritina y aumentó el nivel de hierro sérico, mientras que la saturación de transferrina se mantuvo estable a lo largo del tiempo.
- Se vio una reducción del colesterol LDL (descensos de entre -0,36 y -0,60 mmol/l) y HDL en los pacientes tratados con roxadustat, significativa en la comparación frente a placebo y a comparador activo, tanto en población NDD como en población DD. El efecto en el colesterol LDL fue independiente del uso de estatinas y condujo a una reducción del cociente LDL/HDL.
- No obstante, hubo una importante variabilidad en las variables de calidad de vida (medida fundamentalmente por el cuestionario SF-36, no específico de ERC), sin confirmarse una superioridad de roxadustat frente a placebo ni diferencias significativas respecto a otros FEE, como tampoco se observó ningún efecto del fármaco relacionado con un retraso en el empeoramiento de la función renal respecto placebo.
Finalmente, el perfil de seguridad de roxadustat parece bien caracterizado con datos de casi 6900 pacientes con anemia asociada a ERC (la mitad NDD y la otra mitad DD) que recibieron al menos una dosis del fármaco durante su desarrollo clínico. La duración media del tratamiento osciló entre 50 y 88 semanas, por lo que los datos de seguridad a largo plazo son limitados (solo el 7-13% de los pacientes tratados con roxadustat lo recibieron por periodos de 3 años). Aunque con ciertas diferencias entre la población NDD y DD, en líneas generales todos los estudios revelaron una elevada tasa de abandonos del tratamiento (34-66%), siendo los motivados por eventos adversos más frecuentes con roxadustat (7-11%) que con placebo (5-7%) o con otros FEE. Esto se correlacionó con la mayor notificación de eventos adversos en los pacientes que recibieron el nuevo fármaco frente a los controles; los más frecuentemente reportados como asociados a roxadustat (≥ 10%) fueron: hipertensión (13,9%), trombosis del acceso vascular9 (12,8%), diarrea (11,8%), edema periférico (11,7%), hipercalemia (10,9%) y náuseas (10,2%).
Las recciones adversas graves no fatales también fueron más incidentes con roxadustat que con placebo o FEE, sobresaliendo los casos de sepsis (3,4%), hipercalemia (2,5%), hipertensión (1,4%) y trombosis venosa profunda (1,2 %). No obstante, los casos relacionados directamente con el tratamiento no fueron demasiado comunes (2,3-5% con roxadustat vs. 1,0% con placebo y 1,6-2% con epoetina/darbepoetina alfa). Adicionalmente, se consideraron como de especial interés los riesgos de aparición de pancreatitis aguda, alteraciones hepáticas, tumores, alteraciones de la retina y rabdomiólisis/miopatía.
Mención aparte merecen los análisis realizados sobre datos agrupados de seguridad cardiovascular del nuevo fármaco, el principal signo de preocupación en su perfil toxicológico, dada la relación directa entre el grado de ERC y la mortalidad por causas cardiovasculares. Los resultados revelan que la incidencia de eventos cardiovasculares graves –infartos, ictus, hospitalización por angina inestable o insuficiencia cardiaca– es más probable (HR: 1,26) con el fármaco respecto a placebo en pacientes no dependientes de diálisis, como también lo es la mortalidad por cualquier causa (HR: 1,16). Además, en pacientes con diálisis estable también se ha sugerido un aumento de esos riesgos con el cambio a roxadustat respecto al mantenimiento de otros FEE (HR: 1,18 y 1,23, respectivamente). El riesgo parece aumentar en pacientes no respondedores a roxadustat o en aquellos de difícil tratamiento que reciben altas dosis de FEE antes del cambio (AEMPS, 2021; AEMPS, 2022).
Aspectos innovadores
Roxadustat es un novedoso inhibidor de molécula pequeña de la enzima prolil hidroxilasa del factor inducible por hipoxia (HIF), un factor de transcripción que regula la expresión de los genes que intervienen en la eritropoyesis y cuya activación es importante en la respuesta adaptativa a la hipoxia para aumentar la producción de eritrocitos. Habida cuenta de que la actividad de esas enzimas prolil hidroxilasas controlan los niveles intracelulares de HIF mediante su degradación, su inhibición reversible por roxadustat estimula una respuesta eritropoyética coordinada que incluye el aumento de los niveles plasmáticos de EPO endógena, la regulación de las proteínas transportadoras de hierro y la reducción de la hepcidina. El resultado es la mejora de la biodisponibilidad del hierro y el aumento de la producción de hemoglobina y de la masa eritrocitaria, en base a lo cual el medicamento ha sido autorizado para el tratamiento por vía oral de adultos con anemia sintomática asociada a ERC (A-ERC).

Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica de Evrenzo® (roxadustat). 2021. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/1211574005/FT_1211574005.html.pdf.
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de Roxadustat (Evrenzo®) en anemia sintomática asociada a enfermedad renal crónica. PT 78-2022/V1/24102022. 2022. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/2022/IPT-78-2022-Evrenzo-roxadustat.pdf.
-
- Barratt J, Andric B, Tataradze A, Schömig M, Reusch M, Valluri U et al. Roxadustat for the treatment of anaemia in chronic kidney disease patients not on dialysis: a Phase 3, randomized, open-label, active-controlled study (DOLOMITES). Nephrol Dial Transplant. 2021; 36(9): 1616-28. DOI: 10.1093/ndt/gfab191.
-
- Barratt J, Dellanna F, Portoles J, Choukroun G, De Nicola L, Young J et al. Safety of Roxadustat Versus Erythropoiesis-Stimulating Agents in Patients with Anemia of Non-dialysis-Dependent or Incident-to-Dialysis Chronic Kidney Disease: Pooled Analysis of Four Phase 3 Studies. Adv Ther. 2023; 40(4): 1546-59. DOI: 10.1007/s12325-023-02433-0.
-
- Csiky B, Schömig M, Esposito C, Barratt J, Reusch M, Valluri U et al. Sulowicz W. Roxadustat for the Maintenance Treatment of Anemia in Patients with End-Stage Kidney Disease on Stable Dialysis: A European Phase 3, Randomized, Open-Label, Active-Controlled Study (PYRENEES). Adv Ther. 2021; 38(10): 5361-80. DOI: 10.1007/s12325-021-01904-6.
-
- European Medicines Agency (EMA). Evrenzo®. European Public Assessment Report (EPAR). 2021. EMA/CHMP/393136/2021. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/evrenzo-epar-public-assessment-report_en.pdf.
-
- Fishbane S, El-Shahawy MA, Pecoits-Filho R, Van BP, Houser MT, Frison L et al. Roxadustat for Treating Anemia in Patients with CKD Not on Dialysis: Results from a Randomized Phase 3 Study. J Am Soc Nephrol. 2021; 32(3): 737-55. DOI: 10.1681/ASN.2020081150.
-
- Fishbane S, Pollock CA, El-Shahawy M, Escudero ET, Rastogi A, Van BP, Frison L et al. Roxadustat Versus Epoetin Alfa for Treating Anemia in Patients with Chronic Kidney Disease on Dialysis: Results from the Randomized Phase 3 ROCKIES Study. J Am Soc Nephrol. 2022; 33(4): 850-66. DOI: 10.1681/ASN.2020111638.
-
- Poloznikov AA, Nikulin SV, Hushpulian DM, Khristichenko AY, Osipyants AI et al. Structure-Activity Relationships and Transcriptomic Analysis of Hypoxia-Inducible Factor Prolyl Hydroxylase Inhibitors. Antioxidants (Basel). 2022; 11(2): 220. DOI: 10.3390/antiox11020220.
-
- Shutov E, Sułowicz W, Esposito C, Tataradze A, Andric B, Reusch M et al. Roxadustat for the treatment of anemia in chronic kidney disease patients not on dialysis: a Phase 3, randomized, double-blind, placebo-controlled study (ALPS). Nephrol Dial Transplant. 2021; 36(9): 1629-39. DOI: 10.1093/ndt/gfab057.
1 Dependiendo de la causa subyacente, pueden aparecer síntomas muy diversos además de los característicos de la anemia.
2 El ápex es la zona que se sitúa entre la línea clavicular media y la línea axilar anterior, a la altura del quinto espacio intercostal izquierdo.
3 La hepcidina es una proteína reguladora del hierro que aumenta durante la inflamación en la ERC: esos mayores niveles provocan la degradación de ferroportina, impidiendo la absorción de hierro a nivel intestinal e induciendo su acumulación en macrófagos.
4 Aunque hay cierta incertidumbre, las guías clínicas sugieren el inicio de las transfusiones de glóbulos rojos para la corrección inmediata de la anemia o de la anemia crónica en ausencia de síntomas cuando los niveles de hemoglobina son menores a 7,0 g/dl. Las transfusiones, no obstante, no están exentas de problemas: se asocian con riesgo de introducción de patógenos, de hiperpotasemia, de sobrecarga de volumen y, con especial importancia, también con un riesgo de alosensibilización que reduce las posibilidades a largo plazo de tener un donante de riñón compatible para pacientes elegibles para trasplante y puede provocar tiempos de espera de trasplante más prolongados.
5 Por ejemplo, HIF promueve la expresión de genes relacionados con la síntesis de EPO, de los receptores de EPO, de las proteínas que promueven la absorción de hierro, el trasporte de hierro y la síntesis del grupo hemo.
6 Por ser alto el número de estudios incluidos en el desarrollo del fármaco, sus resultados se sintetizan de forma más breve que en la evaluación de otros fármacos, para asegurar una longitud razonable del presente artículo.
7 Por ejemplo, se excluyeron pacientes tratados con quelantes de hierro 4 semanas antes de la aleatorización, transfusiones sanguíneas 8 semanas antes o si coexistían circunstancias que pudieran provocar pérdida de sangre; en los estudios con pacientes no dependientes de diálisis la administración previa de hierro intravenoso 6-12 semanas antes fue también criterio de exclusión.
8 La respuesta al tratamiento se definió por un valor de hemoglobina ≥ 11 g/dl y un incremento de ≥ 1 y ≥ 2 g/dl en pacientes con un valor de hemoglobina basal > 8 g/dl y ≤ 8 g/dl, respectivamente.
9 La definición de la dependencia de diálisis varió entre los distintos estudios: en PYRENEES se exigía un periodo de “diálisis estable” superior a 4 meses, lo cual refleja el enfoque de conversión de un tratamiento con AEE; en HIMALAYAS se requería una “diálisis incidente” de duración de ≥ 2 semanas pero ≤ 4 meses, que refleja el enfoque de corrección de Hb; y los estudios SIERRAS y ROCKIES combinaron pacientes de ambos tipos (80-90% de pacientes con diálisis estable y 10-20% de diálisis incidente)
10 Roxadustat se ha asociado a un aumento de eventos tromboembólicos (embolia pulmonar, trombosis venosa profunda y trombosis del acceso venoso) respecto a placebo y otros FEE, la mayoría de ellos graves. La trombosis venosa profunda se notificó como evento frecuente y la embolia pulmonar como poco frecuente; la trombosis del acceso venoso fue “muy frecuente” entre pacientes que recibieron diálisis.
11 No se considera una alternativa en pacientes sin diálisis que estén bien controlados con fármacos estimulantes de la eritropoyesis, ya que no se dispone de datos en este contexto.
12 En esa línea se posicionó también el NICE británico: solo lo considera como opción de tratamiento en pacientes que no se encuentran en diálisis al inicio del tratamiento. La FDA estadounidense no lo ha autorizado con la indicación aprobada en la UE.



