Tucatinib en cáncer de mama avanzado HER2+
 Nº468
Nº468
Resumen
Tucatinib es un nuevo inhibidor de tirosina cinasa antineoplásico selectivo para HER2, un receptor de membrana cuya sobreexpresión en determinados tipos de cáncer, como el de mama, se asocia a un peor pronóstico. La activación del receptor HER2 favorece el crecimiento y la proliferación celular, aumentando también el riesgo de metástasis. En base a este mecanismo, tucatinib ha sido autorizado en la Unión Europea con indicación, en combinación con trastuzumab y capecitabina, para el tratamiento de pacientes adultos con cáncer de mama HER2-positivo localmente avanzado o metastásico que hayan recibido por lo menos dos pautas de tratamiento anti-HER2 anteriores.
La eficacia de tucatinib ha sido examinada en un estudio pivotal de fase 2 aleatorizado y doble ciego. Se comparó la adición de tucatinib a un régimen combinado con trastuzumab y capecitabina con la adición de placebo a este mismo régimen, con el objetivo de analizar la SLP como variable principal. La mediana de SLP alcanzada tras 10 meses de seguimiento fue superior para el grupo que recibió tucatinib (7,8 vs. 5,6 meses), con una reducción de aproximadamente el 45% del riesgo de progresión (HR: 0,544; p < 0,00001). Además, estos resultados fueron muy similares en el subgrupo de pacientes con metástasis cerebral, con una SLP de 7,6 vs. 5,4 meses (HR: 0,483; p < 0,00001). La SG estimada, variable secundaria en este estudio, fue también superior en el brazo de tucatinib con un seguimiento de 14 meses (21,9 vs. 17,4 meses; HR: 0,662; p = 0,0048). Con un seguimiento de 29,6 meses, en un análisis exploratorio se obtuvo el mismo dato de SG en el grupo de tucatinib vs. 12,5 meses con placebo.
En relación al perfil de seguridad del nuevo fármaco, el evento adverso más común fue la diarrea, más frecuente que entre quienes recibieron placebo (82% vs. 54%). Otros eventos adversos frecuentes, también más comunes con tucatinib, fueron eritrodisestesia palmoplantar (65% vs. 53%), náuseas (60% vs. 45%) y fatiga (48% vs. 44%). La hepatotoxicidad se ha considerado, junto con la diarrea, un aspecto de seguridad importante para tucatinib. Aunque los eventos identificados de toxicidad hepática se consideraron por lo general manejables, la frecuencia observada en el régimen con tucatinib fue superior (44% vs. 26%), así como la de eventos de grado ≥ 3 (10% vs. 5%).
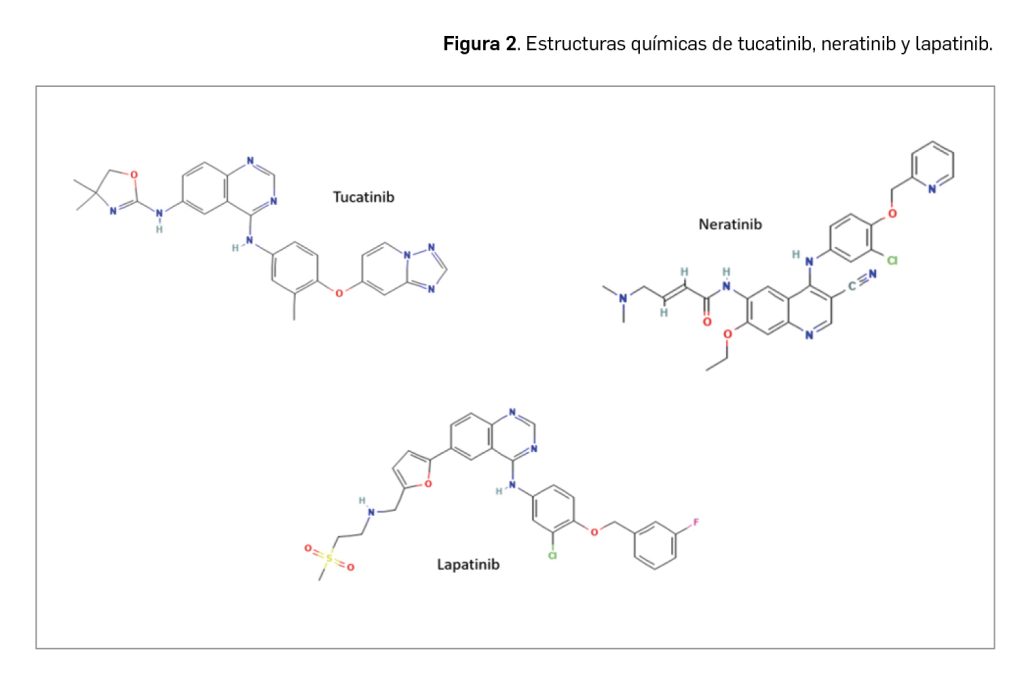
Tucatinib cuenta con un mecanismo de acción ya conocido para otros agentes antineoplásicos empleados en cáncer de mama HER2+ (como neratinib o lapatinib). Sin embargo, el nuevo inhibidor de tirosina cinasa se encuentra autorizado en una indicación para la que actualmente no existe un estándar de tratamiento. Específicamente en pacientes con metástasis cerebrales, por ahora no se dispone de alternativas terapéuticas, por lo que el beneficio observado en SLP con tucatinib, aunque de limitada magnitud, puede considerarse clínicamente relevante. A la espera de disponer de datos más maduros respecto a los aspectos más inciertos sobre la toxicidad del nuevo fármaco –principalmente su potencial hepatotóxico–, se puede concluir que la adición de tucatinib a un régimen combinado con trastuzumab y capecitabina implica una mejora en el abordaje de pacientes altamente pretratadas y con mal pronóstico.
Aspectos fisiopatológicos
El cáncer de mama es una neoplasia que se produce en el tejido mamario, y se desarrolla en el 99% de los casos en mujeres. Dependiendo de la zona específica en la que se produce el crecimiento celular descontrolado podemos distinguir entre el carcinoma ductal, más frecuente, que se genera en los conductos –ductos o dúctulos– que llevan la leche desde la mama hasta el pezón, y el carcinoma lobulillar, que comienza en los lobulillos que producen la leche materna (Figura 1). En cualquier caso, el cáncer de mama es una enfermedad heterogénea, compuesta por distintos subtipos moleculares con comportamientos diferentes.
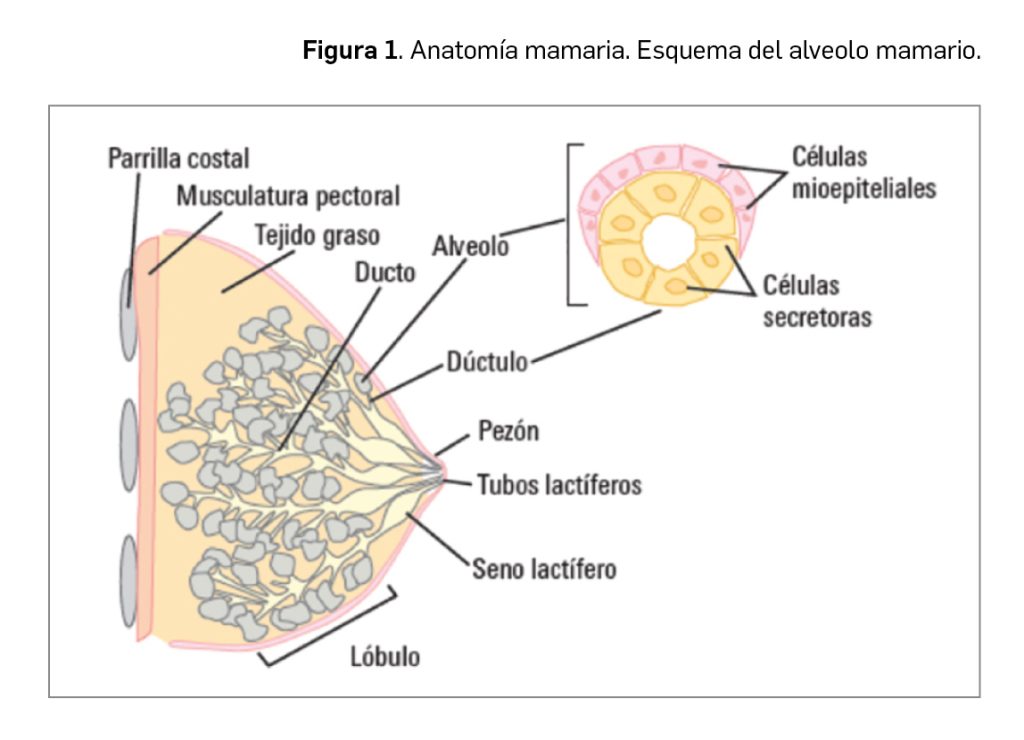
En el momento del diagnóstico es posible que no existan síntomas, especialmente si el descubrimiento se produce en una mamografía de control. No obstante, es posible que la paciente pueda notar la presencia de un nódulo en la mama, dolor en la palpación, cambios en el tamaño de alguna de las mamas, alteraciones en la piel de la mama, cambios en el pezón (retracción, secreción) o aparición de un nódulo en la axila.
En líneas generales, se trata del cáncer más común en mujeres (también si se consideran ambos sexos, incluso por encima del cáncer de pulmón) y se estima que aproximadamente una de cada ocho mujeres lo padecerá en algún momento de su vida. Según se ha sugerido, representa el 20-30% de todos los casos de cáncer y continúa siendo la primera causa de muerte por cáncer en el sexo femenino a nivel global. De acuerdo a los datos de Eurostat (2018), la tasa estandarizada de mortalidad en España por esta causa fue de 23,4/100 000 habitantes, la más baja de la UE, si bien también es la primera causa de muerte por cáncer en mujeres, y la cuarta si se consideran ambos sexos (SEOM, 2022). Además, la incidencia en nuestro país va en aumento, probablemente debido al incremento de la esperanza de vida y al alto grado de concienciación en la población sobre la importancia de la detección precoz, que se acompaña de programas de cribado con mamografía. El éxito de estos programas ha situado a España entre los países de la UE en los que más mamografías se realizan a mujeres de entre 50-69 años (Eurostat, 2018).
Los principales factores de riesgo para el desarrollo del cáncer de mama son la edad avanzada1, la raza (es más frecuente en las mujeres de raza blanca), el consumo de alcohol, una menarquia temprana, una menopausia tardía, haber padecido previamente un cáncer de mama, la ausencia de embarazo (nuliparidad) o un primer embarazo tardío, la terapia hormonal sustitutiva prolongada y un historial familiar de cáncer de mama. Respecto a este último factor, a pesar de que en aproximadamente la mitad de los casos no se puede asociar la aparición de la enfermedad con una mutación o disfunción génica concreta, sí se conoce la relación del cáncer de mama con una actividad aberrante en determinados genes, principalmente BRCA-1 (breast cancer-1), BRCA-2 (breast cancer-2), CHEK2 y TP53.
El tratamiento del cáncer de mama dependerá en buena medida del estadio en que se encuentre el cáncer en el momento de diagnóstico. Si hablamos de un carcinoma ductal in situ (estadio 0), la cirugía puede ser suficiente y, en caso de que exista sobreexpresión de receptores hormonales (RH), se puede realizar terapia hormonal adyuvante. En los estadios I-III se encuentra un tumor de mayor tamaño y ya es posible encontrar cierta diseminación a ganglios linfáticos (mayor cuanto más avanzado es el estadio). En estos casos, además de la cirugía se debe realizar un tratamiento con radioterapia o quimioterapia, que incluirá también una terapia adyuvante o neoadyuvante frente al receptor HER2 cuando éste se encuentre sobreexpresado (HER2+). La terapia neoadyuvante puede ayudar a reducir el tamaño del tumor antes de la cirugía. Cuando ya existen metástasis (estadio IV) el tratamiento puede ser similar al anterior pero complementado con tratamientos específicos dirigidos a aliviar los síntomas de las zonas donde se ha producido la metástasis. El tratamiento en estadio IV está dirigido a contener el crecimiento del tumor durante el mayor tiempo posible y mejorar la calidad de vida de la paciente, sin fines curativos actualmente.
Por otra parte, la presencia de receptores hormonales en las células tumorales es un elemento a considerar en el diagnóstico, en el tratamiento e incluso en el pronóstico del cáncer de mama. Los principales receptores hormonales de interés a este respecto son los de estrógenos y los de progesterona. Alrededor de tres cuartas partes de los carcinomas mamarios diagnosticados son positivos a receptores estrogénicos (RE+): tal hecho permitió abrir una vía terapéutica que consiste bien en el uso de bloqueadores de los receptores de estrógenos, como tamoxifeno o fulvestrant, o bien en la inhibición de la producción de estrógenos (inhibidores de la aromatasa), mediante fármacos como anastrozol, letrozol o exemestano. Los carcinomas RE+ tienen por lo general un mejor pronóstico que aquellos en los que no hay sobreexpresión de receptores hormonales estrogénicos (RE-).
En los casos de tumores RE- localizados o localmente avanzados, el tratamiento farmacológico se basa en el empleo de agentes quimioterapéuticos citotóxicos (Tabla 1). Se pueden destacar por su uso en cáncer de mama los siguientes:
- Antraciclinas como la doxorubicina y la epirubicina, que actúan como intercalantes, constituyen tratamientos de primera línea en el cáncer de mama, en monoterapia o combinadas con otros agentes como ciclofosfamida o 5-fluorouracilo. Hoy en día existen presentaciones de antraciclinas liposomadas o pegiladas, lo cual ha permitido reducir su toxicidad cardiaca y mejorar el perfil general de efectos adversos.
- Los taxanos, que actúan como antimitóticos por interferencia con los microtúbulos citoplasmáticos, son también de interés terapéutico en este tipo de neoplasias. Paclitaxel y docetaxel son fármacos muy activos en el cáncer de mama, con tasas de respuesta en monoterapia del 35% al 45% y del 35% al 60%, respectivamente.
- La capecitabina se metaboliza a 5-fluorouracilo, un inhibidor de la timidilato sintasa esencial para la síntesis de timidina, lo que interfiere en la síntesis de novo del ADN. Ha mostrado su capacidad para inducir una tasa de respuesta entre el 20% y el 40% en monoterapia. Su combinación con docetaxel aumenta la eficacia.
Con independencia de si hay o no una presencia relevante de receptores hormonales en las células tumorales, el pronóstico del cáncer de mama está fuertemente condicionado, como se ha sugerido previamente, por la presencia o ausencia en la superficie de la célula tumoral del receptor 2 del factor de crecimiento epidérmico humano (HER2), también denominado homólogo 2 del oncogén viral de la leucemia paneritroblástica (ErbB-2). Por ejemplo, los tumores de mama positivos para el receptor de hormonas (RH+) y negativos para el receptor del factor de crecimiento epidérmico humano 2 (HER2-), que dependen de los estrógenos para su supervivencia y crecimiento2, tienen mejor pronóstico en estadios avanzados que el conjunto de cánceres de mama metastásicos, siendo la mediana de supervivencia global (en adelante, SG) en este subgrupo de entre 2,5-4 años; en la actualidad aproximadamente un tercio de las pacientes con cáncer de mama metastásico RH+/HER2- están vivas más allá de los 5 años.
Según se ha indicado, el HER2 es un tipo de receptor transmembrana que pertenece a la familia de receptores del factor de crecimiento epidérmico (EGF, por sus siglas en inglés) y está también relacionado con la proliferación y la diferenciación celular, con un papel relevante en el desarrollo del tejido mamario. A pesar de que no se conocen ligandos de alta afinidad que se unan a los dominios extracelulares del receptor, sí se ha descrito su activación por unión a otros receptores de la misma familia (dimerización), lo que conduce a que se produzca la fosforilación de los dominios intracelulares a través de una tirosina cinasa (TK) intrínseca. Esto deriva en la activación de diversas cascadas de señalización mediante segundos mensajeros, entre las que destacan las vías de las MAP cinasas y PI3 cinasas, responsables en buena medida de la función de proliferación y diferenciación celular.
Sin embargo, la sobreexpresión del receptor HER2 en el cáncer de mama exacerba las funciones mencionadas, favoreciendo una elevada resistencia a la apoptosis en la célula tumoral, la proliferación y el desarrollo de metástasis. Esta sobreexpresión se produce en un 20-30% de los carcinomas mamarios diagnosticados y se asocia a un peor pronóstico por aumento de la agresividad tumoral y la frecuencia de recidivas y se asocia también a una menor supervivencia. La importancia terapéutica de este descubrimiento fue notable, dado que ha supuesto la apertura de una nueva vía de tratamientos farmacológicos diseñados específicamente para contrarrestar la actividad de HER2. Esto se ha conseguido hasta la fecha principalmente mediante cuatro fármacos con mecanismos de acción distintos y, en ocasiones, complementarios, que se describen a continuación.
- Trastuzumab es un anticuerpo monoclonal dirigido específicamente a la porción extracelular del receptor HER2, lo que provoca la inhibición del receptor y su destrucción a través de una respuesta citotóxica mediada por células. Está aprobado para uso en monoterapia, en combinación con quimioterapia o en combinación con un inhibidor de la aromatasa para tratamiento del cáncer de mama metastásico o precoz positivo para HER2. La introducción de trastuzumab supuso un aumento de la supervivencia libre de enfermedad y una reducción de las recaídas. El ensayo pivotal conducente a su autorización probó que la combinación con epirubicina-ciclofosfamida y paclitaxel aumentaba la respuesta respecto al solo uso de los agentes quimioterápicos (50% vs. 32%), prolongaba su duración en 3 meses (desde 6,1 a 9,1 meses), mejoró la mediana de SG (17,9 meses vs. 24,8 meses) y redujo la probabilidad de muerte en un 20%. En un estudio de seguimiento durante 11 años en el que se incluyó a 5.102 pacientes, el tratamiento con trastuzumab durante un año aumentó significativamente la SG en comparación con el grupo control (HR: 0,74; IC95%: 0,64-0,86).
- Trastuzumab emtansina (T-DM1) es un conjugado anticuerpo-fármaco formado por trastuzumab unido mediante un enlace covalente al inhibidor de microtúbulos DM1. Esta combinación aumenta la selectividad por las células que sobreexpresan HER2: al producirse la unión al receptor, mediada por trastuzumab, el conjugado es internalizado por la célula y degradado en los lisosomas, lo que produce la liberación de los catabolitos citotóxicos de DM1, que inhiben la tubulina. Tiene indicación como tratamiento único del cáncer de mama precoz o metastásico HER2+ en pacientes que previamente han recibido un taxano y otra terapia dirigida frente a HER2. Los principales efectos adversos descritos, como náuseas, hemorragia o dolor de cabeza, por lo general presentan un carácter leve, si bien se han documentado reacciones adversas de grado 3 y 4, como trombocitopenia, aumento de transaminasas, anemia o hipopotasemia.
- Trastuzumab deruxtecán es un fármaco inmunoconjugado que combina trastuzumab con un inhibidor de la topoisomerasa I. La unión específica del fármaco a las células tumorales permite la internalización del conjugado y la posterior escisión de deruxtecán tras la digestión lisosomal del enlazador. La liberación permite que el inhibidor de la topoisomerasa I ejerza su acción impidiendo la replicación y la transcripción del ADN y conduciendo así a la muerte celular. Deruxtecán presenta una alta permeabilidad que facilita su diseminación en la zona tumoral a otras células cercanas, lo que se conoce como bystander effect. Así, trastuzumab deruxtecán ha sido aprobado con indicación en el tratamiento de pacientes adultos con cáncer de mama HER2-positivo no resecable o metastásico que han recibido una o más pautas previas dirigidas a HER2.
- Pertuzumab es un monoclonal que impide la dimerización de HER2 por unión a su subdominio de dimerización II, inhibiendo así el inicio de la señalización intracelular desencadenado por la autofosforilación. Solo se encuentra aprobado en España en combinación con trastuzumab, pues la asociación ejerce una eficacia sinérgica y no se ha observado un incremento inaceptable de la toxicidad. De los dímeros que forma HER2, el heterodímero HER2-HER3 es el que con mayor potencia contribuye a activar la proliferación tumoral, por lo que su bloqueo por pertuzumab dificulta la aparición de resistencias al tratamiento con trastuzumab y mejora su eficacia. Se usará para el tratamiento de pacientes con cáncer de mama precoz y alto riesgo de recaída.
- Lapatinib es un inhibidor de los dominios intracelulares de los receptores HER1 y HER2. Actualmente, se encuentra aprobado para el tratamiento del cáncer de mama con sobreexpresión de HER2 en combinación con capecitabina o con trastuzumab en pacientes que han mostrado respuesta previa al tratamiento con trastuzumab. Sin embargo, tras una mediana de 6,9 años de seguimiento de las pacientes incluidas en el ensayo pivotal, no se encontraron diferencias significativas en SG entre el tratamiento combinado de lapatinib con trastuzumab y trastuzumab en monoterapia. También está indicado en combinación con un inhibidor de la aromatasa en mujeres posmenopáusicas en las que se desaconseja la quimioterapia. Su uso puede provocar reacciones adversas graves (grado 3 o 4) como arritmias, neumonitis o diarrea intensa, que pueden requerir la interrupción temporal del tratamiento, la reducción de la dosis o incluso su suspensión definitiva.
- Neratinib: es un inhibidor irreversible de la tirosina cinasa del receptor HER2 (también de HER1 y HER4 y sus heterodímeros con HER3) estructuralmente relacionado con lapatinib y de reciente introducción en España. A través de un enlace de alta afinidad al sitio de unión del ATP, bloquea la cascada de señalización intracelular que se desencadena como resultado de la activación por dimerización de HER2. Así, detiene la proliferación de la neoplasia activada por la sobreexpresión de este receptor. En España, está aprobado en el tratamiento adyuvante extendido de cáncer de mama en estadio inicial con receptor hormonal positivo y sobreexpresión/amplificación de HER2, que hayan finalizado el tratamiento de trastuzumab hace menos de un año.
Otras líneas terapéuticas usadas en tumores HER2+ se orientan a frenar la vasculogénesis y la angiogénesis en el contexto metastásico, como es el caso del anticuerpo monoclonal bevacizumab. La diana de este anticuerpo monoclonal es el factor de crecimiento del endotelio vascular (VEGF), cuya neutralización frena el crecimiento tumoral al impedir la formación de nuevos vasos sanguíneos.
A pesar de los avances terapéuticos que se han producido en los últimos años, el cáncer de mama HER2+ no resecable o metastásico continúa siendo una enfermedad incurable y de mal pronóstico, especialmente cuando existen metástasis cerebrales, para las cuales no hay disponibles tratamientos sistémicos por el momento (EMA, 2021).
Acción y mecanismo
Tucatinib es un nuevo agente antineoplásico que actúa como inhibidor de tirosina cinasa selectivo para HER2, un receptor de membrana cuya sobreexpresión en determinados tipos de cáncer, como el de mama, se asocia a un peor pronóstico. Esto se debe a que HER2 promueve el crecimiento y la proliferación celular. En base a este mecanismo, tucatinib ha sido autorizado en la Unión Europea con indicación, en combinación con trastuzumab y capecitabina, para el tratamiento de pacientes adultos con cáncer de mama HER2-positivo localmente avanzado o metastásico que hayan recibido por lo menos dos pautas de tratamiento anti-HER2 anteriores.
En ensayos in vitro en la línea celular BT-474 se ha podido comprobar la capacidad de inhibición de tucatinib sobre la fosforilación de HER2 y HER3 a concentraciones nanomolares. También se ha observado en distintas líneas celulares de cáncer de mama el potencial antitumoral de tucatinib, que está directamente relacionado con la concentración de receptores de HER2 expresados en la membrana celular, con una concentración efectiva media (CE50) de < 500 nM en líneas con una expresión superior a 300 000 receptores HER2/célula y de < 100 nM en líneas con una expresión cercana o superior a 1 000 000 de receptores HER2/célula (EMA, 2021).
Los estudios preclínicos también han mostrado, tanto in vitro como in vivo, una capacidad antitumoral superior con la combinación de tucatinib y trastuzumab en comparación con cada uno de los fármacos por separado (AEMPS, 2023).
Aspectos moleculares
Tucatinib (Figura 2) es un inhibidor de tirosina cinasa que cuenta con la estructura N6-(4,5-dihidro-4,4-dimetil-2-oxazolil)-N4-[3-metil-4-([1,2,4]triazolo[1,5-a]piridin-7-iloxi)fenil] -4,6-quinazolinodiamina, correspondiéndose con la fórmula molecular C26H24N8O2. Su peso molecular es de 480,5 g/mol.
Se formula comercialmente como tucatinib hemietanolato. La sustancia purificada es un polvo no higroscópico de color blanquecino o amarillo. Es prácticamente insoluble en agua, pero en soluciones con tampón ácido (por debajo de pH 4) es altamente soluble.
Como es habitual en otros inhibidores de tirosina cinasa que contienen un anillo de quinazolina (como lapatinib), cabe esperar que tucatinib se una al sitio del ATP de HER2 como un inhibidor reversible y competitivo (Kulukian et al., 2020).
Eficacia y seguridad clínicas
La eficacia y la seguridad clínicas de tucatinib han sido evaluadas en un único ensayo pivotal de fase 2 aleatorizado, doble ciego, controlado con placebo. En el estudio se investigó la adición de tucatinib3 a un régimen combinado de trastuzumab con capecitabina (T+C) en el tratamiento de pacientes con cáncer de mama HER2+ localmente avanzado o metastásico. Para ello, se aleatorizaron un total de 612 participantes4 en proporción 2:1 para recibir tucatinib o placebo en combinación con T+C. Al inicio, el 20% de las pacientes era mayor de 65 años, el 35% presentaba un estadio IV en el diagnóstico primario y el 48% presentaba metástasis cerebrales.
La variable principal de eficacia fue la supervivencia libre de progresión (SLP) de acuerdo a los criterios RECIST 1.1, mientras que, entre los objetivos secundarios, se analizó la supervivencia global (SG), la SLP en pacientes con metástasis cerebral en la línea de base y la tasa de respuesta objetiva (TRO) según RECIST 1.1. Estas variables fueron analizadas por un comité de revisión independiente.
Los resultados divulgados (Murthy et al., 2020) indican que, tras una mediana de 10 meses de seguimiento, la mediana de SLP fue 7,8 meses en el brazo de tucatinib y de 5,6 meses en el brazo de control (HR: 0,54; IC95% 0,42-0,71; p< 0,00001). Se estimó una SLP al año del 33,1% en el brazo de tucatinib vs. 12,3% en el brazo de control. De manera interesante, en el subgrupo de pacientes con metástasis cerebrales, la mediana de SLP fue también superior entre quienes recibieron tucatinib (7,6 vs. 5,4 meses; HR: 0,48; IC95% 0,34-0,69; p< 0,00001). Tras una mediana de seguimiento de 14 meses, la SG mediana estimada fue superior para los pacientes que recibieron tucatinib (21,9 vs. 17,4 meses con placebo; HR: 0,66; IC95% 0,50-0,88; p= 0,0048): en base a ello, se estimó una SG del 44,9% a los 2 años en el grupo de tucatinib frente al 26,6% en el grupo de control. Adicionalmente, se dispone de datos de SG en pacientes con metástasis cerebrales procedentes de un análisis exploratorio en el marco del estudio pivotal (Lin et al., 2023), con un seguimiento mediano de 29,6 meses, en el que se ha reportado un incremento de la supervivencia de 9,1 meses respecto al grupo de placebo (21,6 vs. 12,5 meses; HR: 0,40; IC95% 0,44-0,81; p< 0,001). En estas pacientes se estimó una supervivencia a 2 años del 48,5% vs. 25,1% con placebo.
Por otro lado, la TRO fue también significativamente superior en el grupo de tucatinib (34,6% vs. 19,3%; p= 0,00011), principalmente respuestas parciales (32,9% vs. 18,3%) y una pequeña proporción de respuestas completas, superior en el grupo de tucatinib (1,7% vs. 1,0%).
En un estudio de soporte de fase 1b abierto (N= 60), la eficacia de tucatinib fue evaluada en combinación con capecitabina, con trastuzumab y con ambos. Tras una exposición mediana de 8,5 meses, en la combinación de tucatinib con T+C (n= 27), la TRO fue del 60,9% (IC95% 38,5-80,3), y del 55,6% (IC95% 21,2-86,3) en el subgrupo de pacientes con metástasis cerebral (n= 11). La SLP fue de 7,8 meses (IC95% 4,1-12,5) y de 6,7 meses en el subgrupo con metástasis cerebrales (IC95% 4,1-19,1).
De cara al análisis de la seguridad de tucatinib, se dispone principalmente de los datos del estudio pivotal, con una mediana de exposición al fármaco de 7,4 meses (exposición de > 12 meses en casi un tercio de las participantes). El 99,3% en el brazo de tucatinib vs. 97,0% en el de placebo experimentó algún evento adverso (59,2% vs. 51,3% de grado ≥ 3, respectivamente). Los eventos adversos más comunes (≥ 25%) se presentaron todos ellos con mayor frecuencia en el brazo de tucatinib y fueron: diarrea (81,9% vs. 53,8%), eritrodisestesia palmoplantar5 (64,9% vs. 53,3%), náuseas (59,7% vs. 44,7%), fatiga (47,5% vs. 44,2%), vómitos (36,9% vs. 25,9%), reducción del apetito (25,7% vs. 20,8%) y estomatitis (26,0% vs. 14,2%).
En el caso de los eventos de grado ≥ 3, con excepción de la hipopotasemia, más frecuente en el grupo de placebo (5,1% vs. 3,7%), los más comunes tuvieron una mayor incidencia entre las pacientes tratadas con tucatinib: eritrodisestesia palmoplantar (13,9% vs. 9,1%), diarrea (13,1% vs. 8,6%) y fatiga (5,4% vs. 4,1%). Los fenómenos de hepatotoxicidad fueron más frecuentes con tucatinib (44,3% vs. 25,9%), principalmente manifestado como aumento de las transaminasas o incremento de bilirrubina en sangre. Un total de 14 pacientes fallecieron durante el estudio pivotal debido a un evento adverso, 8 en el brazo de tucatinib (2%) y 6 en el de placebo (3%), pero ninguno de los casos se consideró relacionado con el tratamiento en estudio. La tasa de discontinuación debido a eventos adversos fue superior en el brazo de tucatinib (5,7% vs. 3,6%), siendo la diarrea (1%) el más frecuente.
Aspectos innovadores
Tucatinib es un nuevo antineoplásico inhibidor de tirosina cinasa selectivo para HER2, un receptor de membrana cuya sobreexpresión en determinados tipos de cáncer, como el de mama, se asocia a un peor pronóstico. La activación del receptor HER2 favorece el crecimiento y la proliferación celular, aumentando también el riesgo de metástasis, comprendiéndose que su inhibición por tucatinib ejerce un efecto antitumoral. En base a este mecanismo, el medicamento ha sido autorizado en la UE con indicación, en combinación con trastuzumab y capecitabina, para el tratamiento de pacientes adultos con cáncer de mama HER2-positivo localmente avanzado o metastásico que hayan recibido por lo menos dos pautas de tratamiento anti-HER2 anteriores.
Su eficacia ha sido evaluada en un estudio pivotal de fase 2 aleatorizado y doble ciego. Se comparó la adición de tucatinib a un régimen combinado con trastuzumab y capecitabina con la adición de placebo a este mismo régimen, con el objetivo de analizar la SLP como variable principal. La mediana de SLP alcanzada tras 10 meses de seguimiento fue significativamente superior para el grupo de tucatinib, prolongándose más de 2 meses (7,8 vs. 5,6 meses), lo que supone una reducción de aproximadamente el 45% del riesgo de progresión o muerte por la enfermedad (HR: 0,54; p< 0,00001). Estos resultados fueron muy similares en el subgrupo de pacientes con metástasis cerebral, con una SLP de 7,6 vs. 5,4 meses (HR: 0,48; p < 0,00001).
El análisis de las variables secundarias también arrojó resultados positivos para tucatinib. Además de que se relacionó con una tasa de respuesta de casi el doble (35% vs. 19%), tras 14 meses de seguimiento se estimó una SG superior con el uso del nuevo fármaco, prolongándose la mediana en más de 4 meses (21,9 vs. 17,4 meses con placebo; HR: 0,66; p = 0,0048), esto es, una reducción del 34% del riesgo de muerte por cualquier causa. El análisis por subgrupos no reveló diferencias clínicamente significativas respecto a estas variables.
Es preciso subrayar que la ampliación de la SLP en las pacientes con metástasis cerebrales –un factor que empeora drásticamente el pronóstico y para cuyo tratamiento no se dispone de alternativas terapéuticas– supone uno de los aspectos más relevantes en relación al beneficio clínico de tucatinib. Los datos más actualizados respecto a la SG en pacientes con metástasis cerebral, con un seguimiento mediano de casi 30 meses, indican un incremento de 9,1 meses de supervivencia respecto al grupo de placebo (21,6 vs. 12,5 meses), disminuyendo en un 40% el riesgo de muerte (HR: 0,40; p< 0,001). En estas pacientes se estimó que, a 2 años, están vivas casi la mitad (48,5%), lo que prácticamente duplica lo visto con placebo (tasa de SG del 25,1%).
Por otra parte, el perfil de seguridad de tucatinib parece comparable al de otros inhibidores de tirosina cinasa ya empleados en clínica, con un perfil toxicológico acumulable al de los ya conocidos para los fármacos en combinación, especialmente para capecitabina. El evento adverso más común fue la diarrea, más frecuente con tucatinib que entre quienes recibieron placebo (82% vs. 54%). Otros eventos adversos frecuentes, también más comunes con el nuevo fármaco, fueron eritrodisestesia palmoplantar (65% vs. 53%), náuseas (60% vs. 45%) y fatiga (48% vs. 44%). La hepatotoxicidad se ha considerado, junto con la diarrea, un aspecto de seguridad importante para tucatinib. Aunque los eventos de toxicidad hepática identificados se consideraron por lo general manejables, la frecuencia observada con el régimen con tucatinib fue superior (44% vs. 26%), así como la de eventos de grado ≥ 3 (10% vs. 5%). Por el momento, no se conoce el perfil de seguridad del medicamento en pacientes con condiciones hepáticas crónicas, tales como hepatitis B o C (EMA, 2021).
Tampoco se dispone de comparaciones directas ni indirectas con otras terapias disponibles para la indicación, si bien el IPT destaca que tucatinib mejora los resultados de supervivencia de lapatinib en pacientes con cáncer de mama HER2+ y metástasis cerebrales, lo cual podría representar su principal ventaja terapéutica. En un metaanálisis se concluyó que lapatinib en combinación con capecitabina (pero sin trastuzumab) permite obtener una SLP de 4,1 meses y una SG de 11,2 meses en este grupo de población, frente a los 7,6 y 21,6 meses obtenidos con tucatinib, respectivamente.
En definitiva, tucatinib cuenta con un mecanismo de acción ya conocido para otros agentes antineoplásicos empleados en cáncer de mama HER2+ (como neratinib o lapatinib). Sin embargo, este nuevo inhibidor de tirosina cinasa se encuentra autorizado en una indicación para la que actualmente no existe un estándar de tratamiento. Específicamente en pacientes con metástasis cerebrales, por ahora no se dispone de alternativas terapéuticas, por lo que el beneficio observado en SLP con tucatinib, aunque de limitada magnitud, puede considerarse clínicamente relevante. A la espera de disponer de datos maduros respecto a los aspectos más inciertos sobre la toxicidad del nuevo fármaco –principalmente su potencial hepatotóxico–, se puede concluir que la adición de tucatinib a un régimen combinado con trastuzumab y capecitabina implica una mejora reseñable en el abordaje de pacientes altamente pretratadas y con mal pronóstico.


Bibliografía
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha técnica Tukysa® (tucatinib). 2023. Disponible en: https://cima.aemps.es/cima/dochtml/ft/1201526002/FT_1201526002.html.
-
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de tucatinib (Tukysa®) en el tratamiento de pacientes adultos con cáncer de mama HER-2 positivo, localmente avanzado o metastásico. PT/V3/49-2021. 2022. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/2021/IPT_49-2021-tucatinib2.pdf.
-
- European Medicines Agency (EMA). Tukysa®. European Public Assessment Report (EPAR). 2021. EMA/78409/2021. Disponible en: https://www.ema.europa.eu/en/documents/assessment-report/tukysa-epar-public-assessment-report_en.pdf.
-
- Kulukian A, Lee P, Taylor J, Rosler R, de Vries P, Watson D et al. Preclinical Activity of HER2-Selective Tyrosine Kinase Inhibitor Tucatinib as a Single Agent or in Combination with Trastuzumab or Docetaxel in Solid Tumor Models. Mol Cancer Ther. 2020; 19(4): 976-87. DOI: 10.1158/1535-7163.MCT-19-0873.
-
- Lin NU, Murthy RK, Abramson V, Anders C, Bachelot T, Bedard PL et al. Tucatinib vs Placebo, Both in Combination With Trastuzumab and Capecitabine, for Previously Treated ERBB2 (HER2)-Positive Metastatic Breast Cancer in Patients With Brain Metastases: Updated Exploratory Analysis of the HER2CLIMB Randomized Clinical Trial. JAMA Oncol. 2023; 9(2): 197-205. DOI: 10.1001/jamaoncol.2022.5610. Erratum in: JAMA Oncol. 2023; 9(2): 284.
-
- Murthy RK, Loi S, Okines A, Paplomata E, Hamilton E, Hurvitz SA et al. Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer. N Engl J Med. 2020; 382(7): 597-609. DOI: 10.1056/NEJMoa1914609. Erratum in: N Engl J Med. 2020; 382(6): 586.
1 La edad de máxima incidencia está por encima de 50 años, con un máximo entre los 45 y los 65 años, pero aproximadamente un 6-10% se diagnostica en mujeres menores de 35-40 años.
2 En estos tumores los estrógenos permiten la proliferación celular a través de la estimulación de la progresión a través de la fase G1 del ciclo celular, donde el eje de señalización formado por la ciclina D1, la cinasa dependiente de ciclina (CDK) 4/6 y la proteína del retinoblastoma (pRB) tienen una importancia crucial.
3 La administración de tucatinib por vía oral se estudió en ciclos de 21 días, con una dosis de 300 mg dos veces al día.
4 Esta población se utilizó para el análisis de la SG, mientras que 480 participantes (320 del brazo de tucatinib y 160 del brazo de placebo) constituyeron la población por intención de tratar, y sirvieron de base para el análisis de la SLP.
5 También denominada síndrome mano-pie, es un efecto adverso de algunos fármacos antineoplásicos. Se manifiesta principalmente con dolor, enrojecimiento e hinchazón en las manos y/o los pies.




