Vilanterol/Fluticasona RELVAR ELLIPTA® (GlaxoSmithKline)
 Nº377
Nº377
ASMA Y EPOC
La EPOC (enfermedad pulmonar obstructiva crónica) es una patología caracterizada por una disminución progresiva y fundamentalmente no reversible del flujo aéreo. La limitación crónica al flujo aéreo se asocia con una respuesta inflamatoria anormal del pulmón relacionada, sobre todo, con el humo del tabaco como causa fundamental. Por su parte, el asma es una enfermedad inflamatoria crónica de las vías respiratorias, en cuya patogenia intervienen diversas células y mediadores de la inflamación, condicionada en parte por factores genéticos y que cursa con hiperrespuesta bronquial y una obstrucción variable al flujo aéreo, total o parcialmente reversible, ya sea por la acción medicamentosa o espontáneamente
Relvar Ellipta® está formado por una combinación a dosis fija constituida por vilanterol, un agonista de acción prolongada de los receptores β2 adrenérgicos estrechamente relacionado química y farmacológicamente con el salmeterol, y furoato de fluticasona, un glucocorticosteroide que ya estaba previamente comercializado en España. Dicha combinación ha sido autorizada para el tratamiento regular del asma en adultos y adolescentes de 12 años de edad y mayores cuando la administración de una combinación (un agonista β2 de acción prolongada y un corticosteroide por vía inhalatoria) sea apropiada: pacientes no controlados adecuadamente con corticosteroides inhalados y agonistas β2 inhalados de acción corta administrados "a demanda". También está indicado para el tratamiento sintomático de adultos con EPOC, con un FEV1 <70% del normal (post-broncodilatador) y una historia clínica de exacerbaciones a pesar del uso regular de una terapia broncodilatadora.
En general, los efectos observados tanto en asma como en EPOC son equiparables a los de otras combinaciones de agonistas β2 adrenérgicos de larga duración (formoterol, salmeterol) y glucocorticoides (propionato de fluticasona, budesonida, beclometasona), con una clara superioridad sobre el glucocorticoide solo. El perfil de seguridad de la combinación está en línea con el de otras combinaciones conocidas (nasofaringitis y cefalea, principalmente) y no se han observado eventos adversos específicos; en cualquier caso, la incidencia no es elevada y no es un motivo frecuente de suspensión del tratamiento. No obstante, se han registrado algunos casos mortales aislados de neumonía.
En definitiva, se trata de la primera combinación de un agonista β2 adrenérgicos de larga duración (LABA, long-acting beta-adrenoceptor agonist) y un glucocorticoide que está disponible para su uso tanto en asma como en EPOC y que solo requiere una única administración diaria en inhalación, lo cual, presumiblemente, podría facilitar la tasa de adherencia al tratamiento y, con ello, mejorar el curso y el pronóstico en estos pacientes. En este sentido, hasta ahora, al menos en España, las únicas combinaciones disponibles comercialmente de un LABA (formoterol, salmeterol) y glucocorticoides (beclometasona, budesonida, propionato de fluticasona) solo estaban autorizadas para el tratamiento del asma (con la excepción de salmeterol/fluticasona, que también lo está para EPOC) y todos ellos requieren la administración de dos dosis diarias (cada 12 h).
La EPOC es una patología caracterizada por una disminución progresiva y fundamentalmente no reversible del flujo aéreo. La limitación crónica al flujo aéreo se asocia con una respuesta inflamatoria anormal del pulmón relacionada, sobre todo, con el humo del tabaco como causa fundamental. Esta enfermedad respiratoria crónica engloba patologías como el enfisema1, la bronquitis crónica2 y la enfermedad de vías aéreas pequeñas.
Los parámetros funcionales respiratorios más habitualmente utilizados en la descripción clínica de la EPOC son:
- Capacidad Vital (CV): volumen máximo que el sujeto es capaz de inspirar y espirar en condiciones no forzadas, y corresponde a la suma VC + VRI +VRE:
- Volumen corriente (VC): cantidad de aire empleado en cada respiración (inspiración y espiración) normal (no forzada), lo que da idea del volumen de aire circulado en cada ciclo respiratorio. Habitualmente, el valor expresado representa el aire espirado, que no corresponde exactamente al inspirado, por ser un valor generalmente más estable que el inspirado. En término medio es de 0,5 litros.
- Volumen de Reserva Inspiratoria (VRI): máximo volumen de aire que puede ser inspirado. Se sitúa habitualmente en torno a 3 litros (con las evidentes diferencias entre grupos de edad, desarrollo, etc.).
- Volumen de Reserva Espiratoria (VRE): volumen máximo de aire que es espirado en condiciones normal (sin forzar la respiración). En término medio, se sitúa sobre 1,7 l.
- Capacidad Vital Forzada (CVF): es el equivalente a la capacidad vital (CV), pero en condiciones forzadas y con la máxima rapidez que el sujeto pueda.
- Volumen Espiratorio Forzado en 1 segundo (VEF1): volumen de aire exhalado durante el primer segundo de una espiración forzada (máxima). Se trata de un parámetro fundamental para el diagnóstico y control de la evolución clínica de la EPOC. Una variante de este parámetro es el VEF1%, la fracción correspondiente del VEF1 entre la Capacidad Vital (CV), expresándolo en términos porcentuales (VEF1% = [VEF1/CV] x 100). Actualmente, se acepta también como valor porcentual el correspondiente al cociente VEF1/CVF.
El pronóstico de los pacientes con EPOC depende del grado de obstrucción al flujo aéreo y del abandono del consumo de tabaco. La tasa de mortalidad a los 10 años de establecido el diagnóstico es superior al 50%. La evolución o historia natural de la EPOC sigue un curso lento, pero inexorable, en el que pueden sobrevenir episodios de exacerbación, con desarrollo de insuficiencia respiratoria e hipercapnia potencialmente graves, incluso mortales, que constituyen, por tanto, una urgencia médica en potencia.
La prevalencia de la EPOC en España es similar en líneas generales a la encontrada en otros países europeos y en los Estados Unidos. Concretamente, en España es del 10% de la población entre 40 y 80 años; es decir, la EPOC afectaría a más de 2 millones de personas, de los cuales un 15 % son varones y un 6% mujeres. En España, la EPOC representa la cuarta causa de mortalidad, con una tasa global de 33/100.000 habitantes, que aumenta a 176/100.000 habitantes en población de más de 75 años, e incluso algunos estudios señalan que pasará a ser la tercera causa de mortalidad para el 2020. Se trata, por tanto, de un problema clínico relevante, con importantes repercusiones socioeconómicas, lo que lo convierte en un importante problema de salud pública, que merece todo el interés de profesionales y autoridades sanitarias.
La mayoría de los casos de EPOC están asociados al consumo de cigarrillos, si bien sólo el 15-20% de los fumadores desarrollan esta patología debido a diferencias en susceptibilidad de naturaleza aún desconocida, aunque se piensa que tienen una base genética o quizás ambiental. Desde el punto de vista funcional, la EPOC se define por un aumento de la resistencia al flujo aéreo al que contribuyen:
- a) La disminución de la luz bronquial por el engrosamiento de la pared y la hipersecreción de mucinas.
- b) La contracción de la musculatura lisa de las vías aéreas.
- c) La pérdida de elasticidad del parénquima pulmonar.
En contraposición al asma bronquial, que es una inflamación eosinofílica crónica con obstrucción reversible de vías aéreas, la EPOC presenta un perfil de inflamación neutrofílica crónica con obstrucción no reversible. Los estudios histopatológicos muestran una implicación predominante de las vías respiratorias (bronquiolos) y del parénquima pulmonar, mientras que el asma implica inflamación de todas las vías respiratorias, aunque normalmente sin implicación del parénquima pulmonar. Existe una obstrucción de los bronquiolos, con fibrosis e infiltración con macrófagos y linfocitos T. Se produce la destrucción del parénquima pulmonar y un aumento de macrófagos y linfocitos T, con un mayor aumento de células CD8+ (citotóxicas) en comparación con las células CD4+ (coadyuvantes).
Cualquier opción terapéutica en la EPOC debe pasar por el abandono radical e inmediato del hábito tabáquico en el paciente, habida cuenta su decisivo papel en el origen y mantenimiento de la enfermedad. Junto con el abandono definitivo del tabaquismo, la oxigenoterapia continua domiciliaria cuando la situación lo requiera, son los dos elementos básicos para frenar la progresión de la enfermedad. El alivio sintomático y la mejoría de la calidad de vida se obtienen mediante el empleo de agentes broncodilatadores, la rehabilitación respiratoria y el soporte ventilatorio domiciliario.
La prevención de las exacerbaciones o reagudizaciones también es el objetivo de la utilización de broncodilatadores, así como los de la vacunación antigripal y del uso de corticosteroides en inhalación. Cuando las terapias farmacológicas y rehabilitadoras no son suficientes, se recurre a la cirugía de reducción pulmonar o, incluso, al trasplante. Cuando hay disnea o intolerancia al ejercicio físico, se recomienda el uso de agentes broncodilatadores de acción corta, en inhalación. La elección de agonistas beta2-adrenérgicos (salbutamol, terbutalina, etc.) o de anticolinérgicos (ipratropio) depende de la respuesta y de la incidencia de efectos adversos en cada paciente. En caso de exacerbaciones o disnea persistente con la terapia anterior, las opciones dependen del grado de limitación del flujo respiratorio:
- FEV1 ≥ 50%: Las alternativas son
- Agonista beta2-adrenérgico de larga duración (indacaterol, formoterol, salmeterol, etc.), manteniendo el uso de los de acción corta, a demanda. En caso de falta de respuesta adecuada, puede añadirse un corticosteroide en inhalación, o un anticolinérgico de acción prolongada en inhalación en caso de baja respuesta o intolerancia al corticosteroide.
- Anticolinérgico de acción prolongada (tiotropio, etc.), descontinuando el uso de anticolinérgicos de acción corta. En caso de respuesta inadecuada, puede combinarse con un agonista beta2-adrenérgico de larga duración y un corticosteroide, todos ellos en inhalación.
- FEV1 ≤ 50%:
- Agonista beta2-adrenérgico de larga duración (indacaterol, formoterol, salmeterol, vilanterol, etc.) más un corticosteroide en inhalación, o un anticolinérgico de acción prolongada en inhalación en caso de baja respuesta o intolerancia al corticosteroide.
- Anticolinérgico de acción prolongada (tiotropio, etc.), descontinuando el uso de anticolinérgicos de acción corta. En caso de respuesta inadecuada, puede combinarse con un agonista beta2-adrenérgico de larga duración y un corticosteroide, todos ellos en inhalación.
- Solo cuando la terapia inhalada sea insuficiente para mantener la calidad de vida de los pacientes, se debe recurrir a la terapia sistémica (oral):
- Corticosteroides: no se recomienda su uso continuado en EPOC, salvo en aquellos casos en que no puede suspenderse el tratamiento, tras una exacerbación.
- Teofilina: Puede usarse en combinación con agonistas beta2-adrenérgicos y anticolinérgicos, teniendo siempre presente el amplio espectro de interacciones farmacológicas de este agente.
- Mucolíticos: Se considera aceptable su uso en pacientes con tos crónica productiva, siempre que produzcan una mejora sintomática apreciable. No se recomienda su uso para la prevención de las exacerbaciones.
- Inhibidores selectivos de la fosfodiesterasa 4 (PDE4): Roflumilast es un fármaco que es capaz de reducir la incidencia de exacerbaciones graves o muy graves en pacientes con EPOC e historial de exacerbaciones frecuentes.
ASMA
El asma es un síndrome que comparten manifestaciones clínicas similares en apariencia pero de causas diferenciadas. Ello supone que sea complejo el alcanzar una definición precisa y exacta de la enfermedad, existiendo varias definiciones para la misma. Se define como una enfermedad inflamatoria crónica de las vías respiratorias, en cuya patogenia intervienen diversas células y mediadores de la inflamación, condicionada en parte por factores genéticos y que cursa con hiperrespuesta bronquial y una obstrucción variable al flujo aéreo, total o parcialmente reversible, ya sea por la acción medicamentosa o espontáneamente (Cortijo, 2014a).
El asma en adultos se clasifica, por el grado de gravedad, en cuatro categorías: intermitente, persistente leve, persistente moderada y persistente grave. En los niños se definen dos patrones principales: asma episódica y asma persistente. El asma episódica puede ser ocasional o frecuente, dependiendo del número de crisis que presente. El asma persistente en el niño no puede considerarse como leve, sino que al menos es moderada o grave. Existe un fenotipo mixto EPOC-asma, caracterizado por la presencia de una obstrucción no completamente reversible al flujo aéreo acompañada de síntomas o signos de una reversibilidad aumentada de la obstrucción.
El asma es un problema de salud de elevada prevalencia, con importantes implicaciones en la esperanza y calidad de vida de las personas que la padecen y que genera un importante consumo de recursos sanitarios y unas fuertes pérdidas sociales. Según la Organización Mundial de la Salud (OMS), el asma es la séptima enfermedad más prevalente en el mundo, con cerca de 235 millones de afectados. La cifra de afectados en Europa es de alrededor de 29 millones. Además, supone la quinta causa de muerte en los países desarrollados. En el territorio español, la prevalencia de síntomas asmáticos en niños se ha mantenido constante en los niños de 13-14 años, mientras que ha sufrido un aumento significativo en el grupo de 6-7 años. En los adultos la prevalencia es inferior a la de los países anglosajones y centroeuropeos. El Estudio Europeo de Salud Respiratoria constató en nuestro país unas tasas del 4,7% en Albacete, 3,5% en Barcelona, 1,7% en Oviedo, 1,1% en Galdakao (Vizcaya) y 1% en Huelva. Un 52% de las personas con asma no habían sido diagnosticadas y hasta un 26% de éstas, a pesar de padecer síntomas frecuentes, no seguía ningún tratamiento.
El objetivo principal del tratamiento del asma es lograr y mantener el control de la enfermedad lo antes posible, además de prevenir las exacerbaciones y la obstrucción crónica al flujo aéreo y reducir su mortalidad.
Las exacerbaciones (ataques o crisis) de asma son episodios agudos o subagudos caracterizados por un aumento progresivo de uno o más de los síntomas típicos (disnea, tos, sibilancias y opresión torácica) acompañados de una disminución del flujo espiratorio (FEV1). Según la rapidez de instauración de las crisis, existen dos tipos: las de instauración lenta (normalmente en días o semanas) y las de instauración rápida (en menos de 3 horas), que deben identificarse por tener causas, patogenia y pronóstico diferentes. Las de instauración lenta (más del 80% de las que acuden a urgencias) se deben frecuentemente a infecciones respiratorias altas o a un mal control de la enfermedad.
Las exacerbaciones (ataques o crisis) de asma son episodios agudos o subagudos caracterizados por un aumento progresivo de uno o más de los síntomas típicos (disnea, tos, sibilancias y opresión torácica) acompañados de una disminución del flujo espiratorio (FEV1). Según la rapidez de instauración de las crisis, existen dos tipos: las de instauración lenta (normalmente en días o semanas) y las de instauración rápida (en menos de 3 horas), que deben identificarse por tener causas, patogenia y pronóstico diferentes. Las de instauración lenta (más del 80% de las que acuden a urgencias) se deben frecuentemente a infecciones respiratorias altas o a un mal control de la enfermedad por mala adhesión terapéutica; el mecanismo fundamental del deterioro es la inflamación y la respuesta al tratamiento es también lenta; mientras que las de instauración rápida se deben a alérgenos inhalados, ingestión de fármacos (AINE o fármacos betabloqueantes), alimentos (por los aditivos y conservantes) o estrés emocional; el mecanismo es el broncoespasmo y, aunque tienen una mayor gravedad inicial (con riesgo de intubación y muerte), la respuesta al tratamiento es mejor y más rápida. La intensidad de las exacerbaciones es variable, cursando en ocasiones con síntomas leves e indetectables por el paciente y en otras con episodios muy graves que ponen en peligro su vida.
El objetivo inmediato del tratamiento de una crisis es preservar la vida del paciente revirtiendo la obstrucción al flujo aéreo y la hipoxemia si está presente, de la forma más rápida posible, y posteriormente instaurar o revisar el plan terapéutico para prevenir nuevas crisis.
La pauta de tratamiento en la exacerbación leve debe incluir la administración de broncodilatadores agonistas β2-adrenérgicos de acción rápida (salbutamol o terbutalina), glucocorticoides orales y oxígeno (si es necesario). Los agonistas β2-adrenérgicos de acción corta inhalados son los fármacos broncodilatadores más eficaces y rápidos en el tratamiento de la exacerbación asmática. Si en las primeras 2 horas del tratamiento se constata una evolución favorable (desaparición de síntomas, FEV1 superior al 80% del teórico o del mejor valor personal del paciente) y ésta se mantiene durante 3-4 horas, no son necesarios más tratamientos. Sin embargo, en pacientes no controlados adecuadamente con combinaciones inhaladas de corticosteroides y agonistas β2 de acción corta administradas "a demanda", puede recurrirse a combinaciones similares en las que el agonista β2 sea de acción prolongada (salmeterol, formoterol, vilanterol, etc.).
El uso de glucocorticoides sistémicos acelera la resolución de las exacerbaciones. Excepto en crisis muy leves, deben administrarse siempre, especialmente si: a) no se consigue una reversión de la obstrucción de las vías respiratorias con agonistas β2-adrenérgicos de acción rápida inhalados; b) el paciente estaba tomando ya glucocorticoides orales; c) el paciente ha tratado ya su pérdida de control previa con otras opciones terapéuticas sin éxito; d) existen antecedentes de exacerbaciones previas que requirieron glucocorticoides orales.
ACCIÓN Y MECANISMO
Se trata de un medicamente administrado en forma de inhalación, formado por una combinación a dosis fija de un agonista de acción prolongada de los receptores β2 adrenérgicos (vilanterol) y de un glucocorticosteroide (fluticasona). Ha sido autorizado para el tratamiento regular del asma en adultos y adolescentes de 12 años de edad y mayores cuando la administración de una combinación (un agonista β2 de acción prolongada y un corticosteroide por vía inhalatoria) sea apropiada: pacientes no controlados adecuadamente con corticosteroides inhalados y agonistas β2 inhalados de acción corta administrados "a demanda". También está indicado para el tratamiento sintomático de adultos con EPOC, con un FEV1 <70% del normal (post-broncodilatador) y una historia clínica de exacerbaciones a pesar del uso regular de una terapia broncodilatadora.
Existen tres tipos de receptores adrenérgicos β: β1 (predominantes en el corazón), β2 (músculo liso) y β3 (relacionados con el metabolismo lipídico intracelular). La activación de todos los subtipos de receptores β desencadena un mecanismo de acción similar, mediante el cual la adenilciclasa ligada al receptor se activa y cataliza la conversión del trifosfato de adenosina (ATP) en adenosín monofosfato cíclico (AMPc), provocando, en el caso de los receptores β2 de las células musculares bronquiales, la relajación de éstas y, en consecuencia, una broncodilatación. Estudios de autorradiografía en pulmón humano han demostrado la presencia exclusiva de receptores β2 en el músculo liso de las vías aéreas, sobre todo en las vías periféricas, aunque existen también adrenoceptores β2 en el epitelio, la pared alveolar, las glándulas submucosas, el músculo liso vascular pulmonar, células con capacidad de liberar mediadores (mastocitos, basófilos, eosinófilos), y en los ganglios y las terminaciones nerviosas posganglionares colinérgicas.
El vilanterol presenta una elevada afinidad hacia los receptores β2 adrenérgicos, similar a la del salmeterol y superior a la del formoterol e indacaterol; igualmente, la selectividad relativa para receptores β2 adrenérgicos (en relación a los β1 y β3) es equiparable a la del salmeterol y mayor que la del formoterol e indacaterol.
Por su parte, la fluticasona es un glucocorticosteroide que, como tal, tiene acciones antiinflamatorias e inmunomoduladoras. Tras unirse a los receptores intracelulares específicos, los glucocorticosteroides dan lugar a un factor de transcripción capaz de modular la expresión génica que induce, entre otras acciones, la síntesis de lipocortina-1, polipéptido que inhibe la fosfolipasa A2 (enzima clave en la producción de mediadores de la inflamación como prostaglandinas, leucotrienos, factor activador plaquetario) y disminuye la formación de citocinas tales como las interleucinas IL-5 e IL-3, y el factor de necrosis tumoral (TNF).
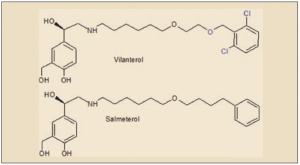
ASPECTOS MOLECULARES
El vilanterol es un agonista β2 adrenérgico de acción prolongada, estrechamente relacionado estructural y farmacológicamente con el salbutamol y, especialmente, con el salmeterol que, como el vilanterol, es de acción prolongada. Químicamente, corresponde al 4-[(1R)-2-[6-[2-[(2,6-diclorofenil)metoxi]etoxi]hexilamino]-1-hidroxietil]-2-(hidroximetil)fenol.
Por su parte, la fluticasona es un glucocorticosteroide bien conocido, ya utilizado en medicamentos previamente autorizados, tanto solo como en combinación con broncodilatadores adrenérgicos. Se trata de un derivado halogenado (contiene es su estructura dos átomos de flúor); está estrechamente relacionado química y farmacológicamente con otros corticosteroides utilizados en asma y EPOC, tanto halogenados (beclometasona, mometasona), como no halogenados (ciclesónido, budesonida).
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de la combinación a dosis fijas de vilanterol y furoato de fluticasona han sido adecuadamente contrastadas tanto en asma como en EPOC mediante varios estudios multicéntricos, aleatorizados, doblemente ciegos y controlados con placebo, en los que se utilizó la formulación de furoato de fluticasona (FF; 50, 100 o 200 µg por pulsación, equivalentes a 46, 92 y 184 µg de fluticasona base) y trifenatato de vilanterol (VI; 25 µg por pulsación, equivalentes a 22 µg de vilanterol base) y el mismo dispositivo dosificador en inhalación que ha sido posteriormente comercializado.
Eficacia clínica en asma
Entre los diversos ensayos clínicos disponibles de fase 3 (confirmatorios de eficacia y de seguridad), los considerados como principales o pivotales son tres. Dichos ensayos clínicos fueron llevados a cabo sobre pacientes adolescentes (≥12 años) o adultos con asma persistente de moderada a grave, que estaban bajo tratamiento con corticosteroides inhalados, eventualmente asociados a un broncodilatador β2 adrenérgico de larga duración.
El estudio HZA106827 (Bleecker, 2014) comparó durante 12 semanas la combinación FF/VI 100/25 µg vs. el corticoide solo (FF 100 µg) y placebo (P), en un conjunto de 609 pacientes con valores de Volumen Espiratorio Forzado en 1 segundo (VEF1) entre el 40% y el 90% del predicho (mediana de 68%), un VEF1 valle (predosis) medio de 2.230 ml y de 2.850 postdosis broncodilatadora. Demográficamente, un 58% eran mujeres, la mediana de edad era de 39,7 años, (13% menores de 18 años), 94% blancos y una mediana de peso de 75,6 kg. Se utilizaron dos covariables primarias de eficacia consistentes en la variación entre los valores basales y los registrados al final del estudio del VEF1 valle (predosis) y la correspondiente a la media ponderada de los valores del VEF1 postdosis (entre 0 y 24 h tras la dosis).
Los resultados mostraron un aumento en el VEF1 valle (predosis) de 368 ml (FF/VI), de 332 ml (FF) y 196 ml (P), siendo la diferencia entre FF/VI y FF de 36 ml (IC95% -45 a 120; p= 0,405) y la de FF/VI vs. placebo (P) de 172 ml (IC95% 87 a 258; p< 0,001). Por lo que respecta a la variación de la media ponderada de los valores del VEF1 postdosis (entre 0 y 24 h tras la dosis), fue de 513 ml (FF/VI), de 398 ml (FF) y 212 ml (P), siendo la diferencia entre FF/VI y FF de 116 ml (IC95% -5 a 236; p= 0,06) y la de FF/VI vs. placebo (P) de 302 ml (IC95% 178 a 426; p< 0,001). Asimismo, la diferencia del porcentaje de días completos sin necesidad de utilizar medicación broncodilatadora de rescate, en relación con el placebo, fue del 19,3% (IC95% 13,0 a 26,6 p< 0,001) para FF/VI y del 10,6% (IC95% 4,3 a 16,8 p< 0,001) para FF; además, la diferencia del porcentaje de días completos sin síntomas, en relación con el placebo, fue del 18,0% (IC95% 12,0 a 23,9 p< 0,001) para FF/VI y del 12,1% (IC95% 6,2 a 18,1 p< 0,001) para FF.
El estudio HZA106829 (O'Byrne, 2014) comparó durante 24 semanas la combinación FF/VI 200/25 µg vs. furoato de fluticasona 200 µg cada 24 h (FF) y propionato de fluticasona 500 µg cada 12 h (PF), en un conjunto de 586 pacientes con VEF1 entre el 40% y el 90% del predicho. Un 59% eran mujeres, la mediana de edad era de 46,2 años, (4% menores de 18 años), 84% blancos y una mediana de peso de 79,9 kg. Los resultados mostraron un aumento en el VEF1 valle (predosis) de 388 ml (FF/VI), de 218 ml (FF) y 173 ml (FP), siendo la diferencia entre FF/VI y FF de 193 ml (IC95% 108 a 277; p< 0,001) y la de FF/VI vs. FP de 210 ml (IC95% 127 a 294; p< 0,001). Por lo que respecta a la variación de la media ponderada de los valores del VEF1 postdosis (entre 0 y 24 h tras la dosis), fue de 394 ml (FF/VI), de 201 ml (FF) y 183 ml (FP).
La diferencia del porcentaje de días completos sin necesidad de utilizar medicación broncodilatadora de rescate, en relación con FF solo, fue del 11,7% (IC95% 4,9 a 18,4 p< 0,001) y del 6,3% (IC95% 6,2 a 18,1 p< 0,001) frente a FP. Además, la diferencia del porcentaje de días completos sin síntomas fue del 8,4% (IC95% 2,0 a 14,8 p= 0,01) frente a FF y del 4,9% (IC95% -1,6 a 11,3 p= 0,137) frente a FP.
El estudio HZA106837 (Bateman, 2014) comparó durante 24 a 78 semanas la combinación FF/VI 100/25 µg vs. el corticoide solo (FF 100 µg), en un conjunto de 2.019 pacientes con VEF1 entre el 50% y el 90% del predicho. Demográficamente, un 67% eran mujeres, la mediana de edad era de 41,7 años, 73% blancos y una mediana de peso de 74,2 kg. La duración media del cuadro asmático era de 15,5 años y un 57% había experimentado al menos un episodio de exacerbación grave del asma durante el último año (un 43% había tenido al menos dos). Como variable primaria de eficacia se determinó el riesgo estadístico de experimentar una exacerbación asmática grave (que requiriese la administración de corticosteroides sistémicos durante al menos tres días y/o la hospitalización del paciente). La tasa anual de exacerbaciones graves fue del 12,8% (IC95% 10,7 a 14,9) con FF/VI vs. 15,9% (IC95% 13,5 a 18,2), lo que implica una reducción del 20% en la tasa de riesgo (HR= 0,795; IC95% 0,642 a 0,985; p= 0,036)
Adicionalmente, un estudio (Woodcock, 2013) comparó durante 24 semanas la combinación FF/VI 100/25 µg vs. propionato de fluticasona y salmeterol 250/50 µg cada 12 h (PF/SA), en un conjunto de 806 pacientes asmáticos. Los resultados mostraron un aumento en el VEF1 valle (predosis) de 341 ml (FF/VI) vs. 377 ml (FP/SA), siendo la diferencia entre ellos de -37 ml (IC95% -88 a 15; p= 0,162). Por lo que respecta a la variación de la media ponderada de los valores del VEF1 postdosis (entre 0 y 24 h), fue de 281 ml (FF/VI) vs. 300 ml (FP/SA), con una diferencia de -19 ml (IC95% -73 a 34; p= 0,485).
Eficacia clínica en EPOC
Hay cuatro ensayos clínicos pivotales, dos de ellos de 6 meses de duración y otros dos de un año. En todos los casos fueron multicéntricos, aleatorizados, controlados y con grupos paralelos.
Los estudios HZC102870 y HZC102871 (Dransfield, 2013) son dos estudios clínicos replicados de un año de duración, realizados sobre 3.245 (1.622 y 1.623) pacientes con EPOC, mayores de 40 años, con un historial de tabaquismo de al menos diez años, cociente VEF1/CVF ≤70% del predicho y con al menos una exacerbación de la enfermedad en el último año. Los pacientes recibieron por vía inahalatoria una dosis diaria de vilanterol (25 µg) solo o asociado a 50, 100 o 200 µg furoato de fluticasona.
Demográficamente, en el estudio HZC102870, un 45% eran mujeres, la mediana de edad era de 63,7 años, 88% blancos y un índice de masa corporal medio de 27,1; los pacientes tenían una mediana VEF1 del 45,7%, un VEF1 valle (predosis) medio de 1.150 ml y de 1.289 postdosis broncodilatadora. Por su parte en el estudio HZC102870, un 41% eran mujeres, la mediana de edad era de 63,6 años, 82% blancos y un índice de masa corporal medio de 26,7; los pacientes tenían una mediana VEF1 del 45,2%, un VEF1 valle (predosis) medio de 1.143 ml y de 1.281 postdosis broncodilatadora
Los resultados del HZC102872 mostraron una tasa anual de exacerbaciones de 0,79 (FF200/VI), 0,90 (FF100/VI), 0,92 (FF50/VI) y 1,14 (VI), con lo que el riesgo relativo (RR) de exacerbación fue reducida en relación al vilanterol solo con la combinación a dosis fija en un 31% (RR= 0,64; IC95% 0,56 a 0,85; p< 0,001) con FF200/VI, en un 21% (RR= 0,79; IC95% 0,64 a 0,97; p= 0,024) con FF100/VI y en un 19% (RR= 0,81; IC95% 0,66 a 0,99; p= 0,040) con FF50/VI. Por su parte, los resultados del HZC102871 mostraron una tasa anual de exacerbaciones de 0,90 (FF200/VI), 0,70 (FF100/VI), 0,92 (FF50/VI) y 1,05 (VI), con lo que el riesgo relativo (RR) de exacerbación fue reducida en relación al vilanterol solo con la combinación a dosis fija en un 15% (RR= 0,85; IC95% 0,70 a 1,04; p= 0,109) con FF200/VI, en un 34% (RR= 0,66; IC95% 0,54 a 0,81; p< 0,001) con FF100/VI y en un 13% (RR= 0,87; IC95% 0,72 a 1,06; p= 0,181) con FF50/VI.
El estudio HZC112206 (Kerwin, 2013) es un estudio multicéntrico, aleatorizado, doblemente ciego, controlado con placebo y de grupos paralelos, realizado sobre 1.030 pacientes con EPOC moderado a grave, que recibieron durante 24 semanas una dosis diaria una combinación de 100 µg de furoato de fluticasona y 25 µg de vilanterol (FF100/VI), 50 µg de furoato de fluticasona y 25 µg de vilanterol (FF50/VI), 100 µg de furoato de fluticasona (FF), 25 µg de vilanterol (VI) o placebo (P).
Los resultados mostraron un aumento de la media ponderada de los valores del VEF1 postdosis (entre 0 y 24 h tras la dosis) de 200 ml (FF100/VI), de 218 ml (FF50/VI), 129 ml (FF), 80 ml (VI) y 26 ml (P); siendo estadísticamente significativas las diferencias entre FF100/VI, FF, VI y P. Por lo que respecta a la variación en el VEF1 valle (predosis), fueron de 151 ml (FF100/VI), de 166 ml (FF50/VI), 103 ml (FF), 70 ml (VI) y 37 ml (P); siendo estadísticamente significativas las diferencias entre FF100/VI y FF, VI y P, así como las registradas entre FF50/VI y VI, y P. Asimismo, las variaciones registradas en la puntuación del Chronic Respiratory Questionnaire Self-Administered Standarized (CRQ-SAS) de disnea fueron de 0,53 (FF100/VI), de 0,42 (FF50/VI), 0,37 (FF), 0,29 (VI) y 0,23 (P), siendo estadísticamente significativas las diferencias entre FF100/VI vs. FF y P; ninguna diferencia fue significativa entre FF50/VI y el resto de grupos.
Por último, el estudio HZC112207 (Martínez, 2013) es un estudio de características similares al anterior, realizado sobre 1.224 pacientes con EPOC moderado a grave, que recibieron durante 24 semanas una dosis diaria una combinación de 200 µg de furoato de fluticasona y 25 µg de vilanterol (FF200/VI), 100 µg de furoato de fluticasona y 25 µg de vilanterol (FF100/VI), 25 µg de vilanterol (VI) 200 µg de furoato de fluticasona (FF200), 100 µg de furoato de fluticasona (FF100) o placebo (P).
Los resultados mostraron un aumento de la media ponderada de los valores del VEF1 postdosis (entre 0 y 24 h tras la dosis) de 197 ml (FF200/VI), de 202 ml (FF1000/VI), 173 ml (VI), 29 ml (FF200), 34 (FF100) y -12 ml (P); siendo estadísticamente significativas las diferencias entre FF200/VI vs. FF200 y P, así como entre FF100/VI vs. FF100 y P. 197 ml (FF200/VI), de 202 ml (FF1000/VI), 173 ml (VI), 29 ml (FF200), 34 (FF100) y -12 ml (P); siendo estadísticamente significativas las diferencias entre FF200/VI vs. FF200 y P, así como entre FF100/VI vs. FF100 y P. Por lo que respecta a la variación en el VEF1 valle (predosis), fueron de 135 ml (FF200/VI), de 148 ml (FF1000/VI), 103 ml (VI), 12 ml (FF200), 48 (FF100) y 4 ml (P); siendo estadísticamente significativas las diferencias entre FF200/VI vs. FF200 y P, así como entre FF100/VI vs. FF100 y P. Además, las variaciones registradas en la puntuación del CRQ-SAS de disnea fueron de 0,31 (FF200/VI), 0,45 (FF100/VI), 0,28 (VI), 0,21 (FF200), 0,10 (FF100) y 0,21 (P), siendo estadísticamente significativas las diferencias entre FF100/VI vs. FF200, FF100 y P; ninguna diferencias fue significativa entre FF50/VI y el resto de grupos.
Seguridad
El perfil toxicológico de vilanterol/fluticasona es equiparable al de otras combinaciones a dosis fijas para inhalación de una agonista β2 adrenérgico de larga duración y un glucocorticosteroide. Los eventos adversos más frecuentemente descritos en los ensayos clínicos controlados y con una incidencia superior a la del placebo son nasofaringitis (12-16 vs. 6% con placebo), cefalea (7-8 vs. 5%) infecciones del tracto respiratorio inferior (8-10 vs. 1-2%) y candidiasis oral (7-8 vs. 0-1%). Los tres primeros presentan una incidencia muy parecida a la del vilanterol y a la de fluticasona por separado. Entre los eventos adversos más graves, cabe citar varios casos mortales de neumonía, así como un incremento de la incidencia de fracturas óseas, en ambos casos más comunes en los pacientes con EPOC que en aquellos con asma.
ASPECTOS INNOVADORES
Se trata de un medicamente administrado en forma de inhalación, formado por una combinación a dosis fija constituida por vilanterol, un agonista de acción prolongada de los receptores β2 adrenérgicos estrechamente relacionado química y farmacológicamente con el salmeterol, y furoato de fluticasona, un glucocorticosteroide que ya estaba previamente comercializado en España. Dicha combinación ha sido autorizada para el tratamiento regular del asma en adultos y adolescentes de 12 años de edad y mayores cuando la administración de una combinación (un agonista β2 de acción prolongada y un corticosteroide por vía inhalatoria) sea apropiada: pacientes no controlados adecuadamente con corticosteroides inhalados y agonistas β2 inhalados de acción corta administrados "a demanda". También está indicado para el tratamiento sintomático de adultos con EPOC, con un FEV1 <70% del normal (post-broncodilatador) y una historia clínica de exacerbaciones a pesar del uso regular de una terapia broncodilatadora.
La combinación ha sido extensamente estudiada mediante ensayos clínicos aleatorizados y controlados con placebo y/o comparadores activos. En pacientes asmáticos, incrementó el FEV1 193 ml más que el furoato de fluticasona sola y 210 ml más que el propionato de fluticasona, tras 24 semanas de tratamiento. Asimismo, el riesgo de experimentar exacerbaciones asmáticas graves fue reducido en un 20% anual en relación a la fluticasona sola. No se encontraron diferencias estadísticamente significativas frente a la combinación de propionato de fluticasona y salmenterol.
En pacientes con EPOC el riesgo relativo (RR) de exacerbación fue reducida en relación al vilanterol solo con la combinación a dosis fija en un 15-31%, 21-34% y 13-19% con las dosis de 200, 100 y 50 µg de furoato de fluticasona, respectivamente, aunque no pudo establecerse una relación entre la dosis de fluticasona y la respuesta clínica.
En general, los efectos observados tanto en asma como en EPOC son equiparables a los de otras combinaciones de agonistas β2 adrenérgicos de larga duración (formoterol, salmeterol) y glucocorticoides (propionato de fluticasona, budesonida, beclometasona), con una clara superioridad sobre el glucocorticoide solo. En algunos grupos – generalmente, con las dosis inferiores – no llega a alcanzarse la significación estadística en la superioridad de la combinación frente a los componentes por separado, aunque esta circunstancia no es inhabitual en otras combinaciones previamente autorizadas. En cualquier caso, en términos generales, la relevancia clínica del efecto diferencial de la combinación parece significativa para la mayoría del comité de evaluación (CHMP) de la Agencia Europea de Medicamentos (EMA), aunque algunos de sus miembros mantuvieron una posición discrepante, resaltando que en los pacientes asmáticos la superioridad de la combinación sobre los componentes por separado en relación al efecto broncodilatador y a la mejoría sintomática no había sido suficientemente demostrada; asimismo, en EPOC, tampoco aprecian un claro beneficio sintomático.
El perfil de seguridad de la combinación está en línea con el de otras combinaciones conocidas (nasofaringitis y cefalea, principalmente) y no se han observado eventos adversos específicos; en cualquier caso, la incidencia no es elevada y no es un motivo frecuente de suspensión del tratamiento. No obstante, se han registrado algunos casos mortales aislados de neumonía.
En definitiva, se trata de la primera combinación de un agonista β2 adrenérgicos de larga duración (LABA, long-acting beta-adrenoceptor agonist) y un glucocorticoide que está disponible para su uso tanto en asma como en EPOC y que solo requiere una única administración diaria en inhalación, lo cual, presumiblemente, podría facilitar la tasa de adherencia al tratamiento y, con ello, mejorar el curso y el pronóstico en estos pacientes (Caramori, 2014). En este sentido, hasta ahora, al menos en España, las únicas combinaciones disponibles comercialmente de un LABA (formoterol, salmeterol) y glucocorticoides (beclometasona, budesonida, propionato de fluticasona) solo estaban autorizadas para el tratamiento del asma (con la excepción de salmeterol/fluticasona, que también lo está para EPOC) y todos ellos requieren la administración de dos dosis diarias (cada 12 h).
La terapéutica farmacológica actual del asma y la enfermedad pulmonar obstructiva crónica (EPOC) se fundamenta principalmente en el uso de fármacos broncodilatadores de corta y/o larga duración de acción, como los β2-agonistas y anticolinérgicos administrados por vía inhalatoria, pudiendo también considerarse el uso de teofilina por vía oral. La utilización de esteroides inhalados solos o en combinación con β2-agonistas de larga duración de acción es también relevante, así como la posible utilización de los inhibidores de la isoenzima 4 de la fosfodiesterasa, como el roflumilast. Sin embargo, ninguno de los fármacos actualmente utilizados en el tratamiento del asma y de la EPOC ha demostrado capacidad para modificar favorablemente el deterioro inexorable de la función pulmonar y del estado general de estos pacientes (Cortijo, 2104b).
|
VALORACIÓN |
|
|---|---|
|
Vilanterol/Fluticasona ► RELVAR ELLIPTA® (GlaxoSmithKline) |
|
|
Grupo Terapéutico (ATC): R03AK. APARATO RESPIRATORIO. Medicamentos contra alteraciones obstructivas pulmonares: combinación de adrenérgicos con corticosteroides. |
|
|
Indicaciones autorizadas: Tratamiento regular del asma en adultos y adolescentes de 12 años de edad y mayores cuando la administración de una combinación (un agonista β2 de acción prolongada y un corticosteroide por vía inhalatoria) sea apropiada: pacientes no controlados adecuadamente con corticosteroides inhalados y agonistas β2 inhalados de acción corta administrados "a demanda". También está indicado para el tratamiento sintomático de adultos con EPOC, con un FEV1 <70% del normal (post-broncodilatador) y una historia clínica de exacerbaciones a pesar del uso regular de una terapia broncodilatadora. |
|
|
Valoración global: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣ ♣ |
|
Novedad físico-química: Mejora las características farmacocinéticas, con incidencia en las condiciones de uso. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA* |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Salbutamol/Beclometasona |
Butosol |
Aldo Unión |
1981 |
|
Salmeterol/Fluticasona |
Seretide |
Glaxo SmithKline |
2001 |
|
Formoterol/Budesonida |
Symbicort |
AstraZeneca |
2002 |
|
Formoterol/Beclometasona |
Foster |
Chiesi |
2007 |
|
Vilanterol/Fluticasona |
Relvar Ellipta |
Glaxo SmithKline |
2014 |
* Se indican únicamente los primeros registros autorizados con ese principio activo.
Bibliografía
Bibliografía
- Bateman ED, O’Byrne PM, Busse WW, Lötvall J, Bleecker ER, Andersen L, Jacques L, Frith L, Lim J, Woodcock A. Once-daily fluticasone furoate (FF)/vilanterol reduces risk of severe exacerbations in asthma versus FF alone. Thorax. 2014; 69(4): 312-9. doi: 10.1136/thoraxjnl-2013-203600.
- Bleecker ER, Lötvall J, O’Byrne PM, Woodcock A, Busse WW, Kerwin EM, Forth R, Medley HV, Nunn C, Jacques L, Bateman ED. Fluticasone Furoate-Vilanterol 100-25 mcg Compared with Fluticasone Furoate 100 mcg in Asthma: A Randomized Trial. J Allergy Clin Immunol Pract. 2014; 2(5): 553-61. doi: 10.1016/j.jaip.2014.02.010.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cortijo Gimeno J, Milara Paya J, Morcillo Sánchez E. Terapéutica del asma, EPOC e insuficiencia respiratoria. En: Terapéutica farmacológica de los trastornos de los aparatos respiratorio, osteomuscular y genitourinario. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2014. pp. 21-44.
- Cortijo Gimeno J, Milara Paya J, Morcillo Sánchez E. Antiasmáticos. En: Terapéutica farmacológica de los trastornos de los aparatos respiratorio, osteomuscular y genitourinario. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2014. pp. 1-20.
- Dransfield MT, Bourbeau J, Jones PW, Hanania NA, Mahler DA, Vestbo J, Wachtel A, Martinez FJ, Barnhart F, Sanford L, Lettis S, Crim C, Calverley PM. Once-daily inhaled fluticasone furoate and vilanterol versus vilanterol only for prevention of exacerbations of COPD: two replicate double-blind, parallel-group, randomised controlled trials. Lancet Respir Med. 2013; 1(3): 210-23. doi: 10.1016/S2213-2600(13)70040-7.
- European Medicines Agency (EMA). Relvar Ellipta®. European Public Assessment Report (EPAR). EMA/593102/2013; EMEA/H/C/002673. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002673/WC500157635.pdf
- Kerwin EM, Scott-Wilson C, Sanford L, Rennard S, Agusti A, Barnes N, Crim C. A randomised trial of fluticasone furoate/vilanterol (50/25 μg; 100/25 μg) on lung function in COPD. Respir Med. 2013; 107(4): 560-9. doi: 10.1016/j.rmed.2012.12.014.
- Martinez FJ, Boscia J, Feldman G, Scott-Wilson C, Kilbride S, Fabbri L, Crim C, Calverley PM. Fluticasone furoate/vilanterol (100/25; 200/25 μg) improves lung function in COPD: a randomised trial. Respir Med. 2013; 107(4): 550-9. doi: 10.1016/j.rmed.2012.12.016.
- O’Byrne PM, Bleecker ER, Bateman ED, Busse WW, Woodcock A, Forth R, Toler WT, Jacques L, Lötvall J. Once-daily fluticasone furoate alone or combined with vilanterol in persistent asthma. Eur Respir J. 2014; 43(3): 773-82. doi: 10.1183/09031936.00064513.
- Woodcock A, Bleecker ER, Lötvall J, O’Byrne PM, Bateman ED, Medley H, Ellsworth A, Jacques L, Busse WW. Efficacy and safety of fluticasone furoate/vilanterol compared with fluticasone propionate/salmeterol combination in adult and adolescent patients with persistent asthma: a randomized trial. Chest. 2013; 144(4): 1222-9. doi: 10.1378/chest.13-0178.
1 El enfisema es un concepto anatomopatológico indicativo de destrucción de pared alveolar y agrandamiento anormal de los espacios aéreos distales a los bronquiolos terminales, sin fibrosis pulmonar evidente.
2 La definición de bronquitis crónica es puramente clínica: presencia de tos y expectoración durante más de 3 meses al año, al menos 2 años consecutivos, en pacientes en los que se han excluido otras causas de tos productiva. Sin embargo, para incluirse dentro del marco de la EPOC, la bronquitis crónica debe cursar con obstrucción crónica al flujo aéreo.
Artículos relacionados
-
23 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




