Tedizolid SIVEXTRO® (Merck Sharp Dohme)
 Nº389
Nº389
Resumen
El tedizolid es un agente antibacteriano, estrechamente relacionado con el linezolid tanto química como estructuralmente, cuyo mecanismo de acción consiste en la inhibición de la formación del complejo funcional de iniciación 70S del ribosoma bacteriano. Ha sido autorizado para el tratamiento de infecciones bacterianas agudas de la piel y tejidos blandos de la piel. El tedizolid tiene un efecto básicamente bacteriostático sobre las especies bacterianas Gram-positivas sensibles y actúa específicamente inhibiendo la iniciación de la síntesis proteica, al interferir de forma selectiva con el proceso de translación, que implica una interacción con la subunidad 50S y, específicamente con el dominio V del centro 23S de la ARNr peptidil transferasa, lo que impide la unión del ARNt.
INFECCIONES DE LA PIEL Y TEJIDOS BLANDOS
Las infecciones de piel y tejidos blandos constituyen la tercera causa más frecuente de infecciones, tras las urinarias y las respiratorias (Calvo, 2007), siendo aún más frecuentes en los mayores que en la población general y, particularmente, en las personas hospitalizadas, debido a la coexistencia de varios factores de riesgo: inmunodepresión, malnutrición, diabetes, otras afecciones crónicas, incontinencia fecal. Asimismo, en las residencias, el 10% de los pacientes que siguen un tratamiento antibiótico lo realiza por una infección de piel o tejidos blandos.
Entre los motivos por los que las personas mayores son más susceptibles a las infecciones de la piel y tejidos blandos cutáneos, destaca el hecho de que en la edad avanzada todas las capas de la piel se encuentran alteradas, debido fundamentalmente a una disminución en la velocidad de renovación de células y en la acumulación consiguiente de células muertas. Asimismo, el estrato córneo es más delgado, sobre todo en zonas expuestas, tiene menor contenido en agua y mayor velocidad de descamación, mientras que la epidermis también es más delgada y en la dermis y la hipodermis disminuye el número de glándulas sudoríparas.
Las infecciones de la piel más frecuentes en los mayores son las bacterianas por grampositivos, el intertrigo, el herpes y la onicomicosis. El punto de entrada más frecuente de las infecciones de la piel son las soluciones de continuidad por pequeñas heridas, aunque también lo pueden ser traumatismos o heridas quirúrgicas. La fiebre, el signo cardinal de las infecciones, está ausente o se presenta más tarde en el 20-30% de los casos, lo que retrasa el diagnóstico y aumenta la mortalidad.
Las bacterias que más frecuentemente ocasionan infecciones en la piel y tejidos blandos del anciano son los grampositivos, como estreptococos betahemolíticos del grupo A (Streptocuccus pyogenes) y Staphylococcus aureus; las infecciones por gramnegativos y anaerobios son más raras. Aunque el estreptococo es más frecuente en la piel del anciano, en los pliegues cutáneos con humedad y maceración son más frecuentes las enterobacterias. En los últimos años ha habido un aumento alarmante en la incidencia de infecciones por grampositivos multirresistentes como el Staphylococcus aureus resistente a meticilina (SARM) y el neumococo (Streptococcus pneumoniae) resistente, que está obligando a cambiar el perfil clásico del tratamiento antibiótico Las infecciones bacterianas más frecuentes son la erisipela y la celulitis, la fascitis necrosante, el impétigo, la ectima, la foliculitis y el eritrasma.
La erisipela es la infección bacteriana de la dermis, mientras que la celulitis también afecta al tejido celular subcutáneo y es menos demarcada. Se localiza sobre todo en las extremidades inferiores y en segundo lugar en la cara. Se manifiesta con eritema, tumefacción, calor y dolor. En la erisipela se forman con frecuencia ampollas superficiales, que pueden hacerse hemorrágicas o necróticas. Una celulitis grave puede producir necrosis dérmica afectando también a fascia y músculo subyacente. Los gérmenes causantes más frecuentes de la erisipela son los estreptococos betahemolíticos (A: Streptococcus pyogenes; B: Streptococcus agalactiae), aunque también pueden producirse por otros estreptococos o estafilococos. En la celulitis, la etiología suele ser más variada, con predominio de estreptococos y también pueden estar implicados neumococos y gramnegativos. Las complicaciones en ancianos son muy frecuentes cuando no se instaura tratamiento antibiótico. Pueden evolucionar a fascitis, necrosis y sepsis. En las extremidades pueden producir linfedema, elefantiasis y trombosis venosa profunda. La celulitis orbitaria es frecuente en ancianos y suele producirse por Streptococcus viridans (un estreptococo alfahemolítico) solo o asociado a gramnegativos.
La fascitis necrosante es una infección particularmente destructiva que causa rápidamente la necrosis de tejidos profundos. La etiología es polimicrobiana e incluye cocos grampositivos y gramnegativos, y anaerobios, como Escherichia coli, Klebsiella pneumoniae y Pseudomonas aeruginosa. Alrededor del 10% está producida por Streptococcus pyogenes, y puede evolucionar a gangrena estreptocócica. Las lesiones menores, como los forúnculos, se encuentran en alrededor del 20% de los pacientes antes de que presenten una fascitis necrosante.
El impétigo es una infección superficial de la piel, que en ancianos se presenta en forma ampollosa, producida por Staphylococcus aureus y Streptococcus pyogenes. Se presenta sobre áreas de piel normal o eritematosa sobre la que aparecen lesiones vesiculoampollosas, de consistencia flácida y ligeramente pruriginosas. Se manifiesta como placas rojas, blandas, dolorosas, calientes y bien delimitadas. El contenido de las ampollas es claro, seroso o purulento. En el impétigo ampolloso el estado general suele ser bueno y sin fiebre; son raras las complicaciones como la linfadenitis o la glomerulonefritis.
La ectima es una infección vesiculopustulosa, que posteriormente se abre y forma una úlcera de márgenes elevados indurados y violáceos, que es más profunda que el impétigo. Se localiza casi siempre en las extremidades inferiores, donde las lesiones ampollosas dejan a la luz unas úlceras de fondo granuloso, exudativo, purulento y con bordes indurados. Evoluciona favorablemente con linfangitis, fiebre, adenopatías y malestar general.
Las foliculitis son infecciones superficiales o profundas que asientan alrededor de un folículo piloso. Se localizan en cualquier zona de pelo corto y grueso, como cuero cabelludo, barba, axilas, nalgas y extremidades inferiores. Son lesiones pustulosas de pequeño tamaño, alrededor de un pelo y rodeadas de un halo eritematoso y ligeramente pruriginosas. Su etiología más frecuente es Staphylococcus aureus, pero pueden estar involucrados estreptococos y gramnegativos. Por su parte, el furúnculo es una foliculitis aguda, profunda y necrosante, que aparece en zonas pilosas de roce o presión, que se inicia como un nódulo duro, rojo y doloroso, que crece rápidamente de tamaño y se rodea de un edema considerable y es muy doloroso. Puede acompañarse de fiebre y malestar general. Pueden ocasionar complicaciones locales (linfadenitis, linfangitis) o generales (osteomielitis, endocarditis, sepsis). Finalmente, el ántrax consiste en una foliculitis profunda que se produce sobre todo en pacientes diabéticos, malnutridos y con malas condiciones de higiene. Afecta a la raíz de varios pelos, así como al tejido dérmico y subcutáneo de alrededor, con la formación de varios focos de necrosis. Se localizan más en nuca y espalda. Se presenta como una placa elevada, edematosa, roja, caliente y dolorosa. Se acompañan de fiebre elevada, dolor intenso y malestar general. Los factores que favorecen la aparición de estas lesiones son: la alta carga nasal de colonizados por Staphylococcus aureus resistentes a meticilina (SARM), los arañazos, la diabetes mellitus, la obesidad, las neoplasias linfoproliferativas, la desnutrición y el tratamiento previo con glucocorticoides o inmunosupresores.
El eritrasma es una infección crónica que se da más en mayores hospitalizados. Está causada por Corynebacterium minutissimum y se presenta como una placa delimitada de forma variable, que al inicio es húmeda y roja, y tiende a volverse marrón y descamativa. Se localiza en pliegues interdigitales de pies, ingles o axilas.
Durante las últimas décadas, el Staphylococcus aureus se ha ido haciendo progresivamente resistente a la meticilina (SARM) y estas cepas se han difundido a escala mundial, no solo en el ámbito hospitalario sino incluso en cuadros infecciosos adquiridos en la comunidad. A esto cabe agregar que un porcentaje creciente de cepas de SARM está adquiriendo la condición de multirresistente, siendo insensibles a diversos antibacterianos: linezolid, clindamicina, estreptograminas, pleuromutilinas (tiamulina), etc. En España existen muy pocos datos acerca de la prevalencia de infecciones por Staphylococcus aureus resistentes a meticilina adquiridos en la comunidad (SARMAC); sin embargo, en un estudio observacional prospectivo realizado en un Servicio de Urgencias de la Comunidad de Madrid (Casado, 2010), donde se evaluaron todos los pacientes que ingresaron en este servicio con una infección cutánea supurativa adquirida en la comunidad a lo largo de un semestre, la prevalencia de SARMAC entre estos pacientes fue del 22% y entre las infecciones estafilocócicas del 33%.
ACCIÓN Y MECANISMO
El tedizolid es un agente antibacteriano, estrechamente relacionado con el linezolid tanto química como estructuralmente, cuyo mecanismo de acción consiste en la inhibición de la formación del complejo funcional de iniciación 70S del ribosoma. Ha sido autorizado para el tratamiento de infecciones bacterianas agudas de la piel y tejidos blandos de la piel.
Los ribosomas son los orgánulos celulares responsables de la síntesis proteica, que están formados por una fracción proteica y por otra de ácido nucleico (ARN ribosomal o ARNr). Estructuralmente están compuestos por dos subunidades de diferente densidad, conocidas como 50S y 30S1. Las dos subunidades se combinan durante la síntesis proteica para formar un ribosoma completo de densidad 70S, cuyo diámetro real es de aproximadamente 25 nm. Una bacteria normal tiene una media 15.000 ribosomas.
Los ribosomas actúan como una auténtica fábrica en cadena para producir proteínas, recibiendo y traduciendo las instrucciones genéticas para la síntesis de proteínas específicas. Durante este proceso, el ARN mensajero (ARNm) – que no es más que una copia simple de una parte concreta del ADN – se une a la subunidad 30S, mientras que el ARN de transferencia (ARNt) transporta a un aminoácido específico (sólo existe un número determinado de ARNt, equivalente al número de aminoácidos fisiológicos: 20), que se une a la subunidad 50S.
El tedizolid tiene un efecto básicamente bacteriostático sobre las especies bacterianas Gram-positivas sensibles y actúa específicamente inhibiendo la iniciación de la síntesis proteica, al interferir de forma selectiva con el proceso de translación2, que implica una interacción con la subunidad 50S y, específicamente con el dominio V del centro 23S de la ARNr peptidil transferasa. También se produce, de forma secundaria, una interacción con la subunidad 30S. La unión del tedizolid con la subunidad 50S impide la unión del ARNt, aunque no la actividad del enzima peptidil transferasa (Cuéllar, 2001).
El tedizolid es, en término medio, unas 3,4 veces más potente que el linezolid como inhibidor de la síntesis proteica en células procariotas y 4-32 veces más potente frente a bacterias Gram-positivas, incluyendo cepas resistentes a vancomicina y linezolid. Tiene un espectro antibacteriano fundamentalmente limitado a bacterias Gram-positivas, con actividad particularmente relevante sobre estafilococos (Staphylococcus aureus, S. epidermidis y otros coagulasa-negativos), enterococos (Enterococcus faecium, E. faecalis), estreptococos (Streoptococcus pyogenes, S. agalactiae, S. anginosus, S. penumonaie, S. viridans), Corynebacterium jeikeium, Listeria monocytogenes, Legionella pneumophyla, Mycobacterium spp. (M. tuberculosis, M. avium, M. kansaii), Nocardia brasiliensis, Clostridium spp. (C. difficile, C. perfringens) y Peptostreptococcus spp. (P. micros, P. anaerobius).
Los valores promedio de la concentración mínima inhibitoria para el 90% de los aislados (CMI90%) son del orden de 0,5 µg/ml para Staphylococcus aureus sensibles a meticilina (MSSA), 1,0 µg/ml para S. aureus resistentes a meticilina (MRSA), 8,0 µg/ml para S. aureus resistentes a linezolid y 1 µg/ml para S. aureus resistentes a vancomicina. En el caso de los enterococos y estreptococos, están en torno a 0,25 µg/ml.
El tedizolid tiene un bajo potencial de inducción de resistencias bacterianas por estafilococos, enterococos y estreptococos, sin que se observe a concentraciones en las que sí se registra con linezolid. El principal mecanismo de resistencia bacteriana al tedizolid es el mismo que el de linezolid y consiste en la aparición de la mutación G2576T al nivel del gen que codifica la subunidad 23S bacteriana.
ASPECTOS MOLECULARES
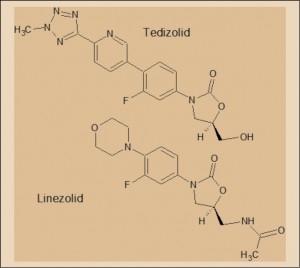
El tedizolid forma parte de la serie de (R)-3-aril-5-metil-2-oxazolidinonas, genéricamente conocido como oxazoladinonas, cuyo primer representante introducido en clínica fue el linezolid. El desarrollo de las oxazolidinonas se inició en 1987 (EI du Pont), aunque los primeros antibacterianos sintetizados fueron desechados por problemas de toxicidad y de farmacocinética desfavorable. Posteriormente, a principios de la década de 1990, los laboratorios Pharmacia-Upjohn sintetizaron dos derivados muchos menos tóxicos, eperezolid (PNU-1005929) y linezolid (PNU-100766), de los que el primero fue también desechado por su farmacocinética desfavorable.
Merece la pena destacar dos aspectos estructurales. El primero es el anillo de oxazolidinona, que no es otra cosa más que un carbamato cíclico, aunque con exigencias estereoespecíficas derivadas de la existencia de un átomo de carbono asimétrico en el anillo (sólo es activo biológicamente el isómero R). Esta estructura es capaz de comportarse como un falso aminoácido que es capaz de incorporarse al proceso de translación, durante el cual el ARNt recoge aminoácidos específicos y procede a transferirlos a los ribosomas para que sean insertados en la posición adecuada de la cadena proteica en formación, dentro de la síntesis proteica bacteriana.
La otra peculiaridad estructural consiste en la presencia de un átomo de flúor sobre el anillo aromático ligado al anillo de oxazolidinona (dicho anillo aromático es imprescindible para la actividad antibacteriana), que incrementa notablemente las propiedades antibacterianas. Es difícil no establecer un cierto paralelismo por este motivo con las antiguas quinolonas (ácido oxolínico, etc.), que vieron notablemente incrementado su espectro y potencia antibacteriana en las fluoroquinolonas (ciprfloxacino, etc.) con la simple introducción de este elemento.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del tedizolid han sido adecuadamente contrastadas en las indicaciones autorizadas mediante dos amplios ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos, doblemente ciegos, doblemente simulados y controlados con linezolid.
Los pacientes incluidos en ambos ensayos clínicos presentaban celulitis/erisipelas, accesos cutáneos graves o heridas infectadas con una superficie afectada mínima de 75 cm2 y al menos un signo regional o sistémico de infección (linfadenopatía, fiebre, ≥10% neutrófilos inmaduros o recuento anormal de leucocitos en sangre periférica). La dosificación utilizada en ambos estudios fue de 200 mg/24 h de tedizolid durante 6 días o de 600 mg/12 h de linezolid durante 10 días, en ambos casos por vía oral. Todos los pacientes comenzaron el tratamiento por vía intravenosa (con al menos una dosis con tedizolid y dos con linezolid), pudiendo cambiarse a la administración oral siempre que se cumpliesen dos de los siguientes cuatro criterios: no aumentase el tamaño de la lesión, temperatura corporal inferior a 38º C, ausencia de signos o síntomas locales de empeoramiento desde la última visita y mejoría de al menos un signo local o síntoma asociado a la infección.
Como covariables primarias se emplearon la tasa de curación clínica por intención de tratar (ITT) y clínicamente evaluable (CE) a los 7-14 días después de finalizar el tratamiento, entendiendo como curación clínica el cumplimiento de todos los siguientes criterios: resolución completa o casi completa de la mayoría de síntomas y signos específicos de la infección, ausencia o resolución casi completa de los signos sistémicos de infección (linfadenopatía, fiebre, ≥10% neutrófilos inmaduros o recuento anormal de leucocitos en sangre periférica), ausencia de nuevos signos, síntomas o complicaciones relacionadas con la infección.
|
Tabla 1. Estudios clínicos de fase 3 con tedizolid controlados con linezolid |
|||
|
Tipo de pacientes |
Adultos (≥18 años) |
Niños mayores y adultos (≥12 años) |
Análisis conjunto |
|
Pacientes aleatorizados |
667 |
666 |
1333 |
|
Finalizaron el estudio (%) |
90,9% |
91,7% |
91,3% |
|
Edad (mediana; % pac. <65 años) |
43 años 91,8% <65 años |
46 años 88,6% <65 años |
45 años 90,2% <65 años |
|
Sexo (% varones) |
60,3% |
65,9% |
63,1% |
|
Raza (% blancos) |
83,2% |
85,1% |
84,1% |
|
IMC (mediana; kg/m2) |
27,4 |
27,1 |
27,3 |
|
Linfadenopatía basal (% pac.) |
86,7% |
70,6% |
78,7% |
|
Recuento alterado de leucocitos |
41,0% |
49,1% |
45,1% |
|
>10% de neutrófilos inmaduros (% pac.) |
3,4% |
14,2% |
8,8% |
|
Fiebre (≥38º C) |
17,9% |
30,0% |
24,0% |
|
Staphylococcus aureus sensible a meticilina (MSSA; % pac.) |
40,7% |
54,2% |
47,5% |
|
Staphylococcus aureus resistente a meticilina (MRSA; % pac.) |
42,6% |
27,3% |
35,0% |
|
Streptococcus pyogenes (% pac.) |
2,9% |
10,3% |
6,6% |
|
Streptococcus anginosus/milleri (% pac.) |
7,2% |
6,8% |
7,0% |
|
Tasa de curación clínica (% pac.), |
Tedizolid: 85,5% Linezolid: 86,0% |
Tedizolid: 88,0% Linezolid: 87,7% |
Tedizolid: 86,7% Linezolid: 86,8% |
|
Tasa de curación clínica (% pac.), |
Tedizolid: 94,6% Linezolid: 95,4% |
Tedizolid: 92,4% Linezolid: 96,1% |
Tedizolid: 93,5% Linezolid: 95,7% |
|
Tasa de erradicación microbiológica |
Tedizolid: 85,6% Linezolid: 86,6% |
Tedizolid: 87,8% Linezolid: 88,6% |
Tedizolid: 86,7% Linezolid: 87,6% |
|
Tasa de erradicación microbiológica |
Tedizolid: 95,9% Linezolid: 98,8% |
Tedizolid: 93,0% Linezolid: 97,0% |
Tedizolid: 94,4% Linezolid: 97,9% |
|
Respuesta clínica precoz |
Tedizolid: 75,9% Linezolid: 79,4% |
Tedizolid: 85,0% Linezolid: 83,0% |
Tedizolid: 81,6% Linezolid: 79,4% |
|
Tasa de curación clínica (% pac., ITT/CE), en pacientes infectados por Staphylococcus aureus meticilina-resistentes (MRSA) |
- |
- |
Tedizolid: 84,8/93,5% Linezolid: 81,5/97,4% |
|
Referencia |
ESTABLISH-1; Prokocimer, 2013 |
ESTABLISH-2; Moran, 2014 |
Shorr, 2015 |
Nota: Ninguna de las diferencias entre los datos correspondientes al tedizolid y los del linezolid fueron estadísticamente significativas.
Desde el punto de vista de la seguridad, el tedizolid presenta un perfil toxicológico equiparable al del linezolid, con eventos adversos generalmente leves o moderados, transitorios y tratables fácilmente. La incidencia global de eventos adversos relacionados con el tratamiento en los ensayos clínicos pivotales fue del 22,4% (tedizolid) y 27,9% (linezolid), siendo graves en el 1,8% y 2,0%, respectivamente. Los porcentajes de pacientes que suspendieron el tratamiento por este motivo fueron del 0,5% y 0,9% (EMA, 2015).
Los eventos adversos más frecuentes fueron de naturaleza digestiva (16,0-16,3% con tedizolid vs. 20,5-26,0% con linezolid), siendo estadísticamente significativas las diferencias relativas a náusea (8,2-8,8 vs. 11,0-14,3%) y vómitos (3,0-3,3% vs. 5,2-6,3%); también fue significativa la diferencia de trombocitopenia (6,4 vs. 12,6%); en cambio, no lo fue la cefalea (5,7-6,3% vs. 6,0-6,7%).
Se observaron algunas diferencias en la incidencia de eventos adversos en función de la vía de administración del tedizolid. En concreto, la incidencia de trastornos gastrointestinales fue del 16,3% por vía oral, 18,4% con evolución de IV a oral y del 4,7% con IV exclusiva; en concreto, náusea (8,5/9,0/3,1%), vómitos (2,7/3,7/0%), fatiga (0,3/0,7/9,4%), deshidratación (0,9/0/3,1%), cefalea (6,3/6,7/3,1%), insomnio (1,8/0,4/4,7%) e hipertensión (0,6(0,7/1,6%).
Se ha observado un empeoramiento en al menos dos grados de gravedad (sobre un máximo de cinco) en los siguientes parámetros hematológicos: anemia (1,0% con tedizolid vs. 0,7% con linezolid), leucocitosis (2,6 vs. 1,7%), neutropenia (0,5 vs. 1,3%) y trombocitopenia (1,4 vs. 0,7%).
ASPECTOS INNOVADORES
El tedizolid es un agente antibacteriano, estrechamente relacionado con el linezolid tanto química como estructuralmente, cuyo mecanismo de acción consiste en la inhibición de la formación del complejo funcional de iniciación 70S del ribosoma. Ha sido autorizado para el tratamiento de infecciones bacterianas agudas de la piel y tejidos blandos de la piel. El tedizolid tiene un efecto básicamente bacteriostático sobre las especies bacterianas Gram-positivas sensibles y actúa específicamente inhibiendo la iniciación de la síntesis proteica, al interferir de forma selectiva con el proceso de translación, que implica una interacción con la subunidad 50S y, específicamente con el dominio V del centro 23S de la ARNr peptidil transferasa, lo que impide la unión del ARNt.
Tiene un espectro antibacteriano fundamentalmente limitado a bacterias Gram-positivas, con actividad particularmente relevante sobre estafilococos (tanto sensibles como resistentes a meticilina), enterococos, estreptococos, Corynebacterium jeikeium, Listeria monocytogenes, Legionella pneumophyla, Mycobacterium spp., Nocardia brasiliensis, Clostridium spp. y Peptostreptococcus spp.
El tedizolid tiene un bajo potencial de inducción de resistencias bacterianas por estafilococos, enterococos y estreptococos, sin que se observe a concentraciones en las que sí se registra con linezolid. El principal mecanismo de resistencia bacteriana al tedizolid es el mismo que el de linezolid y consiste en la aparición de la mutación G2576T al nivel del gen que codifica la subunidad 23S bacteriana.
Dos amplios estudios clínicos de fase 3 (confirmatorios de eficacia y seguridad) controlados con linezolid ha mostrado que el tedizolid no es inferior a aquel, tanto en términos de curación clínica (86,7/86,8% por intención de tratar; 93,5/95,7% clínicamente evaluable) como de erradicación bacteriana (86,7/87,6% por intención de tratar; 94,4/97,9% clínicamente evaluable), con especial relevancia en los cuadros causados por Staphylococcus aureus resistencia a meticilina (MRSA): 84,4/93,5% y 81,5/97,4%).
Presenta un perfil aceptable de toxicidad, en línea con la observada anteriormente con linezolid, con efectos adversos en general leves o moderados y reversibles. Los más comunes (<10%) son náusea, cefalea, vómitos y trombocitopenia, todos los cuales – salvo la cefalea – fueron significativamente menos frecuentes con tedizolid que con linezolid. Aunque presenta in vitro un leve efecto inhibidor de la monoamino oxidasa (IMAO), no se ha apreciado efectos significativos en clínica.
La menor duración del tratamiento con tedizolid (6 días), con relación al linezolid (10 días) podría estar detrás de la menor incidencia de algunos eventos adversos observados en los ensayos clínicos pivotales, particularmente relacionados con una potencial mielosupresión y su efecto sobre las células sanguíneas; sin embargo, la incidencia de trastornos hematológicos graves (empeoramiento de al menos de dos niveles sobre un total de cinco) no parece confirmar esta previsión. De hecho, los cuadros graves de trombocitopenia (1,4 vs. 0,7%) y de leucocitosis (2,6 vs. 1,7%) fueron más frecuentes con tedizolid que con linezolid, no así con los de neutropenia (0,5 vs. 1,3%). Precisamente, en relación con lo anterior, cabe decir que no se dispone de datos de eficacia y de seguridad en pacientes inicialmente con neutropenia, dado que fueron excluidos por protocolo en los dos ensayos clínicos pivotales.
Para el Informe de Posicionamiento Terapéutico (AEMPS, 2015), el tedizolid es una alternativa al linezolid y a otros antibacterianos utilizados en esta misma indicación (vancomicina, teicoplanina, daptomicina, tigeciclina, dalvabancina, etc.), pero sin diferencias clínicamente relevantes.
No obstante, se ha resaltado (Durkin, 2015) el menor número de dosis diarias (1 vs. 2) y, especialmente, la menor duración del tratamiento (6 vs. 10 días) que el linezolid para esta indicación3; asimismo, se ha indicado un menor potencial de interaccionar con otros fármacos, debido a su menor capacidad de actuar como IMAO y una incidencia global de eventos adversos, particularmente digestivos, menor que con linezolid. En cualquier caso, como hemos visto, no parece que haya diferencias sustanciales en lo que se refiere a los efectos adversos clínicamente más relevantes. Por todo ello, solo puede considerarse como una modesta innovación fundamentalmente de carácter farmacocinético, que permite una posología diaria más cómoda y de duración más corta.
|
VALORACIÓN |
|
|
TEDIZOLID
|
|
|
Grupo Terapéutico (ATC): J01XX. TERAPIA ANTIINFECCIOSA, USO SISTÉMICO. Antibacterianos: otros. |
|
|
Indicaciones autorizadas: Tratamiento de infecciones bacterianas agudas de la piel y tejidos blandos de la piel. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣ ♣ |
|
Novedad físico-química: Mejora las características farmacocinéticas, con incidencia en las condiciones de uso. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Linezolid |
Zyvoxid |
Pfizer |
2001 |
|
Tedizolid |
Sivextro |
Merck Sharp Dohme |
2015 |
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de tedizolid fosfato (Sivextro®) en el tratamiento de las infecciones de la piel y tejidos blandos. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-tedizolid-sivextro.pdf. Fecha de publicación: 21 de octubre de 2015
- Calvo Aguirre JJ, Martínez Bengui C. Infecciones de piel y tejidos blandos en el anciano. Rev Esp Geriat Geron 2007; 42(Supl 1): 6-7. doi: 10.1016/S0210-5705(09)71003-9
- Casado Verrier B, Gómez Fernández C, Paño Pardo JR, Gómez Gil R, Mingorance Cruz J, Moreno Alonso de Celada R, Herranz Pinto P. Prevalencia de infecciones de piel y tejidos blandos producidas por Staphylococcus aureus resistente a Meticilina Comunitario en Madrid. Enferm Infecc Microbiol Clin 2012; 30(6): 300–6. doi:10.1016/j.eimc.2011.11.011
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Linezolid (Zyvoxid®) en neumonía. Panorama Actual Med 2001; 25(249): 1002-5.
- Durkin MJ, Corey GR. New developments in the management of severe skin and deep skin structure infections – focus on tedizolid. Ther Clin Risk Manag. 2015; 11:857-62. doi: 10.2147/TCRM. S64553.
- European Medicines Agency (EMA). Sivextro®. European Public Assessment Report (EPAR). EMA/169448/2015; EMEA/H/C/002846. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002846/WC500184803.pdf
- Moran GJ, Fang E, Corey GR, Das AF, De Anda C, Prokocimer P. Tedizolid for 6 days versus linezolid for 10 days for acute bacterial skin and skin-structure infections (ESTABLISH-2): a randomised, double-blind, phase 3, non-inferiority trial. Lancet Infect Dis. 2014; 14(8): 696-705. doi: 10.1016/S1473-3099(14)70737-6.
- Prokocimer P, De Anda C, Fang E, Mehra P, Das A. Tedizolid phosphate vs linezolid for treatment of acute bacterial skin and skin structure infections: the ESTABLISH-1 randomized trial. JAMA. 2013; 309(6): 559-69. doi: 10.1001/jama.2013.241.
- Shorr AF, Lodise TP, Corey GR, De Anda C, Fang E, Das AF, Prokocimer P. Analysis of the phase 3 ESTABLISH trials of tedizolid versus linezolid in acute bacterial skin and skin structure infections. Antimicrob Agents Chemother. 2015; 59(2): 864-71. doi: 10.1128/AAC.03688-14.
1 “S” es la unidad de densidad Svedberg, utilizada en la caracterización de los ribosomas.
2 La translación es uno de los procesos que constituyen la síntesis proteica, durante el cual el ARNt recoge aminoácidos específicos y procede a transferirlos a los ribosomas para que sean insertados en la posición adecuada de la cadena proteica en formación, de acuerdo con la información contenida en la cadena de ARNm.
3 Zyvoxid® (linezolid) tiene autorizada también la indicación de neumonía (nosocomial y adquirida en la comunidad), además de la de infecciones de piel y tejidos blandos.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





