Sufentanilo SUFENTANILO G.E.S.® (G.E.S.)
 Nº382
Nº382
Resumen
El sufentanilo es un analgésico opioide muy potente perteneciente al grupo de las anilidopiperidinas, junto con fentanilo, alfantenilo y remifentanilo, con lo que guarda una estrecha relación química y farmacológica. Ha sido autorizado como coadyuvante analgésico para el mantenimiento de una anestesia general equilibrada de media o larga duración en asociación con un hipnótico y/o un agente anestésico volátil y un agente miorrelajante. Asimismo, como anestésico principal para la inducción y mantenimiento de una anestesia analgésica, con 100% de oxígeno, en el curso de intervenciones de cirugía mayor, tal como la cirugía cardiovascular; en la administración epidural, en dosis única o repetida o en perfusión, sólo o en asociación con un anestésico local para anestesia quirúrgica, obstétrica o post-operatoria; en sedación prolongada, en unidades de cuidados intensivos o en reanimación de pacientes ventilados.
El sufentanilo no es un nuevo fármaco; de hecho, viene utilizándose en muchos países desde hace varias décadas. Su reciente incorporación al arsenal farmacéutico español obedece a cuestiones administrativas más que a aspectos clínicos. En cualquier caso, las diferencias del sufentanilo con el resto de fármacos de este grupo farmacológico se relacionan fundamentalmente con la rapidez y la duración de sus efectos analgésicos-anestésicos. El sufentanilo es un fármaco muy lipófilo, lo que facilita su rápida distribución por los compartimentos neurológicos y, consecuentemente, un efecto analgésico y anestésico muy rápido; al mismo tiempo, el fármaco es eliminado más lentamente que el resto de sus congéneres, lo que determina un efecto más persistente. En definitiva, una opción a considerar por el anestesista, más en función de su propia experiencia y práctica personal, que por ninguna posible ventaja clínica contrastada.
ANESTESIA/ANALGESIA/SEDACIÓN
Los impulsos nociceptivos, responsables del dolor, son transmitidos a través de diversos tipos de conducciones nerviosas, que acceden al tálamo por vías medulares diferentes. El complejo ventrobasal del tálamo, formado por los núcleos laterales y posteriores, recibe conexiones neuronales procedentes del sistema de conducción rápida; en estos núcleos están representados topográficamente la cara, la cabeza y el cuerpo, lo que implica un elevado grado de especialización y selectividad en la ulterior interpretación de los impulsos dolorosos a nivel de la corteza cerebral.
Las neuronas que siguen el sistema ascendente múltiple de la médula transmiten los impulsos lentos (dolor lento), pasan por la formación reticular y terminan en los núcleos medial e intralaminal del tálamo. A diferencia de los otros núcleos talámicos antes indicados, estos últimos no muestran ninguna organización topográfica; esto quiere decir que no existe, o bien no se conoce, reciprocidad entre áreas determinadas de estos núcleos y una localización orgánica específica. De los núcleos medial e intralaminal irradian fibras aferentes en dirección a la corteza, al sistema límbico (relacionado con las emociones y la memoria) y a los ganglios basales (implicados en el control de los movimientos voluntarios). Por todo esto, el tálamo aparece como el gran “discriminador” de los estímulos dolorosos que ascienden por la médula.
Además de los estímulos nociceptivos aferentes (periféricos), existen vías descendentes de los centros superiores que participan en la transmisión ascendente. Uno de los elementos esenciales de este sistema de “control de apertura” o de “barrera” es el sistema inhibitorio descendente. Gracias a él, el propio cerebro es capaz de modular, parcialmente al menos, la percepción de estímulos dolorosos. En particular, el estrés y el propio dolor parecen activar estas vías inhibitorias descendentes. Este sistema parte de la actividad de neuronas encefalinérgicas, de la sustancia gris presente en torno al acueducto o área gris periacueductal, que excitan a las neuronas serotoninérgicas de un núcleo próximo, el núcleo magno del rafe dorsal, que, a su vez, excitan a otras neuronas – también serotoninérgicas –, las cuales conectan directamente con la sustancia gelatinosa del asta dorsal de la médula espinal, lugar donde actúan sobre neuronas encefalinérgicas, responsables últimas de la acción inhibidora sobre la aferencia de estímulos nociceptivos. Por otro lado, existen fibras inhibitorias descendentes adrenérgicas con origen en el locus coeruleus, que descienden por idéntica vía (Cuéllar, 2012).
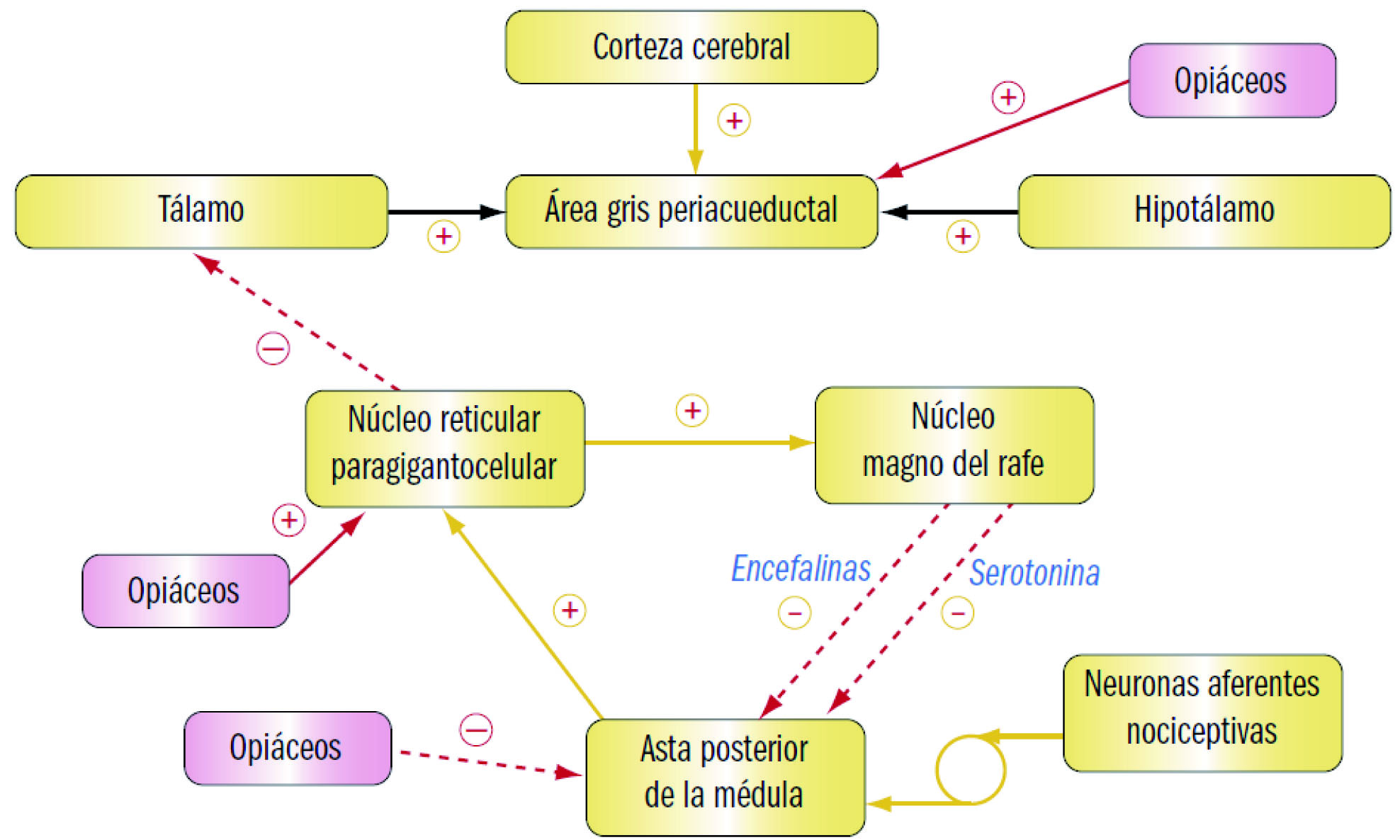
La modulación inhibitoria fisiológica de la información nociceptiva tiene especial interés desde el punto de vista farmacológico, puesto que su activación produce analgesia efectiva. En realidad, los sistemas modulares inhibitorios se encuentran a nivel periférico, segmentario espinal y supraespinal. Estos sistemas se activan en presencia del estímulo nocivo o lesión periférica e implican a diversos neurotransmisores. Los mejor caracterizados son el sistema opiáceo, el noradrenérgico, el serotoninérgico, el gabaérgico y el colinérgico. Todos ellos son independientes, aunque actúan simultánea y sinérgicamente, lo que, desde una perspectiva farmacológica, parece justificar de algún modo la utilización de combinaciones de varios medicamentos en cuadros de dolor muy intenso.
Como se ha indicado, las neuronas encefalinérgicas forman parte del sistema de control de apertura o barrera, que modula la transmisión del dolor. Las encefalinas o endorfinas son péptidos de tamaño variable (desde 5 hasta 31 aminoácidos) que actúan como transmisores inhibitorios, uniéndose a receptores específicos situados en las membranas de dichas neuronas. La estimulación de tales receptores parece capaz de anular la liberación de neurotransmisores excitatorios, bloqueando así la transmisión del impulso doloroso. Estos receptores fueron identificados como diana de los analgésicos opiáceos (morfina, etc.), de ahí que a las encefalinas también se las denomine como opioides internos o endorfinas.
Se han descrito cuatro receptores opioides: el μ (mu), el δ (delta), el κ (kappa) y el “huérfano” u ORL1 (opioid receptor-like, subtipo 1), aunque se han descrito varios subtipos para los tres primeros. El receptor opioide μ (ROM) está presente principalmente en neuronas de la médula espinal, el área gris periacueductal, el tálamo y la corteza cerebral; su activación produce analgesia supraespinal, depresión respiratoria, euforia, sedación, reducción de la motilidad gastrointestinal, miosis y dependencia física. Por su parte, el receptor opioide δ (ROD) se localiza fundamentalmente en el bulbo olfatorio, la corteza cerebral, el núcleo accumbens, la amígdala y el núcleo pontino; su activación provoca analgesia supraespinal y (sobre todo) espinal, inhibición de la motilidad gastrointestinal y depresión respiratoria (aunque este efecto es controvertido). Por otro lado, el receptor opioide κ (ROK) es más común en el sistema límbico, el hipotálamo, el área gris periacueductal y la médula espinal; su activación se relaciona con analgesia espinal, sedación, disnea, dependencia, disforia e inhibición de la liberación de la hormona antidiurética (vasopresina, ADH). Finalmente, el receptor opioide ORL1 o receptor de nociceptina o de orfanina FQ, tiene escasa trascendencia desde el punto de vista de los fármacos opioides convencionales, aunque su activación mediante fármacos experimentales se ha relacionado con la modulación central del dolor y con efectos sobre la locomoción, el estrés, la ansiedad, hábitos alimentarios, aprendizaje, memoria, sistema neurológico de recompensa/adicción, así como actividad urogenital.
Entre las acciones ejercidas por los opioides destaca la analgesia, que se debe a la alteración de la percepción del dolor (bloqueando el impulso doloroso mediado por la sustancia P) a nivel de la médula espinal (sustancia gelatinosa) y de los centros superiores del sistema nervioso central (SNC), como el núcleo trigémino espinal, las zonas grises periacueductal y periventricular, el núcleo medular del rafe y el hipotálamo. Además, los opioides alteran la respuesta emocional del paciente frente al dolor. Por su parte, la anestesia normalmente es producida con dosis superiores a las requeridas para producir analgesia y, en general, precisa del aporte adicional de otras sustancias para mantenerla (benzodiazepinas, habitualmente).
La depresión respiratoria característica de los opioides es debida a un efecto directo sobre los centros respiratorios cerebrales, mediante una reducción de la sensibilidad y de la respuesta frente al incremento de la presión parcial de CO2 (pCO2) en la sangre, deprimiendo los centros nerviosos que regulan el ritmo respiratorio. La falta de respuesta ante el incremento de la pCO2 en la sangre hace que ésta siga aumentando hasta provocar un efecto vasodilatador cerebral, con el consiguiente aumento de la presión del líquido cefalorraquídeo. El efecto antitusivo es también independiente del analgésico, y se produce con dosis iguales, o incluso inferiores, a este último; se debe a una acción depresora directa sobre el centro medular de la tos.
La producción de náuseas está relacionada con una estimulación de la zona gatillo quimiorreceptora de la médula, aunque también puede ser una consecuencia indirecta de la hipotensión ortostática producida por los opioides. Sin embargo, como actúan deprimiendo el centro del vómito, raramente los opioides producen vómitos, muy especialmente después de varias dosis. La miosis – contracción de la pupila del ojo – tiene un origen claramente colinérgico, ya que es antagonizable por atropina. Este mismo efecto parece ser responsable de la reducción de la presión intraocular. Por el contrario, algunos opioides derivados de la petidina pueden producir midriasis (dilatación pupilar), al desarrollar efectos anticolinérgicos.
Los opioides actúan sobre la musculatura lisa de numerosos órganos, como el estómago, el intestino, las vías urinarias o las biliares. Su efecto da lugar a una reducción de la actividad, pero a través de un aumento del tono muscular del músculo liso que llega hasta el espasmo, con el consiguiente bloqueo. Estos espasmos musculares lisos provocan el típico estreñimiento de los opioides, así como espasmos en las vías urinarias y biliares.
Los efectos farmacológicos de los fármacos opioides son consecuencia de su acción sobre los receptores opioides y dependen, básicamente, de 3 factores:
- Afinidad por los receptores (fuerza de la unión fármaco-receptor).
- Actividad intrínseca sobre los receptores (efecto estimulante o agonista).
- Perfil de receptores (combinación específica de receptores sobre los que actúan).
Una elevada afinidad y nula actividad supone, de hecho, un efecto antagonista frente a los ligandos endógenos (opioides) y los fármacos opioides con menor afinidad pero mayor actividad. Existe una situación intermedia, que es la de los agonistas parciales, que presentan elevadas afinidades y actividades intrínsecas moderadas.
ACCIÓN Y MECANISMO
El sufentanilo es un analgésico opioide muy potente (7 a 10 veces más potente que el fentanilo en el hombre y unas 500 veces el de la morfina). Como coadyuvante analgésico para el mantenimiento de una anestesia general equilibrada de media o larga duración en asociación con un hipnótico y/o un agente anestésico volátil y un agente miorrelajante. Asimismo, como anestésico principal para la inducción y mantenimiento de una anestesia analgésica, con 100% de oxígeno, en el curso de intervenciones de cirugía mayor, tal como la cirugía cardiovascular; en la administración epidural, en dosis única o repetida o en perfusión, sólo o en asociación con un anestésico local para anestesia quirúrgica, obstétrica o post-operatoria; en sedación prolongada, en unidades de cuidados intensivos o en reanimación de pacientes ventilados.
Por vía intravenosa, el comienzo de acción es breve, la acumulación limitada y la rápida eliminación de los puntos tisulares de acumulación permite un despertar rápido. Como otros fármacos opioides, el sufentanilo puede, según la dosis y la velocidad de administración provocar rigidez muscular, euforia, miosis o bradicardia. Todos los efectos del sufentanilo son inmediata y completamente revertidos por la utilización de antagonistas opioides, como la naloxona.
La intensidad de la analgesia, sedación y anestesia depende de la dosis; hasta 8 microgramos/kg, el sufentanilo produce una analgesia profunda; a dosis superiores a 8 microgramos/kg, el sufentanilo produce anestesia-analgésica. Asimismo, la administración epidural de 50 microgramos de sufentanilo produce una hipoalgesia segmentaria de unas 3 horas, que se inicia a los 15 minutos tras su administración.
ASPECTOS MOLECULARES
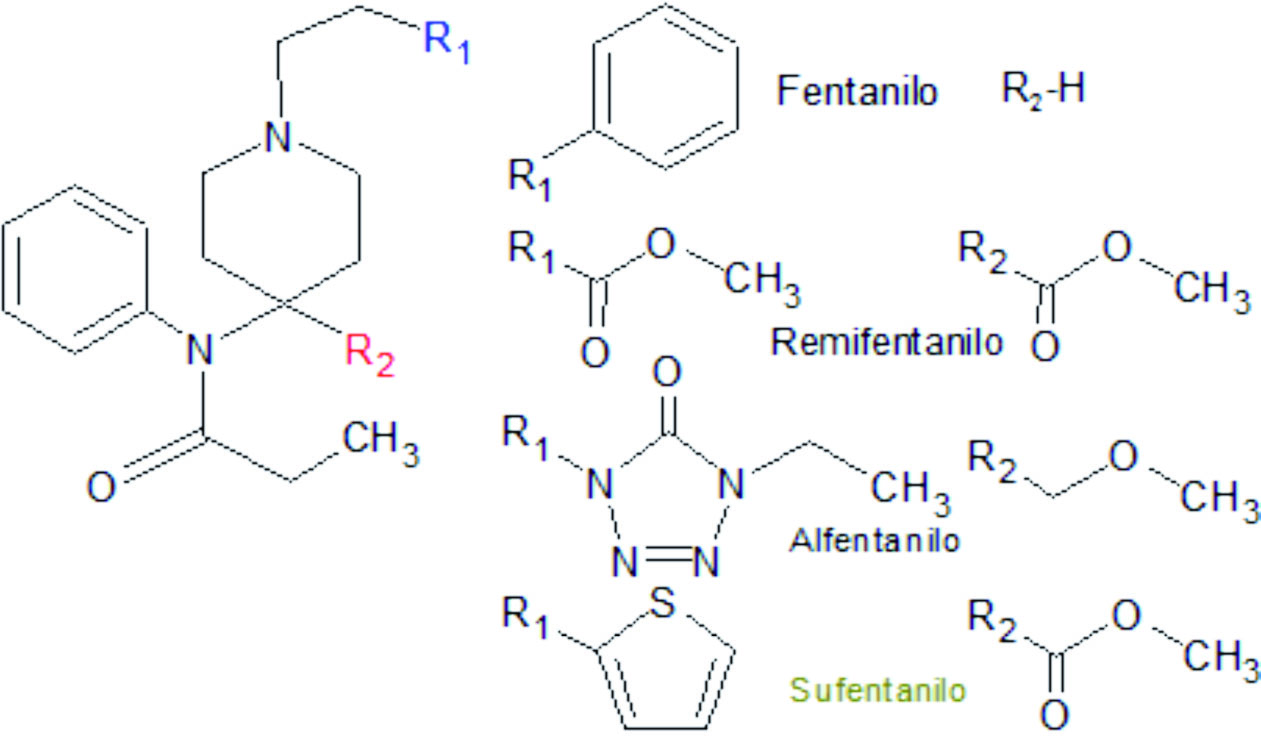
El sufentanilo es un agente opioide del grupo de las anilidopiperidinas, del que forman parte también el fentanilo, el alfentanilo y el remifentanilo. También guarda relación con la petidina, una fenilpiperidina, aunque la incorporación de un grupo amino al anillo bencénico en las anilidopiperidinas potencia el efecto sobre los receptores mu opioides, aun a costa de limitar la duración del efecto. Adicionalmente, esta particularidad estructural determina que el sufentanilo y el resto de los fármacos del grupo carezcan prácticamente de efectos sobre otros tipos de receptores opioides. El sufentanilo presenta una elevada liposolubilidad, lo que se relaciona con un rápido comienzo de acción y con una duración elevada de la ésta.
EFICACIA Y SEGURIDAD CLÍNICAS
El sufentanilo viene utilizándose en clínica desde hace varias décadas y su uso ha sido contrastado frente a otros opioides de su misma familia química. Es ampliamente utilizado durante los procedimientos de anestesia general, particularmente en pacientes graves y cuando se espera que la anestesia requerida sea prolongada (Maciejewski, 2012). La dosificación estándar en el bolo IV de inducción anestésica es de 1 µg/kg, siendo la dosis habitual de mantenimiento de 1 µg/kg/h, generalmente combinado con midazolam y el anestésico en inhalación correspondiente (isoflurano, habitualmente). La dosis de inducción es administrada habitualmente antes de la intubación del paciente. Hay literatura científica (Liao, 2009) que confirma la utilidad del sufentanilo para la estabilización circulatoria de los pacientes, incluyendo a niños (0,2 µg/kg, dos minutos antes de la intubación).
El tiempo transcurrido hasta la extubación traqueal (desde el cierre quirúrgico) ha sido estudiado en comparación con fentanilo, en un estudio retrospectivo de una cohorte de 167 pacientes sometidos a anestesia con propofol para cirugía espinal (Subramanian, 2014). Los resultados del mismo no mostraron diferencias significativas (40,2 min con fentanilo vs. 45,0 m con sufentanilo; p= 0,36).
En dosis normales, el sufentanilo es capaz de inducir una ligera vasodilatación arterial; sin embargo, algunos autores (Ebert, 2005) no consideran que haya un impacto directo negativo relevante sobre la dinámica de la contracción miocárdica; de hecho, se aprecia una reducción del consumo de oxígeno y un leve enlentecimiento del ritmo basal. Esto es importante, porque el mantenimiento de la presión arterial y del ritmo cardiaco es especialmente importante para los pacientes; en este sentido, resulta particularmente relevante para los pacientes con traumatismos graves que requieren una intubación traqueal. Todos los opioides, y el sufentanilo no es una excepción, son susceptibles de atenuar o incluso detener por completo el incremento en ambos parámetros hemodinámicos, si se administran con la pauta adecuada. Un estudio clínico aleatorizado realizado sobre 40 pacientes normotensos anestesiados con propofol comparó los efectos hemodinámicos del sufentanilo y del remifentanilo, observando que el sufentanilo produjo más frecuentemente hipotensión preintubación que el remifentanilo, si bien esta hipotensión desapareció más rápidamente que la asociada a remifentanilo tras la intubación. Aunque ambos agentes pueden prevenir el aumento de la presión arterial y del ritmo cardiaco, los efectos adversos (hipotensión y bradicardia) no deben ser infravalorados (Yeganeh, 2013).
En la anestesia epidural, los opioides incrementan la potencia de los anestésicos locales de tipo amida. En un reciente meta-análisis (Lv, 2014) se ha comparado sistemáticamente la eficacia y la seguridad de la combinación de sufentanilo con bupivacaína, ropivacaína o levobupivacaína durante el parto. Los resultados de este estudio mostraron que la duración de la analgesia fue significativamente más prolongada con ropivacaína que con levobupivacaína (diferencia de 16,12 min; IC95% 2,56 a 29,68; p< 0,03) y con bupivacaína (18,02 min; IC95% 9,09 a 26,96; p< 0,0001). Por otro lado, se alcanzó la analgesia efectiva más rápidamente con bupivacaína que con ropivacaína (diferencia de 2,61 min; IC95% 1,87 a 3,36; p< 0,00001) y con levobupivacaína (4,53 min; IC95% 3,66 a 5,40; p< 0,00001). La incidencia de bloqueo motriz fue más elevada con bupivacaína, aunque la diferencia con los otros dos anestésicos locales no llegó a ser estadísticamente significativa.
Desde el punto de vista toxicológico, el sufentanilo presenta el perfil propio del grupo. Son típicos la depresión respiratoria, con riesgo de apnea, siendo menos frecuente la posibilidad de un laringoespasmo. En casos muy raros se han descrito episodios de depresión respiratoria en el periodo postoperatorio. Son también relativamente comunes la rigidez muscular (en particular, a nivel torácico), la bradicardia y la hipotensión, que pueden ser paliadas en parte ajustando la velocidad de infusión y tienen un carácter transitorio. Son comunes la náusea y los vómitos, y ocasionalmente la sensación de vértigo. La mayor persistencia del sufentanilo con relación a los otros agentes del grupo determina algunas características específicas. En concreto, presenta una menor tendencia a inducir náusea y vómitos que el fentanilo, así como un menor efecto euforizante.
ASPECTOS INNOVADORES
El sufentanilo es un analgésico opioide muy potente perteneciente al grupo de las anilidopiperidinas, junto con fentanilo, alfantenilo y remifentanilo, con lo que guarda una estrecha relación química y farmacológica. Ha sido autorizado como coadyuvante analgésico para el mantenimiento de una anestesia general equilibrada de media o larga duración en asociación con un hipnótico y/o un agente anestésico volátil y un agente miorrelajante. Asimismo, como anestésico principal para la inducción y mantenimiento de una anestesia analgésica, con 100% de oxígeno, en el curso de intervenciones de cirugía mayor, tal como la cirugía cardiovascular; en la administración epidural, en dosis única o repetida o en perfusión, sólo o en asociación con un anestésico local para anestesia quirúrgica, obstétrica o post-operatoria; en sedación prolongada, en unidades de cuidados intensivos o en reanimación de pacientes ventilados.
El sufentanilo no es un nuevo fármaco; de hecho, viene utilizándose en muchos países desde hace varias décadas. Su reciente incorporación al arsenal farmacéutico español obedece a cuestiones administrativas más que a aspecto clínicos. En cualquier caso, las diferencias del sufentanilo con el resto de fármacos de este grupo farmacológico se relacionan fundamentalmente con la rapidez y la duración de sus efectos analgésicos-anestésicos. El sufentanilo es un fármaco muy lipófilo, lo que facilita su rápida distribución por los compartimentos neurológicos y, consecuentemente, un efecto analgésico y anestésico muy rápido; al mismo tiempo, el fármaco es eliminado más lentamente que el resto de sus congéneres, lo que determina un efecto más persistente.
Ambos aspectos tienen una doble lectura. Para unos (Servin, 2008) el remifentanilo es preferible precisamente por la rapidez con que aparecen sus efectos y, también, por la brevedad de su acción, lo que le hace especialmente manejable por los anestesistas, que pueden manipular la duración y la intensidad con más facilidad. Para otros (Maciejewski, 2012), contrariamente a lo que ocurre con el remifentanilo, el uso intraoperatorio de sufentanilo no requiere ser suplementado con otros opioides (como morfina) para mantener una adecuada analgesia postoperatoria. Sea como fuere, no parece que existan pruebas clínicas contrastadas que establezcan la superioridad de un opioide sobre otro en cuadros tales pacientes con graves traumatismos craneales.
En definitiva, una opción a considerar por el anestesista, más en función de su propia experiencia y práctica personal, que por ninguna posible ventaja clínica contrastada.
|
VALORACIÓN |
|
|
SEFENTANILO ► SUFENTANILO G. E. S.® (G. E. S.) |
|
|
Grupo Terapéutico (ATC): N01AH. SISTEMA NERVIOSO. Anestésicos generales: opioides. |
|
|
Indicaciones autorizadas:Como coadyuvante analgésico para el mantenimiento de una anestesia general equilibrada de media o larga duración en asociación con un hipnótico y/o un agente anestésico volátil y un agente miorrelajante. Asimismo, como anestésico principal para la inducción y mantenimiento de una anestesia analgésica, con 100% de oxígeno, en el curso de intervenciones de cirugía mayor, tal como la cirugía cardiovascular; en la administración epidural, en dosis única o repetida o en perfusión, sólo o en asociación con un anestésico local para anestesia quirúrgica, obstétrica o post-operatoria; en sedación prolongada, en unidades de cuidados intensivos o en reanimación de pacientes ventilados. |
|
|
VALORACIÓN GLOBAL: SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
♣ |
| FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA* | |||
| Fármaco | Medicamento® | Laboratorio | Año |
| Fentanilo | Fentanest | Kern | 1965 |
| Alfentanilo | Limifen | Janssen Cilag | 1988 |
| Remifentanilo | Ultiva | GlaxoSmithKline | 1997 |
| Sufentanilo | Sufentanilo GES | GES | 2014** |
BIBLIOGRAFÍA
Bibliografía
- Centro de Información online de Medicamentos de la AEMPS (CIMA). http://www.aemps.gob.es/cima/ (consultado el 2 de diciembre de 2014)
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Fármacos analgésicos. En: Terapéutica farmacológica de los trastornos del sistema nervioso. Programa de Actualización en Farmacología y Farmacoterapia. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2012. pp. 1-80.
- Ebert TJ, Ficke DJ, Arain SR, Holtz MN, Shankar H. Vasodilatation from sufentanil in humans. Anaesth Analg. 2005; 101: 1677-80.
- Liao X, Yang QY, Xue FS, Luo MP, Xu YC, Liu Y, Zhang YM. Bolus dose remifentanil and sufentanil blunting cardiovascular intubation responses in children: a ramdomized, double-blind comparison. Eur J Anaesthesiol. 2009; 26: 73-80.
- Lv BS, Wang W, Wang ZQ, Wang XW, Wang JH, Fang F, Mi WD. Efficacy and safety of local anesthetics bupivacaine, ropivacaine and levobupivacaine in combination with sufentanil in epidural anesthesia for labor and delivery: a meta-analysis. Curr Med Res Opin. 2014; 30(11): 2279-89. doi: 10.1185/03007995.2014.946127.
- Maciejewski D. Sufentanil in anaesthesiology and intensive therapy. Anaesthesiol Intensive Ther. 2012; 44(1): 35-41.
- Niemegeers CJ, Schellekens KH, Van Bever WF, Janssen PA. Sufentanil, a very potent and extremely safe intravenous morphine-like compound in mice, rats and dogs. Arzneimittelforschung. 1976; 26(8): 1551-6.
- Roberts DJ, Hall RI, Kramer AH, Robertson HL, Gallagher CN, Zygun DA. Sedation for critically ill adults with severe traumatic brain injury: a systematic review of randomized controlled trials. Crit Care Med. 2011; 39(12): 2743-51. doi: 10.1097/CCM.0b013e318228236f.
- Subramanian A, Wanta BT, Fogelson JL, Curry TB, Hannon JD. Time to extubation during propofol anesthesia for spine surgery with sufentanil compared with fentanyl: a retrospective cohort study. Spine (Phila Pa 1976). 2014; 39(21): 1758-64. doi: 10.1097/BRS.0000000000000509.
- Yeganeh N, Roshani B, Latifi H, Almasi A. Comparison of target-controlled infusion of sufentanil and remifentanil in blunting hemodynamic response to tracheal intubation. J Inj Violence Res. 2013; 5(2):101-7. doi: 10.5249/jivr.v5i2.325.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




