Sofosbuvir/Velpatasvir ▼ Epclusa® (Gilead) en Hepatitis C
 Nº404
Nº404
Resumen
La asociación de velpatasvir y de sofosbuvir es una combinación de dos antivirales de acción directa, ambos activos sobre los virus de la hepatitis C (VHC); actúan sobre dos pasos consecutivos del proceso final de replicación del ARN viral. El velpatasvir actúa inhibiendo específicamente la proteína NS5A, alterando su localización subcelular, sus procesos de hiperfosforilación e inhibiendo la síntesis de ARN viral, mientras que el sofosbuvir actúa inhibiendo selectivamente la proteína NS5B, una ARN polimerasa dependiente del ARN viral, lo que impide la replicación del material genético viral. Dicha combinación ha sido autorizada para el tratamiento de la hepatitis C en adultos. Los datos clínicos indican unas tasas de respuesta viral sostenida a las 12 semanas (RSV12) por encima del 95% en el conjunto de los pacientes, para todos los genotipos, aunque los pacientes con cirrosis descompensada e infectados por el genotipo 3 del VHC requieren la incorporación de ribavirina para alcanzar tasas óptimas de respuesta (>85%), a costa de incrementar la toxicidad del tratamiento (especialmente, anemia). El perfil toxicológico de sofosbuvir/velpatasvir es benigno, con una incidencia similar a la encontrada en los pacientes tratados con placebo. Hay datos recientes que muestran que la combinación es eficaz y segura en pacientes co-infectados por VIH y VHC. Los eventos adversos más frecuentemente descritos son cefalea, fatiga, náusea e insomnio; el único aspecto relevante en este aspecto es el riesgo de interacciones farmacológicas. Sin duda, un excelente fármaco que supone una leve mejora dentro de un grupo de medicamentos cuyo “listón” de eficacia y seguridad está, ciertamente, muy alto ya.
ASPECTOS FISIOPATOLÓGICOS
Se estima que la infección por el virus de la hepatitis C (VHC) afecta a 170-180 millones de personas en todo el mundo (2%), con una incidencia anual de 4 millones de nuevos casos y alrededor de 500.000 muertes. En España, la prevalencia de la infección por VHC C se sitúa en torno al 1,7% de la población general, lo que supone alrededor de 700.000 personas infectadas, todavía muchas de ellas sin diagnosticar.
Generalmente, la infección aguda por VHC es asintomática y muy raramente se asocia a una enfermedad mortal. Sin embargo, si no se trata, 15% de los pacientes con hepatitis C crónica acabará por desarrollar cirrosis hepática al cabo de 20 años, porcentaje que aumenta por encima del 40% a los 30 años; muchos de ellos acabarán por padecer un cáncer de hígado (hepatocarcinoma), a un ritmo de un 2% anual. Más del 50% de los pacientes que han necesitado un trasplante de hígado en España son pacientes con hepatitis C que han evolucionado a una enfermedad hepática terminal.
El virus de la hepatitis C (VHC) pertenece al género Hepacivirus, de la familia Flaviviridae. Se trata de un virus con cubierta de un diámetro de unos 50 nm, que tiene como material genético una única cadena de ARN en sentido positivo (+ssRNA). Existen 6 genotipos (1-6) y numerosos subgenotipos (a, b, c...) del VHC; en Europa y en Estados Unidos el más frecuente es el 1 (70% de los casos, mayoritariamente el 1b, que en España supone el cerca del 45% de todas las infecciones por VHC, mientras que el 1a representa el 25%), seguido por el 3 (3a; 20%), el 4 (4%) y el 2 (2a, 2b y 2c; 3%).
La expresión del ARN del VHC utiliza la maquinaria genética de los hepatocitos humanos; para ello, induce la síntesis de una única proteína o poliproteína(C-E1-E2-p7-NS2-NS3-NS4A-NS4B-NS5A-NS5B), formada por 3.011 aminoácidos, lo que implica la necesidad de que varias proteasas celulares y virales (NS2 y NS3, junto con su cofactor NS4A, que forman parte de la propia poliproteína) actúen para liberar las formas activas de las 3 proteínas estructurales (E) y de las 7 no estructurales (NS) que la constituyen (Figura 1).
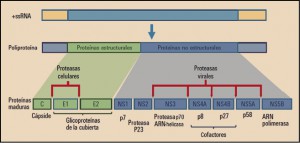
Figura 1. Expresión del ARN del virus de la hepatitis C (VHC) y resultado del procesamiento de la poliproteína.
El procesamiento de la poliproteína se inicia por la señal peptidasa del retículo endoplásmico; liberando la proteína C que forma la cápside viral, las E1 y E2 de la envoltura de la partícula y la p7, forma los canales iónicos en la envoltura viral, necesarios para la liberación del genoma. Por su parte, la región de las proteínas no estructurales (NS2 a NS5B), es procesada por NS2 y NS3 que producen un corte autocatalítico de las regiones NS2-NS3 y NS3-NS4A, respectivamente. Esta última es un complejo enzimático que inicia el procesamiento del resto de la poliproteína viral; está constituido por la NS3, una enzima multifuncional con actividades de serina-proteasa y de ARN helicasa DexH/D (revierte el enrollamiento de cadenas de ARN formadas durante la replicación viral); por su parte, la NS4A es responsable de reorganizar la estructura y optimizar la actividad de NS3 y facilitar la localización del complejo NS3/4A sobre la membrana del retículo endoplásmico, donde es procesada la poliproteína viral.
La NS5A es una proteína intensamente fosforilada y forma parte del complejo de replicación; se une a la fracción 3’-terminal del ARN viral recién sintetizado e interacciona con la ARN polimerasa dependiente del ARN viral. Esta última es la proteína NS5B, obviamente esencial en la replicación del ARN viral, que utiliza la cadena de éste como molde para nuevas cadenas y cataliza el proceso de polimerización de los ribonucleótido-trifosfato (rNTP) durante este proceso de replicación viral. En definitiva, produce la hebra de ARN complementaria – ARN(–) – que servirá de molde para fabricar las auténticas hebras de ARN viral – ARN(+) –, que a su vez podrán ser de nuevo replicadas y traducidas, o bien empaquetadas en las proteínas estructurales para formar nuevas partículas virales de VHC, que son liberadas mediante un proceso de exocitosis (Cuéllar, 2016).
El VHC posee un elevada variabilidad genética (1.400-1.900 sustituciones/nucleótido/año), que es debida principalmente a la sustitución nucleotídica que ocurre durante el proceso replicativo y por la falta de actividad de exonucleasa de la polimerasa viral, que impide la corrección de errores en la secuencia replicada. Sin embargo, esta variabilidad no es uniforme, ya que existen regiones altamente conservadas, como la secuencia que codifica para la proteína de la cápside viral (C), la región para la serina proteasa NS3 y los extremos 5’ y 3’ no traducibles de la cadena de ARN; otras regiones, como las que codifican las proteínas NS4B, NS5A y las regiones hipervariables 1 y 2 (RHV-1 y RHV-2) en la proteína de envoltura E2, pueden diferir hasta en más del 50%, dando lugar a las múltiples variantes genotípicas del VHC mencionadas anteriormente.
El tratamiento farmacológico de la hepatitis C crónica ha ido evolucionando de forma muy rápida en los últimos años. Hasta hace algunos años, se basaba en la administración de interferón alfa (generalmente, como peginterferón alfa) subcutáneo y ribavirina oral durante 24-72 semanas. Este tratamiento se asocia con una respuesta viral sostenida no demasiado satisfactoria (30-50%) y un perfil notable de efectos adversos.
En el año 2011 se produjo un cambio notable en el panorama terapéutico de la hepatitis C, al comercializarse el boceprevir y el telaprevir – la primera generación de inhibidores selectivos y reversibles de la proteasa NS3 – para el tratamiento de pacientes infectados por VHC de tipo 1, tanto no tratados previamente (naïve) como tratados, en combinación con peginterferón alfa y ribavirina (terapia triple). En estas circunstancias, las tasas de respuesta tanto en pacientes naïve como en pretratados llegaban a alcanzar hasta un 70% en algunas subpoblaciones de pacientes, permitiendo acortar la duración del tratamiento en algunos casos de 48 a 24 semanas. Sin embargo, boceprevir y telaprevir presentan un perfil toxicológico importante que obliga a suspender el tratamiento en un porcentaje de pacientes netamente superior a los tratados solo con peginterferón alfa y ribavirina, amén de un amplio abanico de interacciones farmacológicas, lo cual, asociado con la propia complejidad del tratamiento, dejaba un amplio margen para la mejora.
Tras esta primera generación de inhibidores de la proteasa del VHC, en 2014 llegó otra oleada de nuevos agentes con propiedades farmacodinámicas, farmacocinéticas y toxicológicas más satisfactorias que los anteriores, formada por el simeprevir, inhibidor dual de NS3 y NS4A, el daclatasvir, inhibidor de la NS5A, y el sofosbuvir, inhibidor de la NS5B, todos ellos con tasas de respuesta viral sostenida por encima del 80% para la mayoría de los genotipos y condiciones clínicas.
La forma de uso de todos ellos consiste en combinar dos o más para optimizar los resultados y, especialmente, reducir la duración de los tratamientos, excluir o reducir el uso de la terapia triple (peginterferón y ribavirina, más boceprevir o telaprevir), y reducir el riesgo de emergencia de cepas virales resistentes. Por este motivo, muchos de los nuevos medicamentos que están llegando actualmente consisten en combinaciones a dosis fijas de inhibidores de NS3/NS4A, NS5A y NS5B, con el objetivo adicional de optimizar la adherencia al tratamiento. Entre ellas, cabe citar las de:
- NS5A/NS3/4A: Ombitasvir/Paritaprevir (+ritonavir1) y Elbasvir/Grazoprevir
- NS5A/NS5B: Ledipasvir/Sofosbuvir y Velpatasvir/Sofosbuvir.
El criterio fundamental en la estrategia terapéutica es considerar el nivel de fibrosis hepática que presenta el paciente en el momento del diagnóstico, que determina la potencial utilidad de los tratamientos disponibles. Se suele cuantificar el nivel de fibrosis hepática mediante Fibroscan, considerándose como leve para niveles 0 y 1 (F0 y F1), moderada (F2), avanzada (F3) y grave (F4), típicamente cirrosis, que puede estar compensada o descompensada. La estrategia terapéutica definida actualmente en el Plan Estratégico para el abordaje de la hepatitis C en el Sistema Nacional de Salud propone tratar con los nuevos antivirales a pacientes tanto monoinfectados como coinfectados con el VIH:
- Pacientes con fibrosis hepática significativa (F2 a F4) con independencia de la existencia o no de complicaciones previas a la hepatopatía.
- Pacientes en lista de espera de trasplante hepático o trasplantados (hepáticos que hayan vuelto a infectarse y no hepáticos con hepatitis C).
- Pacientes que no hayan respondido a la triple terapia con inhibidores de la proteasa de primera generación.
- Pacientes con hepatitis C con manifestaciones extrahepáticas clínicamente relevantes del virus de la hepatitis C, sea cual sea el grado de fibrosis.
- En cualquier caso, y también con independencia del grado de fibrosis, se debe indicar el tratamiento en pacientes con elevado riesgo de trasmisión y mujeres en edad fértil que deseen un embarazo.
Según el genotipo, se han propuesto diferentes combinaciones de tratamientos considerando separadamente la condición de pacientes previamente no tratados (naïve) o con recaída tras un éxito inicial con terapia triple, con la de pacientes con fracaso previo a terapia triple. Entre las diversas opciones terapéuticas propuestas en la Estrategia ninguna tiene un carácter preferencial dado que no hay datos comparativos directos entre ellas.
ACCIÓN Y MECANISMO
La asociación de velpatasvir y de sofosbuvir es una combinación de dos antivirales de acción directa, ambos activos sobre los virus de la hepatitis C (VHC); actúan sobre dos pasos consecutivos del proceso final de replicación del ARN viral. Dicha combinación ha sido autorizada para el tratamiento de la hepatitis C en adultos.
El velpatasvir actúa inhibiendo específicamente la proteína NS5A, alterando su localización subcelular, sus procesos de hiperfosforilación e inhibiendo la síntesis de ARN viral. La proteína NS5A es una proteína intensamente fosforilada que, una vez escindida de la poliproteína viral, localiza a las membranas donde se une a la fracción 3’-terminal del ARN viral recién sintetizado y participa en la replicación del genoma viral, en parte a través de interacciones con la ARN polimerasa dependiente del ARN viral (NS5B). Ha mostrado una elevada actividad frente a las formas estables de los genotipos de VHC 1a, 2a, 2b, 3a, 4a, 5a y 6a, con valores de EC502 que van desde 0,014 a 0,11 µM. Los valores medios de EC50 encontrados para el velpatasvir frente a replicones quiméricos que codifican sequencias de NS5A procedentes de aislados clínicos son de 0,029 µM para el genotipo 1; 0,027 para el 2; 14,8 para el 3; 0,005 para el 4; 0,007 para el 5 y 0,11 para el 6.
Por su parte, el sofosbuvir actúa inhibiendo selectivamente la proteína NS5B, una ARN polimerasa dependiente del ARN viral, lo que impide la replicación del material genético viral. Dicha NS5B es responsable de producir la hebra de ARN complementaria – ARN(-) – que servirá de molde para fabricar las auténticas hebras de ARN viral – ARN(+) –, que a su vez podrán ser de nuevo replicados y traducidas, o bien empaquetados en las proteínas estructurales para formar nuevas partículas virales de VHC, que son liberadas mediante un proceso de exocitosis.
La combinación de sofosbuvir/velpatasvir ha mostrado in vitro que es aditiva. El replicón del mutante NS5B S282T, que confiere un bajo nivel de sensibilidad al sofosbuvir fue susceptible, sin embargo al velpatasvir (EC50 0,004 µM). De igual manera, los mutantes con baja sensibilidad al velpatasvir fueron completamente inhibidor por el sofosbuvir. Incluso los mutantes dobles (NS5A y NS5B) mostraron una baja capacidad de replicación con la combinación sofosbuvir/velpatasvir.
ASPECTOS MOLECULARES
El velpatasvir está estructural y farmacológicamente relacionado con daclatasvir, ledipasvir y, en particular, con el elbasvir, en tanto que todos ellos son inhibidores de la proteína NS5A del VHC. Presentan una característica estructura simétrica (daclatasvir y ledipasvir) o cuasi-simétrica (elbasvir y velpatasvir), en la que destacan dos aspectos fundamentales. En primer lugar, el núcleo central de la molécula que constituye un amplio sistema resonante, de alta densidad electrónica, el cual facilita la unión a la proteína NS5A, estabilizando su estructura y bloqueando sus funciones. En segundo lugar, se aprecian sendas estructuras en los extremos de las moléculas que emulan secuencias peptídicas (son carbamatos, en realidad), que facilitan la inserción del fármaco en los huecos (bolsillos) de la proteína.
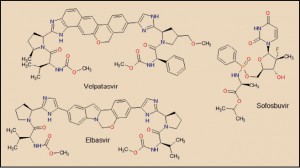
Por su parte, el sofosbuvir es un análogo estructural del uridilato (monofosfato de uridina, UMP), una de las cuatro bases nucleicas que constituyen el ARN; además, incluye un resto de L-alanina. Tras un proceso de fosforilación intracelular, el sofosbuvir es transformado en un derivado trifosfatado, que es la forma biológicamente activa del fármaco, actuando como un falso trifosfato de uridina (UTP) que es capaz de bloquear a la ARN polimerasa dependiente del ARN viral, provocando la finalización prematura del proceso de replicación y, con ello, deteniendo la reproducción del VHC.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de la combinación sofosbuvir/velpatasvir han sido adecuadamente contrastadas en las indicaciones autorizadas mediante cuatro ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad. La dosis del medicamento empleada en todos los casos fue de 400 mg de sofosbuvir y 100 mg de velpatasvir, administrados por vía oral, una vez al día; la duración del tratamiento fue en todos los estudios de 12 semanas, con excepción del dos de ellos (ASTRAL-3 y ASTRAL-4), en el que uno de los brazos de estudio mantuvo el tratamiento con la combinación durante 24 semanas. Adicionalmente, se ha llevado a cabo otro estudio (ASTRAL-5) en pacientes co-infectados por VIH y VHC.
La variable clínica más utilizada en los ensayos clínicos fue la respuesta viral sostenida durante 12 semanas (RVS12), definida como la persistencia de una concentración plasmática de ARN viral (VHC) inferior a 25 UI/ml durante las 12 semanas posteriores a la finalización del tratamiento; en algunos ensayos también se empleó como variable clínica la RVS a 4 (RVS4) y 24 semanas (RVS24), generalmente como variable secundaria. Igualmente, se consideró como rebote el incremento por un factor de 10 o más (1 log10) de la concentración plasmática de ARN VHC, medido en dos determinaciones en dos semanas.
|
Tabla 1. Ensayos clínicos de fase 3 con sofosbuvir/velpatasvir en hepatitis C |
||||||
|
Estudio (referencia) |
Genotipo viral (GT) |
Tratamiento y |
Tipo de estudio |
Nº paci |
Características de los pacientes |
Tasa de respuesta (RSV12) |
|
ASTRAL-1 (Feld, 2015) |
1, 2, 4, 5, 6 |
Sofosbuvir/Velpatasvir 12 semanas vs. Placebo |
Aleatorizado, doble ciego, controlado con placebo o sofosbuvir/ribavirina |
624 |
≤20% pacientes con cirrosis (compensada) |
99% 0% |
|
ASTRAL-2 (Foster, 2015) |
2 |
Sofosbuvir/Velpatasvir 12 semanas vs. Sofosbuvir/Ribavirina, 12 semanas |
266 |
99% 94% |
||
|
ASTRAL-3 (Foster, 2015) |
3 |
Sofosbuvir/Velpatasvir 12 semanas vs. Sofosbuvir/Ribavirina 24 semanas |
552 |
95% 80% |
||
|
ASTRAL-4 (Curry, 2015) |
1, 2, 4, 6 |
Sofosbuvir/Velpatasvir 12 semanas vs. Sofosbuvir/Veltapasvir/Ribavirina 12 semanas vs. Sofosbuvir/Velpatasvir 24 semanas |
Aleatorizado, abierto |
267 |
100% pacientes con cirrosis (descompensada) |
83% 94% 86% |
|
ASTRAL-5 (Youssoni, 2017) |
1 (74%) |
Sofosbuvir/Velpatasvir 12 semanas |
Abierto |
106 |
Co-infectados por VIH (terapia antirretroviral estable) y VHC (18% con cirrosis) |
95% |
|
Tabla 2. Resultados agregados por genotipo y presencia de cirrosis (compensada o no) (EMA, 2016) |
||||||||
|
Tasa de respuesta |
Tratamiento |
Genotipo 1 |
Genotipo 2 |
Genotipo 3 |
Genotipo 4 |
Genotipo 5 |
Genotipo 6 |
RESPUESTA GLOBAL |
|
Global |
Sofosbuvir + Velpatasvir 12 semanas |
98,5% |
99,6% |
95,3% |
100% |
97,1% |
100% |
98,1% |
|
Sin cirrosis |
98,4% |
99,5% |
97,0% |
100% |
96,6% |
100% |
98,5% |
|
|
Cirrosis compensada |
98,6% |
100% |
91,3% |
100% |
100% |
100% |
96,4% |
|
|
Cirrosis no compensada |
Sofosbuvir + Velpatasvir 12 semanas |
88,2% |
100% |
50,0% |
100% |
– |
– |
83,3% |
|
Sofosbuvir + Velpatasvir + Ribaviina, 12 semanas |
95,6% |
100% |
84,6% |
100% |
– |
– |
94,3% |
|
|
Sofosbuvir + Velpatasvir, 24 semanas |
91,5% |
75,0% |
50,0% |
100% |
– |
100% |
85,6% |
|
Desde el punto de vista de la seguridad, la combinación sofosbuvir/velpatasvir presenta un perfil toxicológico benigno, equiparable al del placebo. La incidencia global de eventos adversos posiblemente relacionados con el tratamiento fue del 50% con S/V y del 45% con placebo, siendo los más comunes cefalea (21%, tanto con S/V como placebo), fatiga (16%, igual), nausea (10%, igual) e insomnio (5,4 vs. 6,0%). La incidencia de eventos adversos valoados como graves fue del 3,2%, suspendiéndose el tratamiento por este motivo en el 0,2% de los pacientes incluidos en los ensayos clínicos pivotales.
ASPECTOS INNOVADORES
La asociación de velpatasvir y de sofosbuvir es una combinación de dos antivirales de acción directa, ambos activos sobre los virus de la hepatitis C (VHC); actúan sobre dos pasos consecutivos del proceso final de replicación del ARN viral. El velpatasvir actúa inhibiendo específicamente la proteína NS5A, alterando su localización subcelular, sus procesos de hiperfosforilación e inhibiendo la síntesis de ARN viral, mientras que el sofosbuvir actúa inhibiendo selectivamente la proteína NS5B, una ARN polimerasa dependiente del ARN viral, lo que impide la replicación del material genético viral. Dicha combinación ha sido autorizada para el tratamiento de la hepatitis C en adultos.
Los datos clínicos indican unas tasas de respuesta viral sostenida a las 12 semanas (RSV12) por encima del 95% en el conjunto de los pacientes, para todos los genotipos; estas tasas estuvieron por encima del 95% en los pacientes sin cirrosis o con cirrosis compensada infectados por el genotipo 1, 99% para el 2, 100% para el 4, 96% para el 5 y 98% para el 6; en los infectados por el genotipo 3, las tasas fueron del 91% en no cirróticos y cirróticos compensados, y del 50% en cirróticos no compensados (aunque aumentaron al 85% con la adición de ribavirina). En pacientes con cirrosis no compensada, las tasas globales de respuesta fueron del 83% con el tratamiento de 12 semanas y del 86% con 24 semanas; la adición de ribavirina al tratamiento de 12 semanas elevó la RSV12 global hasta un 94% en estos pacientes. Es decir, los pacientes con cirrosis descompensada e infectados por el genotipo 3 del VHC requieren la incorporación de ribavirina para alcanzar tasas óptimas de respuesta (>85%), aunque a costa de incrementar la toxicidad del tratamiento (especialmente, anemia) lo que, a su vez, puede obligar a ajustar la dosis de ribavirina (de hecho, más de un tercio de los pacientes lo requiere).
El perfil toxicológico de sofosbuvir/velpatasvir es benigno, con una incidencia similar a la encontrada en los pacientes tratados con placebo. Los eventos adversos más frecuentemente descritos son cefalea, fatiga, náusea e insomnio, similar a lo observado con otros agentes antivirales o incluso combinaciones de estos a dosis fijas, como la elbasvir/grazoprevir. El único aspecto relevante en este aspecto es el riesgo de interacciones farmacológicas, debido a que los medicamentosque actúan como inductores de la gnP o del citocromo P450 (CYP) pueden reducir significativamente los niveles de sofosbuvir y/o velpatasvir; asimismo, esta combinación podría incrementar la exposición a ciertos fármacos antirretrovirales, como el tenofovir.
Hay datos recientes que muestran que la combinación es eficaz y segura en pacientes co-infectados por VIH y VHC; asimismo, el uso de sofosbuvir/velpatasvir en pacientes con insuficiencia renal no requiere ningún ajuste posológico.
Sin duda alguna, esta combinación muestra un perfil terapéutico ciertamente bueno; bien es cierto que, aunque no se dispone de comparaciones directas, hay otras combinaciones – como la de elbasvir/grazoprevir – con características similares, tanto en eficacia como en seguridad. A pesar del sustancial avance conseguido con este tipo de combinaciones y siendo la de sofosbuvir/velpatasvir quizá la que más amplia cobertura genotipal tiene, aún quedan algunos aspectos que no están satisfactoriamente resueltos. En concreto, sofosbuvir/velpatasvir requiere la incorporación de ribavirina en pacientes con cirrosis hepática descompensada, lo que añade un plus de toxicidad (especialmente anemia) a un tratamiento, por otro lado, muy bien tolerado por la gran mayoría de los pacientes. Asimismo, no se dispone de datos clínicos que avalen su uso en pacientes que hayan tenido una respuesta inadecuada con otros inhibidores de la NS5A ni en pacientes sometidos a trasplante hepático.
Sin duda, un excelente fármaco que supone una leve mejora dentro de un grupo de medicamentos cuyo “listón” de eficacia y seguridad está, ciertamente, muy alto ya.
|
VALORACIÓN |
|
SOFOSBUVIR/VELPATASVIR
|
|
Grupo Terapéutico (ATC): J05AX. TERAPIA ANTIINFECCIOSA SISTÉMICA. Antivirales de acción directa: otros. |
|
Indicaciones autorizadas: Tratamiento de la hepatitis C crónica en adultos. |
|
INNOVACIÓN moderada. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Boceprevir |
Victrelis |
Merck Sharp Dohme |
2011 |
|
Telaprevir |
Incivo |
Janssen Cilag |
2011 |
|
Simeprevir |
Olysio |
Janssen Cilag |
2014 |
|
Sofosbuvir |
Sovaldi |
Gilead |
2014 |
|
Daclatasvir |
Daklinza |
Bristol-Myers Squibb |
2015 |
|
Ledipasvir/Sofosbuvir |
Harvoni |
Gilead |
2015 |
|
Ombitasvir/Paritaprevir/Ritonavir |
Viekirax |
Abbvie |
2015 |
|
Dasabuvir |
Exviera |
Abbvie |
2015 |
|
Elbasvir/Grazoprevir |
Zepatier |
Merck Sharp Dohme |
2017 |
|
Sofosbuvir/Velpatasvir |
Epclusa |
Gilead |
2017 |
BIBLIOGRAFÍA
Bibliografía
- Chahine EB, Sucher AJ, Hemstreet BA. Sofosbuvir/Velpatasvir: The First Pangenotypic Direct-Acting Antiviral Combination for Hepatitis C. Ann Pharmacother. 2016 Sep 8. pii: 1060028016668897.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Elbasvir/Grazoprevir (Zepatier®) en hepatitis C. Panorama Actual Med 2017; 41(400): 59-64.
- Curry MP, O’Leary JG, Bzowej N, Muir AJ, Korenblat KM, Fenkel JM, et al; ASTRAL-4 Investigators. Sofosbuvir and Velpatasvir for HCV in Patients with Decompensated Cirrhosis. N Engl J Med. 2015; 373(27): 2618-28. doi: 10.1056/NEJMoa1512614.
- European Medicines Agency (EMA). Epclusa®. European Public Assessment Report (EPAR). EMA/337142/2016; EMEA/H/C/004210. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/004210/WC500211152.pdf
- Feld JJ, Jacobson IM, Hézode C, Asselah T, Ruane PJ, Gruener N, et al; ASTRAL-1 Investigators. Sofosbuvir and Velpatasvir for HCV Genotype 1, 2, 4, 5, and 6 Infection. N Engl J Med. 2015; 373(27): 2599-607. doi: 10.1056/NEJMoa1512610.
- Foster GR, Afdhal N, Roberts SK, Bräu N, Gane EJ, Pianko S, et al; ASTRAL-2 Investigators; ASTRAL-3 Investigators. Sofosbuvir and Velpatasvir for HCV Genotype 2 and 3 Infection. N Engl J Med. 2015; 373(27): 2608-17. doi: 10.1056/NEJMoa1512612.
- Kohli A, Alshati A, Georgie F, Manch R, Gish RG. Direct-acting antivirals for the treatment of chronic hepatitis C in patients with chronic kidney disease. Therap Adv Gastroenterol. 2016; 9(6): 887-97.
- Ministerio de Sanidad, Servicios Sociales e Igualdad. Plan estratégico para el abordaje de la hepatitis C en el Sistema Nacional de Salud. https://www.msssi.gob.es/ciudadanos/enfLesiones/enfTransmisibles/hepatitisC/PlanEstrategicoHEPATITISC/docs/plan_estrategico_hepatitis_C.pdf
- Younossi ZM, Stepanova M, Sulkowski M, Wyles D, Kottilil S, Hunt S. Patient-reported outcomes in patients co-infected with hepatitis C virus and human immunodeficiency virus treated with sofosbuvir and velpatasvir: The ASTRAL-5 study. Liver Int. 2017 May 4. doi: 10.1111/liv.13462. [Epub ahead of print]
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





