Simeprevir OLYSIO® (Janssen Cilag)
 Nº376
Nº376
HEPATITIS C
La hepatitis es un cuadro inflamatorio del hígado cuyo origen puede ser infeccioso (tanto viral como bacteriano), inmunológico (hepatitis autoinmune) o tóxico (alcohol, tóxicos – incluyendo algunos procedentes de hongos, como los de la Amanita phaloides – o fármacos). Los virus susceptibles de provocar hepatitis se pueden agrupar en 7 tipos: A, B, C, D, E, F y G, aunque desde un punto de vista patológico los más relevantes son A, B y C, particularmente los dos últimos (B y C).
Las infecciones crónicas por los virus de la hepatitis B (VHB) y C (VHC) constituyen un grave problema de salud pública a escala mundial. La prevalencia de infecciones por VHB es, según la OMS (julio de 2013), de 2.000 millones de personas, de las cuales más de 240 millones presentan una hepatitis crónica. Por lo que respecta a la prevalencia global del VHC, aunque inferior a la del VHB, se estima entre 150 y 180 millones (2-3 % de la población general), con una incidencia anual de 3-4 millones de nuevos casos.
En España, la prevalencia general de la hepatitis C se sitúa en torno al 1,2-1,7% de la población general, lo que supone un número de personas infectadas de entre 500.000 y 1.000.000; más del 50% de los pacientes que han necesitado un trasplante de hígado son pacientes con hepatitis C que han evolucionado a una enfermedad hepática terminal.
El virus de la hepatitis C (VHC) causa infección aguda y crónica. Por lo general, la infección aguda es asintomática y muy raramente se asocia a una enfermedad potencialmente mortal. Aproximadamente un 20-40% de las personas infectadas eliminan el virus espontáneamente en un plazo de tres a seis meses, incluso sin necesidad de tratamiento alguno (no parece haber casos de curación espontánea más allá del periodo inicial de un año); pero el restante 60-80% desarrollan la infección crónica. De estas últimas, un 80% permanece estable, mientras que un 20% evoluciona a cirrosis hepática al cabo de 20-25 años, de los cuales un 80% acabará por padecer un cáncer de hígado (hepatocarcinoma). Las formas más graves y progresivas de hepatitis C aguda acontecen en pacientes coinfectados por el virus de la hepatitis B (VHB) o el de la inmunodeficiente humana (VIH)1, así como en pacientes trasplantados. Según la OMS, entre 300.000 y 500.000 personas mueren anualmente en todo el mundo por enfermedades hepáticas relacionadas con la hepatitis C.
La infección se transmite principalmente mediante el contacto con la sangre de una persona infectada (transfusiones no controladas de sangre y hemoderivados; uso compartido de agujas; realización de tatuajes, piercing, acupuntura, etc., siempre que el material no esté debidamente esterilizado). Se considera que es el agente causal de más del 90 % de las hepatitis postransfusionales. La transmisión por vía sexual y materno-fetal es rara, aunque posible; en concreto, la transmisión por vía sexual representa menos del 2% de los casos y se da especialmente cuando existe sangrado o erosión de las mucosas durante la relación sexual. La escasa eficacia de las vías de transmisión sexual y maternofilial sugieren que el virus de la hepatitis C (VHC) no tiene una gran capacidad infectante, a diferencia de lo que ocurre con la el VHA y, especialmente, con el VHB y el VIH.
Los síntomas físicos como ictericia son raros, y el cansancio asociado a las hepatitis puede pasar inadvertido. La fase crónica puede alargarse 20 y 30 años sin más síntomas que algunas alteraciones de los marcadores hepáticos, especialmente los enzimas funcionales (transaminasas, especialmente). En los cuadros que evolucionan negativamente, se desarrolla una fase de fibrosis hepática que puede llegar a desembocar en cirrosis en unos años y posteriormente en cáncer de hígado. El pronóstico es mejor cuanto más tempranamente se haya contraído la enfermedad, y esto independientemente de la viremia, que tampoco parece afectar a la evolución de la enfermedad y, quizá, sólo modifique lo potencialmente contagioso que es cada paciente.
El VHC, anteriormente denominado virus de la hepatitis no-A no-B, fue identificado en 1988 y se clasifica dentro de la familia Flaviviridae por ser un virus envuelto, de aproximadamente 50 nm de diámetro, con una sola cadena de ARN en sentido positivo (5'-3') y en el género Hepacivirus que se creó para distinguir las características poco comunes de este virus, como lo es la enzima multifuncional NS3.
En Europa y EEUU, el más frecuente es el 1 (70% de los casos), seguido por el 2 y 3 (25%). El 2 (varios subtipos) y 4 (b, c, e y m) en África del Norte y Central, y el 6p y 2i en Asia. En concreto, en Norte América predomina el genotipo 1a, seguido de 1b, 2a, 2b y 3a. En Europa predomina el genotipo 1b seguido de 2a, 2b, 2c y 3a.
El VHC se replica principalmente en los hepatocitos, aunque se ha sugerido la posibilidad de que también pueda hacerlo en linfocitos y monocitos. Las partículas virales circulantes se unen a receptores específicos presentes en la superficie de los hepatocitos, que habilitan la penetración del virus en el interior de la célula. Se ha sugerido que estos receptores podrían ser el CD81 y el SR-BI. Sin embargo, dado que estos receptores están presentes en otros muchos tipos de células humanas, parece razonable que deban existir otros cofactores o co-receptores que resulten indispensables para justificar el tropismo específico del VHC hacia los hepatocitos.
Una vez en el interior del hepatocito, el VHC utiliza la maquinaria celular para replicarse. La expresión del ARN viral conduce a la síntesis de una única proteína (poliproteína) de gran tamaño (3.011 aminoácidos), que requiere de la acción de varias proteasas para dar lugar a las formas activas de las proteínas virales, que incluyen a tres proteínas estructurales (E) y a siete no estructurales (NS). Esta poliproteína (C(F)-E1-E2-p7-NS2-NS3-NS4A-NS4B-NS5ANS5B) genera al menos diez proteínas maduras al ser procesada por la señal peptidasa del retículo endoplásmico, la cual libera las proteínas C, E1, E2 y p7 que forman la cápside o núcleo viral (C), la envoltura de la partícula (E1 y E2) y p7 que se parece intervenir en la liberación del genoma al formar canales iónicos en la envoltura viral; la región de las proteínas no estructurales (NS2-NS5B) que participan en la replicación son procesadas por dos enzimas virales: NS2 y NS3 que generan un corte autocatalítico en las regiones NS2-NS3 y NS3-NS4A respectivamente y permiten la formación del complejo proteasa de serina NS3/4A que procesa el resto de la poliproteína viral, provocando la maduración de las proteínas NS4B, NS5A y NS5B con función de polimerasa de ARN dependiente de ARN (NS5B) y de fosfoproteína (NS5A); por el momento, la función de la proteína NS4B no está plenamente comprendida, como ocurre con la existencia de un segundo marco de lectura (ORF +1) que provoca la síntesis de la proteína F y una variante de la proteína C.
Las proteínas NS toman el ARN viral formando un complejo de replicación – sistema replicón – que es asociado a membranas ciplasmáticas modificadas. Concretamente, la proteínas NS5B es una ARN polimerasa ARN dependiente que es responsable de producir la hebra de ARN complementaria – ARN(-) – que servirá de molde para fabricar las auténticas hebras de ARN viral – ARN(+) –, que a su vez podrán ser de nuevo replicados y traducidas, o bien empaquetados en las proteínas estructurales para formar nuevas partículas virales de VHC, que son liberadas mediante un proceso de exocitosis. La capacidad de replicación del VHC es enorme, calculándose en un billón (1012) el número de nuevos virus que son capaces de ser producidos durante un día en una persona infectada.
La proteína NS3 del VHC es una enzima multifuncional ya que presenta en el primer tercio de su estructura, una actividad de proteasa de serina y en el resto función de ARN helicasa DexH/D que revierte el enrollamiento de cadenas dobles de ARN formadas durante la replicación viral. El extremo NS4A es una proteína anfipática de 54 aminoácidos que se asocia no covalentemente con las cadenas A0 y A1 de NS3 y provoca una reorganización en su estructura, optimizando así la actividad de proteasa de NS3; además NS4A promueve la localización del complejo NS3/4A a la membrana del retículo endoplásmico donde es procesada la poliproteína viral.
El hecho de que se trate de un virus ARN implica que el material genético es más inestable que el de los virus con ADN, por lo que la tasa de mutaciones es, también, mucho mayor. Obviamente, eso se traduce en una mayor facilidad para desarrollar resistencias a fármacos antivirales. Particularmente, el VHC posee un alta variabilidad genética (1400-1900 sustituciones/nucleótido/año), debida principalmente a la sustitución nucleotídica que ocurre durante el proceso replicativo y por la falta de actividad de exonucleasa de la polimerasa viral, que impide la corrección de errores en la secuencia replicada. Sin embargo, esta variabilidad no es uniforme, ya que existen regiones altamente conservadas como la secuencia que codifica para la proteína de la cápside viral (C), la región para la proteasa de serina NS3 y los extremos 5' y 3' no traducibles de la cadena de ARN, mientras que otras regiones como las que codifican las proteínas NS4B, NS5A y las regiones hipervariables 1 y 2 (RHV 1 y RHV 2) en la proteína de envoltura E2 difieren hasta en más de 50%. Estas diferencias en el genotipo del VHC dan origen a las variantes virales mencionadas anteriormente.
A diferencia de lo que sucede con las hepatitis A y B, no se dispone por el momento de una vacuna frente a la hepatitis C y no hay evidencias que avalen la utilidad de la inmunoglobulina inespecífica. La medida más eficaz para reducir la posibilidad de contraer hepatitis postransfusional por VHC es la detección sistemática del virus en la sangre de los donantes de sangre mediante la determinación de los anticuerpos anti-VHC. Por su parte, los agentes farmacológicos antivirales que han demostrado un eficacia contrastada frente al VHC – definida como la eliminación del virus en sangre mantenida hasta un año después de finalizado el tratamiento – son el interferón alfa y la ribavirina.
El interferón alfa, como tal o pegilado, permite normalizar las transaminasas y disminuir la inflamación hepática en el 50% de los pacientes; sin embargo, sólo se observa una respuesta persistente en menos de una cuarta parte de los tratados, aunque los pacientes más jóvenes sin cirrosis hepática y con niveles de viremia bajos son presentan una respuesta algo más favorable. Por su parte, la ribavirina es un peculiar fármaco con un amplio espectro antiviral, actuando tanto sobre virus ARN como ADN, destacando los virus gripales (tipos A y B) y los virus sincitiales respiratorios; también ha mostrado actividad frente a herpesvirus, retrovirus, virus de la fiebre Lassa (un arenavirus), y el virus de la hepatitis C (VHC) entre otros. En general, la adición de ribavirina incrementar sustancialmente la respuesta al interferón alfa en los pacientes afectados por hepatitis C crónica; de ahí que la combinación de ribavirina con peginterferón alfa 1a o 1b (que han desplazado a las formas no pegiladas, por su mayor comodidad de uso) se convirtiera en el tratamiento estándar durante varios años. No obstante, la tasa global de respuesta viral sostenida (RVS) se situaba en torno al 50% y ello a costa de una notable toxicidad. En general, el virus 1b era más resistente y requería tratamientos más prolongados, de hasta 48 semanas; por el contrario, la tasa de respuestas ascendía con este tratamiento hasta un 80% para los genotipos 2 y 3, requiriendo además tratamientos más cortos, en torno a 24 semanas.
Sin embargo, en el año 2011 se produjo un cambio notable en el panorama terapéutico de la hepatitis C, al autorizarse el boceprevir y el telaprevir – la primera generación de inhibidores selectivos y reversibles de la proteasa NS3 – para el tratamiento de pacientes infectados por VHC de tipo 1, tanto no tratados previamente (naïve) como tratados, en combinación de con peginterferón alfa y ribavirina (terapia triple). En estas circunstancias, las tasas de respuesta tanto en pacientes naïve como en pretratados llegaban a doblarse prácticamente, permitiendo acortar la duración del tratamiento en muchos de los pacientes (60%) de 48 a 24 semanas (Cuéllar, 2012).
Sin embargo, boceprevir y telaprevir presentaban perfiles toxicológicos importantes que obligaban a suspender el tratamiento en un porcentaje de pacientes netamente superior a los tratados solo con peginterferín y ribavirina, amén de un amplio abanico de interacciones farmacológicas, lo cual, asociado con la propia complejidad del tratamiento, dejaba un amplio margen para la mejora.
Tras esta primera generación de inhibidores de la proteasa del VHC ha llegado una nueva oleada de agentes con propiedades farmacodinámicas, farmacocinéticas y toxicológicas más satisfactorias, que está en la fase final del proceso de autorización por las agencias reguladoras (EMA, en el caso de la Unión Europea) o han recibido dicha autorización en los últimos meses. Se trata del asunaprevir, inhibidor de la NS3); simeprevir, faldaprevir y vaniprevir, inhibidores duales de NS3 y NS4A; daclatasvir y ledipasvir, de la NS5A; y sofosbuvir y deleobuvir, de la NS5B.
ACCIÓN Y MECANISMO
El simeprevir es un agente antiviral activo frente a virus de la hepatitis C, que actúa inhibiendo específicamente el complejo de serina proteasa NS3/4A, lo que impide la replicación viral. Ha sido autorizado para el tratamiento, en combinación con otros medicamentos, de la hepatitis C crónica en adultos.
La proteína NS3 del VHC es una enzima multifuncional ya que presenta en el primer tercio de su estructura, una actividad de proteasa de serina y en el resto función de ARN helicasa DexH/D que revierte el enrollamiento de cadenas dobles de ARN formadas durante la replicación viral. El extremo NS4A es una proteína que se asocia con las cadenas de NS3 y provoca una reorganización en su estructura, optimizando así la actividad de proteasa de NS3; además NS4A promueve la localización del complejo NS3/4A a la membrana del retículo endoplásmico donde es procesada la poliproteína viral. El fármaco es especialmente activo frente a los genotipos 1a y 1b (es tres veces más potente bloqueando la proteasa NS3 del 1a que del 1b), aunque también tiene efectos significativos sobre los genotipos 2a, 4a y 6a; por el contrario, la proteasa de los genotipos 3a y 5a es menos susceptible.
La resistencia del VHC a simeprevir está directamente relacionada con mutaciones que conducen a determinadas variaciones en la secuencia peptídica de la proteasa NS3, en particular de los aminoácidos localizados en las posiciones 40, 80, 122, 155, 156 y 168, siendo las más comúnmente descritas como causantes de resistencia clínica al fármaco en pacientes con VHC (no alcanzaron una respuesta virológica sostenida) las mutaciones por sustitución D168E (ácido glutámico por ácido aspártico en la posición 168; 14,5% para pacientes con VHC 1a y 17,4% para 1b), D168V (valina por ácido aspártico; 10,3% en 1a y 60,5% en 1b), Q80R (arginina por glutamina; 4,3% para 1a y 12,3% para 1,b) y R155K (lisina por arginina; 76,7% para 1a y 0% para 1b).
En cuanto a la resistencia cruzada, se observó que las cepas de VHC infectantes de los pacientes tratados con simeprevir que no experimentaron curación virológica (especialmente, con la mutación R155K) también presentaban una susceptibilidad reducida a telaprevir y boceprevir. No obstante, las variantes resistentes a simeprevir mostraron en general susceptibilidad a los inhibidores de NS5A (daclatasvir, etc.) y, vicerversa.
ASPECTOS MOLECULARES
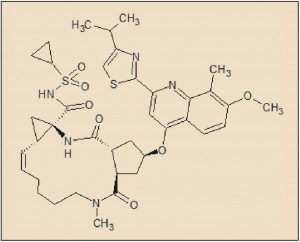
Aunque aparentemente hay bastantes diferencias estructurales con otros inhibidores de la proteasa del VHC conocidos, coincide con estos en la presencia de varios grupos amida que le confieren a la molécula una carácter de falso péptido, lo que resulta necesario para incorporarse – y bloquear – a determinadas regiones de la proteasa (NS3/NS4A).
El simeprevir presenta una estructura química relativamente compleja, caracterizado por la presencia de un anillo de 14 eslabones (macrociclo), formado por la condensación doble de una diamina (1,8-octanodiamina) con un diácido (ácido 3-hidroxipentano-1,2-dicarboxílico), formando una doble amida intracatenaria (lactama). También presenta una insaturación en el anillo, del que forman parte, asimismo, dos estructuras anulares (un ciclopropano y un ciclopentano) que quedan integradas en el anillo de 14 eslabones. En términos químicos, el simprevir corresponde a la (2R,3aR,10Z,11aS,12aR,14aR)-N-(17-(2-(4-isopropiltiazol-2-il)-7-metoxi-8-metilquinolin-4-iloxi)-13-metil-2,14-dioxo-3,13-diazatriciclo(13.3.0.04,6)octadec-7-eno-4-carbonil)(ciclopropil)sulfonamida.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad del simeprevir en la indicación autorizada han sido contrastadas mediante varios ensayos clínicos: dos de fase III en pacientes no pretratados (C208, QUEST-1; C216, QUEST-2), uno de fase III en pacientes con recidiva viral tras tratamiento con interferón alfa ( HPC3007; PROMISE), otro en combinación con sofosbuvir (con o sin ribavirina) en pacientes no responderores a peginterferon alfa y ribavirina y en pacientes naïve (COSMOS), uno de fase IIb en pacientes con recidiva vital tras tratamiento con interferón alfa y ribavirina (C206; ASPIRE) y uno de fase III y abierto, en pacientes coinfectados por VIH y VHC (C212). En todos los casos, la variable primaria de eficacia utilizada fue la tasa de pacientes con respuesta viral sostenida (menos de 25 copias/ml de ARN de VHC a la semana 12 después de haber finalizado el tratamiento completo).
QUEST-1 Y QUEST-2 son dos estudios de fase III, aleatorizados, multicéntricos, multinacionales, doblemente ciegos y controlados con placebo, en los que se buscaba confirmar la eficacia y la seguridad del simeprevir, combinada con peginterferón alfa y ribavirina, en pacientes con hepatitis viral C crónica no tratados previamente (naïve).
El primero de estos ensayos clínicos (C208; QUEST-1; Jacobson, 2014) fue llevado a cabo en 13 países de Europa, Norteamérica, Puerto Rico, Australia y Nueva Zelanda, sobre un conjunto de 394 pacientes adultos, de los que un 56% eran varones, un 89% de raza blanca, con una mediana de edad de 48 años (un 43% tenían menos de 46 años y un 56% entre 46 y 65), con unas medianas de 81 kg de peso y 26,6 de índice masa corporal (IMC).
Los pacientes fueron aleatoriamente asignados a uno de los dos brazos de tratamiento: simeprevir (150 mg/24 h, oral) más peginterferón alfa-2a (180 µg/semana, subcutáneo) y rabavirina (1000 o 1200 mg/día, según peso, oral) durante 12 semanas, seguido de otras 12 semanas de peginterferón alfa-2a y ribavirina; el otro brazo de tratamiento fue idéntico, sustituyendo el simeprevir por placebo. La duración del tratamiento fue de 24 (12+12) o de 48 (12+36) semanas en el grupo del simeprevir, según la respuesta precoz2, mientras que en todos los casos fue de 48 semanas en el brazo placebo.
Los resultados mostraron una tasa de respuesta viral sostenida del 79,3% en el brazo del simeprevir vs. 50,1% en el del placebo, con una diferencia de 29,3 puntos porcentuales (IC95% 20,1 a 38,6; p< 0,0001).
El estudio QUEST-2 (Manns, 2014) tuvo un diseño y tipo de pacientes idéntico al anterior, llevándose a cabo en 76 localizaciones de 14 países de Europa, Norte y Sudamérica. El esquema terapéutico fue también igual, salvo por el hecho de que se utilizaron dos clases de interferón alfa (180 µg/semana de peginterferón alfa-2a y 50, 80, 100, 120 o 150 µg/semana, según peso, de peginterferón alfa-2b), asignados aleatoriamente entre los pacientes. En este caso, los resultados globales mostraron una tasa de respuesta viral sostenida del 81,9% vs. 50,1% 49,7%, con una diferencia de 32,2 puntos porcentuales (IC95% 23,3 a 41,2; p< 0,001). Considerando específicamente el tipo de interferón utilizado, la respuesta en los pacientes tratados con peginterferón alfa-2a fueron de 91,5% vs. 57,6%, (diferencia de 33,9 puntos porcentuales; IC95% 21,0 a 46,8; p< 0,01), mientras que la de aquellos tratados con peginterferón alfa-2b fueron de 81,0% vs. 34,9%, (diferencia de 46,1 porcentuales; IC95% 33,9 a 58,3; p< 0,01).
Agregando los datos procedentes de QEUST-1 y de QUEST-2, las tasas de respuesta viral sostenida fueron del 80,4% vs. 50,0%, (diferencia de 30,5 puntos porcentuales; IC95% 24,1 a 36,9; p< 0,001).
El estudio PROMISE (HPC3007; Forns, 2014) evaluó la eficacia del tratamiento combinado de simeprevir (o placebo), peginterferón alfa-2a y ribavirina en pacientes tratados previamente con interferón alfa y que habían experimentado una recidiva del VHC. El estudio inclyó a 393 pacientes pretratados anteriormente con interferón durante al menos 24 semanas habiendo obtenido inicialmente una respuesta viral satisfactoria, recayendo posteriormente. En el momento de comenzar el estudio, todos los pacientes tenían una carga viral superior a las 10.000 copias/ml de ARN de VHC, con una mediana de 3.090.000 (6,49 log10) copias/ml y teniendo un 84% de ellos más de 800.000 copias/ml. Un 66% eran varones y el 94% era de raza blanca. El protocolo terapéutico fue el mismo que en los ensayos clínicos anteriormente comentados, registrándose una tasa de respuesta viral sostenida del 79,6% vs. 36,6%, (diferencia de 43,0 porcentuales; IC95% 33,8 a 52,3; p< 0,01).
Asimismo, el estudio ASPIRE (C206; Zeuzem, 2013) analizó la eficacia de simeprevir en pacientes previamente tratados con interferón alfa y ribavirina. Este estudio incluyó a pacientes con cirrosis y se evaluaron distintas posologías de simeprevir. Los grupos de tratamiento 1 y 2, recibieron 12 semanas de triple terapia con peginterferón alfa, ribavirina y simeprevir (100 mg o 150 mg, respectivamente) seguido de 36 semanas de biterapia con peginterferón y ribavirina; los grupos 3 y 4, recibieron 24 semanas de triple terapia (con dosis de simeprevir de 100mg o 150 mg) seguido de 36 semanas de biterapia a dosis estándar según peso) y el grupo 5 y 6 recibieron 48 semanas de triple terapia. Los pacientes asignados al grupo placebo recibieron 48 semanas de biterapia y placebo.
Las tasas globales de respuesta fueron del 61-80% vs. 23% (p <0,001), variandpo según el tipo de respuesta previa: 38-59% vs. 19% en respondedores nulos, 48-86% vs. 9% en respondedores parciales y 77-89% vs 37% en pacientes que recayeron tras una respuesta inicial satisfactoria. Según las dosis de simeprevir, las tasas de respuesta fueron del 65% (100 mg) y 73% (150 mg), pero similares con relación a la duración del tratamiento. Los pacientes con cirrosis presentaron tasas de respuesta inferiores (61-62%), aunque manifiestamente mejores que las obtenidas en el grupo placebo (0%).
El estudio COSMOS (Lawitz, 2014) incluyó a 168 pacientes con hepatitis C crónica por VHC de genotipo 1 no pretratados (naïve) o que previamente no habían respondido a peginterferón alfa y ribavirina. Los pacientes fueron asignados al azar para recibir 150 mg de simeprevir y 400 mg de sofosbuvir al día durante 24 semanas con (grupo 1) o sin (grupo 2) ribavirina, o 12 semanas con (grupo 3) o sin (grupo 4) ribavirina, en dos cohortes: no respondedores previos con puntuaciones en la escala METAVIR3 de 0 a 2 (cohorte 1) y no respondedores previos y pacientes sin tratamiento previo con puntuaciones 3 a 4 (cohorte 2). Los resultados mostraron una tasa de respuesta del 92% (IC95% 81-96) en la cohorte 1 del 94% (IC95% 87-98) en la 2.
Finalmente, el estudio C212 (EPAR, 2014) investigó la eficacia del simeprevir en pacientes coinfectados por VIH y VHC. Se trata de un ensayo clínico de fase III, abierto, realizado sobre 106 pacientes tratados (peginterferon alfa y ribavirina) o no previamente para el VHC, de los que un 88% estaba siendo tratado con tratamiento antirretroviral para la infección por VIH. Las características demográficas de los pacientes eran: 48 años de mediana de edad (27-67), 85% varones, y el 82% de raza blanca). La mediana de la carga viral era de 3.236.000 (6,51 log10) copias/ml de ARN de VIHC, teniendo el 86% más de 800.000 copias/ml; por su parte la mediana de la carga viral de VIH era de 15.100 (4,18 log10) copias/ml. Un 50% de los pacientes no habían recibido tratamiento previo para el VHC, un 14% habían experimentado recidivas, un 9% eran respondedores parciales y un 26% no habían obtenido ninguna respuesta al tratamiento previo. Todos ellos fueron sometidos con a un esquema terapéutico triple (con simeprevir) igual al definido en los anteriores estudios comentados.
Los resultados mostraron unas tasas de respuesta viral sostenida 12 semanas después de finalizado el tratamiento y de fracaso durante el mismo4 del 79% y 9%, respectivamente, para los pacientes no tratados previamente, del 87% y 0% para aquellos con recidiva previa, del 70% y 20% para los pacientes con respuesta parcial previa y del 57% y 39% para aquellos con respuesta previa nula.
Desde el punto de vista toxicológico, el simeprevir parece ser bien tolerado y no parece incrementar significativamente la toxicidad del régimen de base de peginterferón alfa y ribavirina. La incidencia de eventos adversos graves es incluso más baja que con placebo (siempre con peginterferón alfa y ribavirina), con tasas comparadas del 2,0 vs. 2,5%, que en el caso de aquellos potencialmente relacionados con el simeprevir (o, en su caso, el placebo) son del 0,4 vs. 0,3%. En cualquier caso, el porcentaje de pacientes que suspendieron el tratamiento en los ensayos clínicos por este motivo es también inferior con simeprevir vs. placebo (2,6 vs. 4,5%). En términos generales, los eventos adversos descritos para el simeprevir con una incidencia de al menos 2 puntos porcentuales mayor que el placebo son: síndrome de tipo gripal (26,0 vs. 21,2%), prurito (20,6 vs. 13,6%), náusea (22,2 vs. 17,6%), exantema (13,6 vs. 11,1%), mialgia (16,1 vs. 13,4%), artralgia (10,2 vs. 7,8%), disnea (7,7 vs. 5,5%) y dolor de espalda (6,3 vs. 4,3%).
ASPECTOS INNOVADORES
El simeprevir es un agente antiviral activo frente a virus de la hepatitis C, que actúa inhibiendo específicamente el complejo de serina proteasa NS3/4A, lo que impide la replicación viral. Ha sido autorizado para el tratamiento, en combinación con otros medicamentos, de la hepatitis C crónica en adultos. El fármaco es especialmente activo frente a los genotipos 1a y 1b, aunque también tiene efectos significativos sobre los genotipos 2a, 4a y 6a; por el contrario, la proteasa de los genotipos 3a y 5a es menos susceptible.
Los resultados de los ensayos clínicos son contundentes, con tasas de respuesta viral sostenida a las 12 semanas 30 o 40 puntos porcentuales por encima de las conseguidas solo con la terapia doble de peginterferón alfa y ribavirina: 80 vs. 50% en pacientes no tratados anteriormente (naïve), 79 vs. 37% en pacientes tratados y respondedores pero con recaída viral posterior, 76 vs. 9% en parcialmente respondedores e incluso 51 vs. 19% en no respondedores. Los resultados son también satisfactorios (aunque metodológicamente menos consistentes) en pacientes coinfectados por VIH y VHC.
No obstante, es preciso indicar que la eficacia en pacientes infectados por VHC de genotipo 1a y con polimorfismo Q80K es solo margina con respecto a la terapia doble. Este polimorfismo viral es frecuente en el genotipo 1a (19-48%) y se asocia con un cierto grado de resistencia al simeprevir (Poveda, 2014).
Algunos datos muy recientes (publicados a finales de julio; Lawitz, 2014) sugieren resultados muy convincentes asociando simeprevir y sofosbuvir, tanto en pacientes pretratados no respondedores al peginterferón como en naïve y con independencia del nivel de fibrosis hepática. Precisamente, la eficacia de esta combinación, en ausencia de interferón, es muy apreciable al añadir el ahorro de la toxicidad del interferón y mejorar así la tolerabilidad del tratamiento (Gaetano, 2014). No obstante, aunque el sofosbuvir (Sovaldi®) ya fue autorizado por la EMA en marzo 2014, en agosto todavía no estaba disponible comercialmente en España.
En cualquier caso, hubiera sido muy deseable una comparación directa entre simeprevir – un inhibidor mixto de NS3/4A – y telaprevir (Incivo®) – un inhibidor puro de NS3 –, con particularidad de que ambos han sido desarrollados por el mismo laboratorio y tienen un esquema posológico similar (12 semanas de tratamiento), a diferencia del otro inhibidor de NS3, el boceprevir (Victrelis®). Es importante, en este sentido, recordar que también la superioridad del telaprevir en asociación con peginterferón alfa y ribavirina ha sido claramente demostrada frente a esta combinación más placebo en pacientes naïve, con tasas de respuesta viral sostenida del 75% vs. 44%, como también lo ha sido con una magnitud similar en pacientes previamente tratados con respuesta nula o parcial, o con recaída). Además, esta superioridad sobre el placebo es general para los genotipos virales 1a y 1b, ni depende del grado de daño hepático preexistente o la presencia de cepas variantes, como IL28B (Cuéllar, 2012). Obviamente, las comparaciones indirectas carecen de valor cuantitativo, pero en este caso resultan bastante ilustrativas.
No obstante y, precisamente a diferencia de telaprevir y boceprevir, el simeprevir es un fármaco relativamente bien tolerado, sin que su adición a la terapia doble de peginterferón alfa y ribavirina dé lugar a un incremento significativo de la toxicidad general ni obligue a más pacientes a suspender el tratamiento por este motivo. Los eventos adversos descritos con algo más de frecuencia que el placebo son prurito, náusea, exantema, mialgia, etc., y no se ha descrito ningún riesgo especial. También a diferencia de telaprevir y boceprevir, el simeprevir solo requiere una única dosis oral diaria, frente a las tres de aquellos.
Es de resaltar la rapidez con que los nuevos fármacos sofosbuvir, simeprevir y daclatasvir, autorizados hace pocos meses, hayan dejado obsoleta a la última guía de práctica clínica de la Asociación Europea para el Estudio del Hígado (European Association for the Study of the Liber, EASL), que había sido publicada en diciembre de 2013, produciendo una nueva edición (EASL, 2014) en la que incluía las nuevas recomendaciones. En concreto, en el caso del tratamiento de la hepatitis C de genotipo 1, la guía establece como opciones preferentes de tratamiento las combinaciones de sofosbuvir o de simeprevir con peginterferon + ribavirina. Como alternativas recomienda daclatasvir junto con peginterferon + ribavirina, sofosbuvir + simeprevir durante 12 semanas o sofosbuvir + daclatasvir durante 12 o 24 semanas.
Ciertamente, el simeprevir forma parte de una segunda oleada de antivirales frente al VHC, tras telaprevir y boceprevir, que aportan elevadas tasas de curación en todos los subtipos de pacientes, a través de regímenes más sencillos y mejor tolerados (Jiménez Galán, 2014). Sea como fuere, conviene recordar que la prevalencia de la hepatitis C en España se sitúa en entorno al 1,5% de la población, lo que supondría un número de personas infectadas de entre 500.000 y 1.000.000. Habida cuenta de que un 60-80% desarrollan la infección crónica y de últimas, un 20% evoluciona a cirrosis hepática al cabo de 20-25 años, de los cuales un 80% acabará por padecer un cáncer de hígado, es evidente el interés sanitario y económico de un tratamiento curativo eficaz.
Como preveíamos en Panroma Actual del Medicamento con ocasión de la comercialización del boceprevir y telaprevir (Cuéllar, 2012), la situación actual evoca un evidente paralelismo farmacológico y terapéutico con la introducción a mediados de los años 90 del pasado siglo de los inhibidores de la proteasa del VIH (saquinavir, etc.), que revolucionaron la terapia del SIDA, permitiendo el desarrollo de los denominados TARGA (tratamientos antirretrovirales de gran actividad). Esperemos que sea así también para la hepatitis C, por el bien de todos.
|
VALORACIÓN |
|
|---|---|
|
SIMEPREVIR - OLYSIO® (Janssen Cilag) |
|
|
Grupo Terapéutico (ATC): J05AE. GRUPO GENERAL. Grupo específico. |
|
|
Indicaciones autorizadas: Tratamiento, en combinación con otros medicamentos, de la hepatitis C crónica en adultos. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN IMPORTANTE. Aportación sustancial a la terapéutica estándar. |
♣ ♣ ♣ |
|
Novedad clínica: Mejora la eficacia clínica del tratamiento farmacológico estándar |
⇑ |
|
Novedad molecular: Incorpora variaciones significativas en el mecanismo de acción. |
⇑ |
|
Novedad toxicológica: Mejora el perfil toxicológico con relación a la terapia farmacológica estándar. |
⇑ |
|
Novedad físico-química: Mejora las características farmacocinéticas, con incidencia en las condiciones de uso. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Boceprevir |
Victrelis |
Merck Sharp Dohme |
2011 |
|
Telaprevir |
Incivo |
Janssen Cilag |
2011 |
|
Simeprevir |
Olysio |
Janssen Cilag |
2014 |
|
COSTE DIRECTO DEL MEDICAMENTO |
||
|---|---|---|
|
Fármaco |
Dosis |
Coste tratamiento (€)** |
|
Simeprevir |
150 mg/24 h |
28.773,39 |
|
Telaprevir |
750 mg/8 h |
28.750,08 |
|
Boceprevir* |
800 mg/8 h |
19.218,66 |
|
|
|
25.624.88 |
|
|
|
35.234,21 |
* Considerando el PVPIVA notificado de los envases requeridos para 12 semanas de tratamiento con simeprevir y telaprevir.
** Considerando el PVPIVA notificado de los envases requeridos para 24, 36 o 44 semanas de tratamiento, en el caso del boceprevir
BIBLIOGRAFÍA
Bibliografía
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Telaprevir (Incivo) en hepatitis C. Panorama Actual Med. 2012; 36 (351): 144-53.
- European Association for the Study of the Liber (EASL). Recommendations on Treatment of Hepatitis C 2014. http://www.easl.eu/_newsroom/latest-news/easl-recommendations-on-treatment-of-hepatitis-c-2014
- European Medicines Agency (EMA). Olysio®. European Public Assessment Report (EPAR). EMA/286589/2014; EMEA/H/C/002777. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002777/WC500167870.pdf
- Forns X, Lawitz E, Zeuzem S, Gane E, Bronowicki JP, Andreone P, Horban A, Brown A, Peeters M, Lenz O, Ouwerkerk-Mahadevan S, Scott J, De La Rosa G, Kalmeijer R, Sinha R, Beumont-Mauviel M. Simeprevir with peginterferon and ribavirin leads to high rates of SVR in patients with HCV genotype 1 who relapsed after previous therapy: a phase 3 trial. Gastroenterology. 2014; 146: 1669-79.e3. doi: 10.1053/j.gastro.2014.02.051.
- Gaetano JN. Benefit-risk assessment of new and emerging treatments for hepatitis C: focus on simeprevir and sofosbuvir. Drug Healthc Patient Saf. 2014; 6:37-45. doi: 10.2147/DHPS.S43304.
- Jacobson IM, Dore GJ, Foster GR, Fried MW, Radu M, Rafalsky VV, Moroz L, Craxi A, Peeters M, Lenz O, Ouwerkerk-Mahadevan S, De La Rosa G, Kalmeijer R, Scott J, Sinha R, Beumont-Mauviel M. Simeprevir with pegylated interferon alfa 2a plus ribavirin in treatment-naïve patients with chronic hepatitis C virus genotype 1 infection (QUEST-1): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet. 2014; 384(9941): 403-13. doi: 10.1016/S0140-6736(14)60494-3.
- Jiménez Galán R, Albacete Ramírez A, Monje Agudo P, Borrego Izquierdo Y, Morillo Verdugo R. Nuevos fármacos en el abordaje terapéutico de la hepatitis C. Farm Hosp. 2014; 38(3): 231-247. DOI: 10.7399/FH.2014.38.3.7314
- Lawitz E, Sulkowski MS, Ghalib R, Rodriguez-Torres M, Younossi ZM, Corregidor A, DeJesus E, Pearlman B, Rabinovitz M, Gitlin N, Lim JK, Pockros PJ, Scott JD, Fevery B, Lambrecht T, Ouwerkerk-Mahadevan S, Callewaert K, Symonds WT, Picchio G, Lindsay KL, Beumont M, Jacobson IM. Simeprevir plus sofosbuvir, with or without ribavirin, to treat chronic infection with hepatitis C virus genotype 1 in non-responders to pegylated interferon and ribavirin and treatment-naive patients: the COSMOS randomised study. Lancet. 2014 Jul 26. pii: S0140-6736(14)61036-9. doi: 10.1016/S0140-6736(14)61036-9. [Epub ahead of print]
- Manns M, Marcellin P, Poordad F, de Araujo ES, Buti M, Horsmans Y, Janczewska E, Villamil F, Scott J, Peeters M, Lenz O, Ouwerkerk-Mahadevan S, De La Rosa G, Kalmeijer R, Sinha R, Beumont-Mauviel M. Simeprevir with pegylated interferon alfa 2a or 2b plus ribavirin in treatment-naive patients with chronic hepatitis C virus genotype 1 infection (QUEST-2): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2014; 384(9941): 414-26. doi: 10.1016/S0140-6736(14)60538-9.
- Poveda E, Wyles DL, Mena A, Pedreira JD, Castro-Iglesias A, Cachay E. Update on hepatitis C virus resistance to direct-acting antiviral agents. Antiviral Res. 2014; 108C: 181-191. doi: 10.1016/j.antiviral.2014.05.015.
- Zeuzem S, Berg T, Gane E, Ferenci P, Foster GR, Fried MW, Hezode C, Hirschfield GM, Jacobson I, Nikitin I, Pockros PJ, Poordad F, Scott J, Lenz O, Peeters M, Sekar V, De Smedt G, Sinha R, Beumont-Mauviel M. Simeprevir increases rate of sustained virologic response among treatment-experienced patients with HCV genotype-1 infection: a phase IIb trial. Gastroenterology. 2014; 146(2): 430-41.e6. doi: 10.1053/j.gastro.2013.10.058.
1 Entre el 30% y el 50% de los pacientes con VIH están coinfectados por VHC.
2 Según el protocolo RGT (response-guided therapy) previamente definido, considerando la existencia de niveles inferiores a 25 copias/ml de ARN del VHC a las 4 o a las 12 semanas.
3 La escala METAVIR permite evaluar los estadios de fibrosis en individuos con hepatitis crónica viral o alcohólica, utilizando cinco niveles: sin fibrosis (F0), fibrosis perisinusoidal sin septos (F1), fibrosis portal y periportal con mínimos septos (F2), fibrosis portal y periportal con muchos septos (F3) y cirrosis (F4).
4 Proporción de pacientes con niveles séricos de copias de ARN de VHC detectables al finalizar el tratamiento.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




