Sacubitrilo/Valsartán (▼Entresto®, Novartis) en insuficiencia cardiaca
 Nº397
Nº397
Resumen
El medicamento está formado por un complejo equimolecular de sacubitrilo y valsartán. El sacubitrilo es un profármaco, cuya forma activa (el metabolito LBQ657) inhibe la neprilisina, una endopeptidasa neutra (NEP) que participa en la degradación proteolítica de diversos péptidos natriuréticos, potenciando así los efectos de estos últimos. Por su parte, el valsartán es inhibidor del receptor de tipo 1 de la angiotensina II, por lo que previene los efectos de ésta a nivel cardiovascular y renal e inhibe la liberación de aldosterona dependiente de angiotensina II. El medicamento ha sido autorizado para el tratamiento de la insuficiencia cardiaca crónica sintomática con fracción de eyección reducida, en adultos. Un amplio estudio clínico realizado con este nuevo fármaco, ha demostrado que es capaz de reducir la mortalidad y la necesidad de hospitalización derivadas de la insuficiencia cardíaca en torno a un 20% a lo largo de un periodo de dos años. Por otro lado, la tasa de mortalidad por cualquier causa experimenta una reducción relativa del 16%. Desde el punto de vista de la seguridad, el complejo sacubitrilo/valsartán presenta un perfil toxicológico relativamente benigno, equiparable al del enalaprilo, siendo los eventos adversos más comunes hipotensión, insuficiencia renal e hiperpotasemia. Todo lo anterior sugiere que la introducción de sacubitril/valsartán en clínica supone una mejora sustancial dentro de un campo donde hay muy pocas novedades de interés farmacológico o terapéutico en las últimas décadas. La consistencia de los datos clínicos y la mejora de la supervivencia, aunque modesta, van acompañadas por un mecanismo farmacológico innovador, la inhibición de la neprilisina, capaz de impedir la degradación de los péptidos natriuréticos, potenciando así los efectos de estos últimos.
ASPECTOS FISIOPATOLÓGICOS
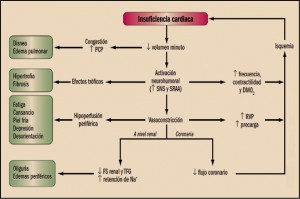
Según la Sociedad Europea de Cardiología, la insuficiencia cardiaca (IC) es el estado en el que el corazón es incapaz de mantener una suficiente capacidad de bombeo sanguíneo, expresada como volumen minuto, en relación con el retorno venoso y las necesidades metabólicas del organismo en cada momento, o cuando solo puede hacerlo a expensas de unas presiones de llenado muy elevadas. En este sentido, la disminución del volumen minuto cardiaco es responsable de los signos y síntomas de un deficiente riesgo sanguíneo de los tejidos (hipoperfusión tisular):
- Piel: fría y sudorosa
- Músculo esquelético: fatiga, astenia, disminución de la tolerancia al ejercicio.
- Riñón: oliguria.
- Sistema nervioso central: depresión, desorientación.
Adicionalmente, la sangre que no puede ser expulsada durante la sístole cardiaca se acumula retrógradamente en el territorio venoso, originando los signos y síntomas de congestión pulmonar (disnea, edema pulmonar) y sistémica (edemas periféricos).
En la insuficiencia cardiaca sistólica, la anomalía primaria consiste en un déficit de la contractilidad cardiaca, y se caracteriza por un aumento del tamaño cardiaco (cardiomegalia) y de la presión intraventricular al final del llenado (diástole) del ventrículo izquierdo (presión telediastólica) y una disminución de la fracción de eyección ventricular izquierda (< 40%) y del volumen minuto cardiaco. La fracción de eyección es el porcentaje del volumen de sangre que contiene el ventrículo antes de contraerse que es bombeado en cada sístole. En condiciones normales, el corazón expulsa el 50-60% del volumen de sangre durante la sístole, pero puede aumentar hasta un 80-85% durante el ejercicio. Una fracción de eyección inferior al 30-35% indica la presencia de insuficiencia cardiaca sistólica (Tamargo, 2012).
Sin embargo, hasta un 40% de los pacientes con insuficiencia cardiaca presenta una fracción de eyección ventricular izquierda normal y el corazón no está dilatado; en realidad, lo que se observa es una alteración de la distensibilidad ventricular, que dificulta la relajación y aumenta la presión diastólica final ventricular. Es decir, presentan una insuficiencia cardiaca diastólica o con fracción de eyección preservada.
En ocasiones, el término insuficiencia cardiaca va asociado a otros, que lo matizan. Por ejemplo, de nueva aparición, cuando es el primer episodio (p. ej., tras un infarto de miocardio extenso); congestiva, que hace referencia al acúmulo de líquidos (edemas) a nivel pulmonar y sistémico; izquierda o derecha, lo que indica cuál de los dos ventrículos es el insuficiente; crónica, cuando se desarrolla a lo largo de meses o años; y aguda, caracterizada por la rápida aparición de los signos y síntomas o por el rápido empeoramiento (descompensación) de una insuficiencia crónica, que requiere un tratamiento urgente. Este último cuadro cursa con una reducción brusca e intensa del volumen minuto, síntomas de hipoperfusión periférica y congestión venosa; el cuadro, en ocasiones, culmina en un edema pulmonar. La descompensación de la insuficiencia cardiaca crónica es responsable del 80% de las hospitalizaciones por insuficiencia cardiaca. Finalmente, también debe citarse a la disfunción ventricular asintomática, caracterizada por una fracción de eyección <40% pero que no manifiesta síntomas clínicos.
La insuficiencia cardiaca es un grave problema sociosanitario, ya que afecta al 0,5-2% de la población (1,7% en el grupo de edad de 45-54 años; 6,1% en el de 65-74 años y más del 10% en pacientes >80 años), y su prevalencia sigue aumentando debido al envejecimiento de la población, la mayor supervivencia de los pacientes que han sufrido un infarto de miocardio y la eficacia de los programas de prevención secundaria en pacientes de alto riesgo. En España, la insuficiencia cardiaca es la causa más frecuente de ingreso hospitalario en personas de más de 65 años, y representa la tercera causa de mortalidad cardiovascular, después de la cardiopatía isquémica y la enfermedad cerebrovascular.
Además, la calidad de vida del paciente con insuficiencia cardiaca es muy pobre (peor incluso que la del paciente canceroso) y el pronóstico muy sombrío, aumentando la mortalidad con la gravedad del síndrome. Se ha estimado que el 30-50% de los pacientes diagnosticados de insuficiencia cardiaca leve o moderada fallecerá en el plazo de 5 años, mientras que un 50% de los pacientes graves (p. ej., tras infarto de miocardio) fallecerá durante el primer año. La alta prevalencia, las frecuentes hospitalizaciones y las pruebas diagnósticas explican el alto coste que el tratamiento de esta enfermedad conlleva (1-2% del gasto sanitario).
La función de bomba del ventrículo depende de cuatro factores que regulan el volumen minuto, es decir, el volumen de sangre que el corazón bombea en un minuto (figura 2).
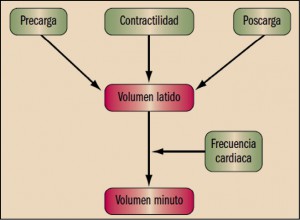
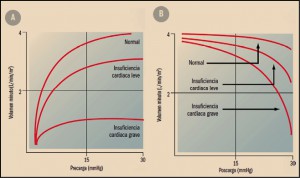
La precarga es la presión que distiende al miocardio durante la diástole (dilatación y llenado) y determina el grado de elongación de la célula cardiaca antes de contraerse; equivale a la presión telediastólica del ventrículo izquierdo. Relacionando la precarga y el volumen minuto, se puede construir una curva de función ventricular en la que se observa que, dentro de ciertos límites, cuanto más se llena de sangre el ventrículo durante la diástole (precarga), mayor es el volumen de sangre expulsado durante la sístole (ley de Frank Starling, figura 3A).
En la insuficiencia cardiaca aumenta la precarga, como consecuencia de la reducción del volumen sistólico – que incrementa la presión y el volumen de sangre (volemia) en la cavidad ventricular al final de la sístole – y del aumento de la volemia. Cuando la precarga alcanza valores >20-25 mmHg, el volumen minuto disminuye y aparecen signos de congestión y edema pulmonar.
Por su parte, la poscarga es la fuerza que deben desarrollar los ventrículos para enviar la sangre a las arterias aorta (ventrículo izquierdo) y pulmonares (ventrículo derecho), y se equipara a las resistencias vasculares periféricas. Dado que según la ecuación, presión arterial = volumen minuto × resistencias vasculares periféricas, un aumento de las resistencias vasculares hace que disminuya el volumen minuto1. En el miocardio normal, la precarga determina los cambios del volumen minuto, de forma que pequeñas modificaciones de la precarga producen importantes variaciones del volumen minuto, mientras que las variaciones de la poscarga no se acompañan de cambios importantes en el volumen minuto (figura 3). Sin embargo, en la insuficiencia cardiaca, la curva de función ventricular se aplana, por lo que cambios importantes de la precarga apenas modifican el volumen minuto. En estas condiciones, las variaciones del volumen minuto dependen fundamentalmente de la poscarga (figura 3B). Esta es la justificación de la utilización de los fármacos vasodilatadores en el tratamiento de la insuficiencia cardiaca (Tamargo, 2012).
La frecuencia cardiaca está controlada por el tono vegetativo. En la insuficiencia cardiaca aumenta el tono simpático y se produce una taquicardia compensadora que intenta mantener el volumen minuto, pero que no aumenta (o incluso disminuye) la contractilidad cardiaca. La contractilidad es la fuerza que desarrolla el corazón al contraerse y está determinada por la concentración de calcio intracelular libre ([Ca2+]i) en el miocardio durante la sístole a nivel de las proteínas contráctiles y que se encuentra deprimida en los pacientes con insuficiencia cardiaca sistólica que cursa con bajo volumen minuto (p. ej., posinfarto de miocardio).
En los pacientes con insuficiencia cardiaca se ponen en marcha varios mecanismos que intentan compensar la reducción del volumen minuto. Aunque a corto plazo estos mecanismos son beneficiosos, a largo plazo aceleran la progresión natural de la insuficiencia cardiaca y disminuyen la supervivencia del paciente.
- Dilatación cardiaca. El ventrículo insuficiente presenta un aumento de la presión y del volumen ventriculares al final de la diástole (precarga), como consecuencia de la disminución del volumen de eyección (volumen latido) y del aumento del volumen residual que dilata la cavidad ventricular. Esta dilatación aumenta la fuerza contráctil y el volumen de eyección ventricular durante la sístole (ley de Frank-Starling). Sin embargo, en la insuficiencia cardiaca la curva de función ventricular es plana y el aumento de la precarga no aumenta el volumen de eyección. Además, el aumento de la precarga tiene dos inconvenientes, ya que incrementa la presión telediastólica del ventrículo izquierdo y la presión capilar pulmonar, facilitando la aparición de signos de congestión pulmonar (disnea); asimismo, incrementa la tensión de la pared ventricular y las demandas miocárdicas de O2, lo que puede producir o agravar la isquemia cardiaca.
- Hipertrofia cardiaca. Cuando existe una sobrecarga hemodinámica, ya sea de presión o de volumen, el ventrículo responde con un aumento de la masa muscular. Según la ley de Laplace (T = P × R/2 h), la tensión (T) a la que está sometida la pared ventricular es directamente proporcional a la presión intraventricular (P) y al radio (R), e inversamente proporcional al grosor de la pared ventricular (h). Por tanto, la hipertrofia es un mecanismo compensador que intenta reducir la tensión de la pared ventricular y aumentar la función sistólica. Sin embargo, la hipertrofia no se acompaña de un aumento paralelo de la vascularización coronaria, lo que puede acentuar la isquemia (incluso en ausencia de enfermedad coronaria) y la necrosis cardiaca. Por otro lado, la hipertrofia se acompaña de una marcada fibrosis que altera la arquitectura ventricular, reduce su distensibilidad y acentúa la disminución del volumen minuto. Por tanto, la hipertrofia y la fibrosis aceleran la progresión de la insuficiencia cardiaca y aumentan la morbimortalidad.
- Activación neurohumoral. La reducción del volumen minuto cardiaco activa diversos mecanismos neurohumorales de signo opuesto, predominando los que presentan propiedades vasoconstrictoras, antidiuréticas y mitogénicas (sistema renina-angiotensina-aldosterona, tono simpático, vasopresina y endotelina 1), y aceleran la progresión de la insuficiencia cardiaca. A corto plazo, la activación neurohumoral produce una vasoconstricción arteriovenosa que ayuda a mantener la presión arterial, redistribuye los flujos sanguíneos (aumenta los flujos cerebral y coronario y disminuye la perfusión a nivel renal, esplácnico y cutáneo) y aumenta la contractilidad y la frecuencia cardiacas. Sin embargo, a largo plazo, la vasoconstricción arteriovenosa aumenta la precarga y la poscarga y reduce aún más el volumen minuto, la retención hidrosalina facilita la aparición de edemas y signos de congestión pulmonar, el aumento de la frecuencia cardiaca facilita la aparición de taquiarritmias e incrementa las demandas miocárdicas de O2 y los efectos proliferativos acentúan la hipertrofia y la fibrosis cardiaca. Además, el aumento de la contractilidad y la frecuencia cardiacas y de las resistencias vasculares periféricas incrementa las demandas miocárdicas de O2 y la isquemia cardiaca, la principal causa de IC. Por tanto, a largo plazo, la activación neurohumoral empeora la función ventricular, acelera la progresión de la IC y aumenta la morbimortalidad del paciente. De hecho: 1) los pacientes con IC que presentan los niveles plasmáticos más elevados de renina, angiotensina II (AII), aldosterona, noradrenalina o endotelina 1 presentan menor supervivencia; y 2) los agonistas β-adrenérgicos aumentan la mortalidad, mientras que los inhibidores del SRAA y los betabloqueantes mejoran la sintomatología y reducen la morbimortalidad del paciente. Estos hallazgos han sido la base para la utilización de inhibidores neurohumorales en el tratamiento de la IC.
¿Pero cuál es el motivo de la función de bomba del corazón esté deprimida? Los motivos pueden ser múltiples, aunque los más destacables son:
- una disfunción de la contractilidad cardiaca, como consecuencia de la pérdida de miocitos cardiacos, como sucede tras un infarto de miocardio;
- una sobrecarga de presión impuesta al corazón, como consecuencia de valvulopatías (estenosis aortica o pulmonar), coartación aortica o la presencia de hipertensión arterial sistémica o pulmonar;
- una sobrecarga de volumen, como sucede en presencia de hipervolemia, insuficiencia valvular (mitral, aórtica o tricuspídea) y defectos del tabique interauricular o interventricular;
- una disminución del llenado ventricular secundaria a alteraciones de la distensibilidad (hipertrofia y fibrosis cardiaca), hipovolemia, pericarditis constrictiva, valvulopatías (estenosis tricuspídea o mitral), miocardiopatías (dilatada, hipertrófica, restrictiva), taquiarritmias o bradiarritmias. Las taquiarritmias pueden producir IC porque reducen el tiempo de llenado ventricular, disminuyen la participación de la aurícula en el llenado ventricular y aumentan las demandas miocárdicas de O2 y la cardiopatía isquémica. Además, las taquiarritmias crónicas producen una taquimiocardiopatía, una forma de cardiomiopatía dilatada. Las bradiarritmias marcadas también pueden reducir el volumen minuto. En definitiva, la insuficiencia cardiaca representa el estadio final de muchas cardiopatías.
Otras causas de IC incluyen infecciones generales y respiratorias, alteraciones metabólicas (hipertiroidismo, feocromocitoma, enfermedad de Cushing), uso de determinados fármacos (betabloqueantes, antiarrítmicos, calcioantagonistas, antitumorales, zidovudina), alcoholismo, colagenosis (lupus eritematoso, esclerodermia, dermatomiositis), sarcoidosis y arritmias cardiacas.
En Europa, la cardiopatía isquémica es responsable de hasta un 70% de los cuadros de insuficiencia cardiaca sistólica (casi el 40% de los pacientes ha tenido un infarto de miocardio previo), aunque la hipertensión arterial y la diabetes están presentes en muchos pacientes. El riesgo de insuficiencia cardiaca se duplica en pacientes con hipertensión arterial moderada y se cuadruplica en los que presentan cifras >160/90 mmHg. La diabetes mellitus es un factor de riesgo para la aparición de cardiopatía isquémica y coexiste con la hipertensión arterial, lo que explica por qué en la mujer diabética el riesgo de insuficiencia cardiaca se quintuplica.
La New York Heart Association (NYHA) clasifica la IC, según los síntomas y la capacidad de ejercicio del paciente, en 4 clases funciónales. La clase I incluye a los pacientes sin limitación de la actividad física. La clase II, a los que presentan síntomas realizando la actividad física habitual, pero no en reposo; la clase III, a los que presentan síntomas cuando realizan una actividad física más ligera de la habitual; y la clase IV, a los que presentan síntomas de IC incluso en reposo.
Dado su carácter progresivo y su elevada morbimortalidad, el tratamiento de la insuficiencia cardiaca tiene como objetivos: a) reducir la mortalidad; b) reducir la morbilidad: aliviar los signos y síntomas, mejorar la calidad de vida, corregir las alteraciones hemodinámicas, aumentar la capacidad de ejercicio y reducir las hospitalizaciones; y c) prevenir o retrasar el deterioro de la función cardiaca y el desarrollo de daño miocárdico y de la hipertrofia y la fibrosis cardiacas.
El tratamiento farmacológico de la insuficiencia cardiaca se fundamenta actualmente en la utilización de una o varias de las siguientes opciones (Cuéllar, 2015):
- Aumentar la contractilidad miocárdica (inotrópicos positivos):
- Bloqueantes de la ATPasa dependiente de Na+/K+: digoxina
- Incrementadores de los niveles intracelulares de AMPc:
- Simpaticomiméticos: dopamina, dobutamina
- Inhibidores de la fosfodiesterasa 3 (PDE3): milrinona
- Incrementadores de la sensibilidad al Ca2+ de las proteínas contráctiles: levosimendán.
- Mejorar los signos de congestión pulmonar y periférica (diuréticos):
- Del asa (alto techo): bumetanida, furosemida, torasemida
- Tiazidas: hidroclorotiazida, indapamida, xipamida, bendroflumetiazida
- Ahorradores de potasio: amilorida, triamtereno
- Mejorar la función ventricular, reduciendo:
- la precarga (vasodilatadores venosos): nitroglicerina, dinitrato de isosorbida, 5-mononitrato de isosorbida
- la poscarga (vasodilatadores arteriales): bloqueantes de los canales de calcio de tipo L (calcioantagonistas: amlopdipino, felodipino, etc.)
- ambas (vasodilatadores arteriovenosos):
- Nitroprusiato sódico
- Combinación de hidralazina y dinitrato de isosorbida
- Inhibir la activación neurohumoral:
- Inhibidores del sistema renina-angiotensina-aldosterona:
- Inhibidores de la enzima de conversión de la angiotensina (IECA): captopril, enalapril, lisinopril, ramipril, trandolapril, etc.
- Antagonistas de los receptores AT1 de la angiotensina II (ARA II): candesartán, losartán, valsartán, etc.
- Antagonistas de la aldosterona: eplerenona, espironolactona
- Bloqueantes β-adrenérgicos (betabloqueantes): bisoprolol, carvedilol, metoprolol, nebivolol
- Reducir de forma selectiva la frecuencia cardiaca.
- Ivabradina
- Aumentar la presión arterial, el volumen minuto y la perfusión tisular en pacientes con insuficiencia cardiaca aguda e hipotensión arterial que no responden a dopamina o dobutamina: vasopresores de acción breve (adrenalina y noradrenalina).
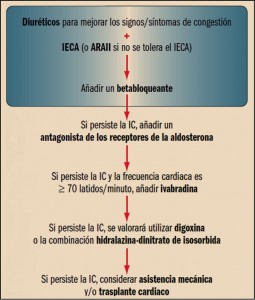
En general, tras el diagnóstico de insuficiencia cardiaca se suele recurrir a la combinación de un IECA (enalaprilo, etc.) o, en caso de intolerancia a éste tipo, un ARA II (losartán, etc.) con un diurético (habitualmente del asa: furosemida, etc.) con el fin de controlar o mejorar los síntomas y signos más relevantes de la enfermedad. A medida que la enfermedad progresa o deja de estar controlada satisfactoriamente con la anterior combinación, se suele añadir a ésta un betabloqueante (carvedilol, bisoprolol, nevibolol). En el caso de que persista, la recomendación incluye un antagonista de la aldosterona, tal como la epleronona o la espironolactona; y si ello no permitiese un adecuado control de los síntomas de insuficiencia y la frecuencia cardiaca no fuera inferior a 70 latidos/minuto, se recomienda la utilización de ivabradina. En los cuadros en los que se mantenga la insuficiencia cardiaca, debe valorarse la utilización de digoxina o la combinación de vasodilatadores hidralazina-dinitrato de isosorbida. Finalmente, los pacientes con cuadros que no responsan satisfactoriamente al tratamiento farmacológico son tributarios de asistencia mecánica y/o trasplante cardiaco.
Los medicamentos que han demostrado hasta ahora reducir la mortalidad son los inhibidores del sistema renina-angiotensina-aldosterona (IECA, ARAII, antagonistas de la aldosterona), los bloqueantes β-adrenérgicos y la ivabradina. Por su parte, no modifican significativamente la mortalidad la digoxina y el levosimendán; mientras que los fármacos inotrópicos positivos (dopamina, dobutamina, milrinona) sí parecen incrementarla, a pesar de su utilidad en determinadas situaciones. Hay datos contradictorios sobre si los diuréticos afectan favorable o desfavorablemente, en su caso, a la mortalidad; en cualquier caso, no se discute su utilidad para el control sintomático de la insuficiencia cardiaca (Tamargo, 2012).
ACCIÓN Y MECANISMO
El medicamento está formado por un complejo equimolecular de sacubitrilo y valsartán. El sacubitrilo es un profármaco, cuya forma activa (el metabolito LBQ657) inhibe la neprilisina, una endopeptidasa neutra (NEP) que participa en la degradación proteolítica de diversos péptidos natriuréticos, potenciando así los efectos de estos últimos. Por su parte, el valsartán es inhibidor del receptor de tipo 1 de la angiotensina II, por lo que previene los efectos de ésta a nivel cardiovascular y renal e inhibe la liberación de aldosterona dependiente de angiotensina II. El medicamento ha sido autorizado para el tratamiento de la insuficiencia cardiaca crónica sintomática con fracción de eyección reducida, en adultos.
Entre los efectos negativos de la hiperactividad del sistema renina-angiotensina-aldosterona, cabe destacar la vasoconstricción, la retención renal de sodio y de fluidos, la activación y proliferación del crecimiento celular de las paredes vasculares, y el consiguiente remodelado desfavorable cardiovascular. En este sentido, la inhibición de la neprilisina provocada por el metabolito activo del sacubitrilo (LBQ657), impide la degradación de los péptidos natriuréticos, potenciando así los efectos de estos últimos; entre ellos, cabe destacar la vasodilatación, la natriuresis y la diuresis, así como el incremento de la filtración glomerular y del flujo sanguíneo renal, la inhibición de la liberación de renina y de aldosterona, la reducción de la actividad del sistema nervioso simpático y efectos antihipertróficos y antifibróticos. Por otro lado, el valsartán bloquea los efectos relacionados con la actividad de la angiotensina II sobre sus receptores, previniendo la activación sistema renina-angiotensina-aldosterona y, en consecuencia, la vasoconstricción, la retención renal de sodio y de fluidos, la activación de la proliferación y crecimiento celular vascular, y el consiguiente remodelado cardiovascular patológico, propio de la insuficiencia cardiaca.
La neprilisina es expresada por una amplia variedad de tejidos, siendo particularmente abundante en el riñón, donde ejerce un importante papel en la regulación del tono vascular a través de diversos péptidos con propiedades vasoactivas y natriuréticas. Se trata de una endopeptidasa neutra2, también conocida como CD10 o antígeno común de la leucemia linfoblástica aguda (Common acute lymphoblastic leukemia-associated, CALLA), es una metaloproteasa dependiente de cinc (Zn) unida a la membrana ampliamente distribuida en los tejidos, con función de hidrolasa encargada de la escisión preferencial de polipéptidos entre residuos hidrofóbicos, particularmente aquellos conteniendo fenilalanina o tirosina que posteriormente funcionarán como hormonas, péptidos inflamatorios y vasoactivos: glucagón, encefalinas, sustancia P, neurotensina, oxitocina y bradicinina. También degrada el amiloide beta, cuya acumulación está implicada en la enfermedad de Alzheimer.
Precisamente, debido a la expresión de la neprilisina por células de diversos tejidos y especialmente por su efecto sobre la degradación del amiloide beta, su inhibición podría plantear la posibilidad de un efecto deletéreo sobre algunos de los mecanismos patológicos de la Enfermedad de Alzheimer. En este sentido, se podría considerar que el sacubitrilo, en tanto que inhibidor de la neprilisina, presenta un riesgo potencial de reducir la degradación de amiloide beta, motivo por el cual esta cuestión se ha incluido dentro del plan de farmacovigilancia del medicamento.
Por otro lado, se han detectado en estudios sobre animales (ratas) posible efectos adversos sobre el hueso y el riñón en especímenes jóvenes y, en particular, una reducción de la masa y de la elongación óseas; aunque no se ha detectado ningún efecto relevante en pacientes humanos adultos en esta materia y el medicamento solo está indicado en pacientes adultos, se ha sugerido (EMA, 2015) que no puede excluirse una interferencia, leve y transitoria en cualquier caso, sobre las primeras etapas de los procesos de consolidación ósea tras una fractura en adultos.
ASPECTOS MOLECULARES
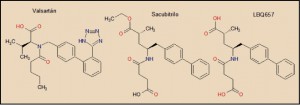
El sacubitrilo y el valsartán están formulados como un complejo equimolecular, que se disocia rápidamente en el tracto digestivo. Como se ha indicado, el sacubitrilo es en realidad un profármaco, cuya forma activa es el metabolito LBQ657, producto de la hidrólisis del agrupamiento éster. En términos estructurales, tanto el LBQ657 como el valsartán son falsos péptidos que actúan como sustratos inhibidores del receptor de tipo I de la angiotensina II (valsartán) y de la actividad enzimática de la neprilisina (LBQ657). Aunque es evidente la similitud estructural de ambos, sin embargo cada uno actúa específicamente sobre su respectiva diana bioquímica.
La neprilisina es una glucoproteína dependiente de zinc (metaloproteína) que presenta dominios intra y extramembranales en las células donde se expresa. En concreto, presenta dos subdominos alfa-helicoidales, que incluyen el inicio y el final de la estructura peptídica, los cuales están anclados a una zona donde se sitúa el centro catalítico, formado por residuos del dominio 1, donde se une con gran afinidad el metabolito LBQ657. En este sentido, son especialmente determinantes el grupo carboxilo próximo al grupo metilo (-CH3) y el resto bifenilo. La configuración especial (el metabolito LBQ657 tiene cuatro posibles estereoisómeros) es muy importante, ya que el isómero RR, correspondientes a los carbonos donde se unen el resto metilo (R) y el bifenilo (S) tiene una potencia bloqueante sobre la neprilisina entre 5 y 100 veces mayor que cualquier de los otros tres estereoisómeros (RR, SS y SR). Todas las interacciones moleculares entre LBQ657 y la neprilisina son de tipo no covalente, lo que está en línea con un modo de inhibición reversible (Schiering, 2016).
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del sacubitrilo/valsartán han sido adecuadamente contrastadas en la indicación autorizada mediante un amplio ensayo clínico de fase 3 (confirmatorio de eficacia y seguridad), aleatorizado, multicéntrico y multinacional (47 países), doblemente ciego, de grupos paralelos y controlados con un comparador activo (enalaprilo). Este estudio, denominado PARADIGMA-HF (Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbility in Heart Failure; McMurray, 2014) tuvo una duración de 27 meses e incluyó a 8.442 pacientes con insuficiencia cardíaca con grados II, III o IV según la clasificación de la NYHA (New York Heart Association), y fracciones de eyección ≤40%3. Los pacientes debían tener elevados niveles de péptido natriurético de tipo B (BNP ≥150 pg/mol, o ≥100 pg/mol en el caso de pacientes que hubieran estado hospitalizados menos de un año).
Las características fisiopatológicas generales de los pacientes participantes fueron: 64 años de mediana de edad (49% ≥65 años), 78% varones, mediana de fracción de eyección del ventrículo izquierdo de 30% (el 89% tenía ≤35%), con clasificación del grado de insuficiencia cardiaca según NYHA mayoritariamente de grado II (70%) y III (24%) y con una mediana de la tasa de filtración glomerular de 60 ml/min/1,73 m2.
Desde al menos un mes antes del inicio del estudio, los pacientes participantes normalizaron su tratamiento farmacológico, recibiendo dosis estables de enalaprilo 10 mg (o equivalntes), betabloqueantes y, en los casos necesarios, de antagonistas de aldosterona (espironolactona, eplerenona) y diuréticos. Los participantes se distribuyeron de manera aleatoria en dos grupos, uno tratado con el complejo sacubitrilo/valsartán (200 mg/12 h), mientras que los del grupo control con enalaprilo (10 mg/12 h), ambos por vía oral. Los pacientes de ambos grupos recibieron el resto de medicación que les había sido prescrita antes de su inclusión en el ensayo.
La variable primaria de eficacia utilizada para determinar la eficacia clínica combinó dos criterios (covariable): muerte de origen cardiovascular y hospitalización por insuficiencia cardíaca. Como variables secundarias de eficacia se determinaron la mortalidad por cualquier causa, la variación en los síntomas y limitaciones físicas según el cuestionario KLCQ (Kansas City Cardiomyopathy Questionnaie), y la mediana de tiempo transcurrido hasta la aparición de un cuadro de fibrilación auricular.
El estudio fue finalizado en la parte doblemente ciega, correspondiente al brazo de control, cuando el análisis intermedio demostró que en el grupo de los pacientes tratados con sacubitrilo/valsartán, la covariable primaria era un 20% inferior a la del grupo de control con enalaprilo, lo que sucedió a tras un seguimiento medio de 27 meses (tasa de riesgo, HR=0,80; IC95% 0,73 a 0,87; p<0,0001). Los respectivos porcentajes de pacientes afectados por la covariable principal fueron del 21,8% con sacubitrilo/valsartán vs. 26,5% con enalaprilo, con una reducción absoluta de 4,7 puntos porcentuales (pp). La reducción del riesgo de la covariable primaria por secubitrilo/valsartán fue consistente en todos estratos de los subgrupos estudiados (edad, sexo, nivel de NYHA, fracción de eyección, etc.).
Considerando de forma separada los dos componentes de la covariable primaria, los porcentajes de muerte de origen cardiovascular fueron del 13,3 vs. 16,5%, con una reducción absoluta de 3,1 pp y relativa del 20% (HR=0,80; IC95% 0,71 a 0,89; p<0,0001), mientras que los de hospitalización fueron del 12,8 vs. 15,6%, con una reducción absoluta de 2,8 pp y relativa del 21% (HR=0,79; IC95% 0,71 a 0,89; p<0,0001).
En cuanto a las variables secundarias, la tasa de mortalidad por cualquier causa fue del 17,0 vs. 19,8%, con una reducción absoluta de 2,8 pp y relativa del 16% (HR=0,84; IC95% 0,76 a 0,93; p=0,0005); en cuanto a la puntuación de la escala KCCQ y la incidencia de fibrilación auricular de nueva aparición, las diferencias entre los dos brazos de estudios no fueron estadísticamente significativas.
Desde el punto de vista de la seguridad, el complejo sacubitrilo/valsartán presenta un perfil toxicológico relativamente benigno, equiparable al del enalaprilo. Los eventos adversos más comunes que aparecieron durante el tratamiento fueron hipotensión (24% con sacubitrilo/valsartán vs. 19% con enalaprilo), insuficiencia renal (16 vs. 18%), hiperpotasemia (12 vs. 14%), angioedema confirmado (0,5 vs. 0,2%), hepatotoxicidad (3,3 vs. 4,4%), alteraciones cognitivas (2,0 vs. 2,0%), reacciones de hipersensibilidad (7,8 vs. 8,7%), cambios en la densidad/crecimiento óseo (2,0 vs. 1,9%) y lesiones gástricas (10,2 vs. 10,3%). La incidencia de eventos adversos intensos (severos) emergentes durante el tratamiento fue similar con ambos tratamientos, incluyendo la hipotensión (1,4 vs. 1,6%).
ASPECTOS INNOVADORES
El medicamento está formado por un complejo equimolecular de sacubitrilo y valsartán. El sacubitrilo es un profármaco, cuya forma activa (el metabolito LBQ657) inhibe la neprilisina, una endopeptidasa neutra (NEP) que participa en la degradación proteolítica de diversos péptidos natriuréticos, potenciando así los efectos de estos últimos. Por su parte, el valsartán es inhibidor del receptor de tipo 1 de la angiotensina II, por lo que previene los efectos de ésta a nivel cardiovascular y renal e inhibe la liberación de aldosterona dependiente de angiotensina II. El medicamento ha sido autorizado para el tratamiento de la insuficiencia cardiaca crónica sintomática con fracción de eyección reducida, en adultos.
Un amplio estudio clínico realizado con este nuevo fármaco (PARADIGMA; McMurray, 2014), ha demostrado que es capaz de reducir la mortalidad y morbilidad derivada de la insuficiencia cardíaca en torno a un 20%, lo que podría conducir a un replanteamiento de los esquemas terapéuticos actuales de la insuficiencia cardiaca. Este estudio incluyó a 8.442 pacientes de 47 países con insuficiencia cardíaca con grados II a IV, y fracciones de eyección ≤35%. Los participantes se distribuyeron de manera aleatoria en dos grupos, uno tratado con sacubitrilo/valsartán (200 mg/12 h) y el grupo control, con enalaprilo (10 mg/12 h), ambos por vía oral. Los pacientes de ambos grupos recibieron el resto de medicación que les había sido prescrita antes de su inclusión en el ensayo. La covariable primaria utilizada para determinar la eficacia clínica combinó dos criterios: muerte de origen cardiovascular y hospitalizaciones por insuficiencia cardíaca.
Transcurridos 27 meses desde el inicio del estudio, el 21,8% de los pacientes tratados con sacubitrilo/valsartán habían fallecido o precisado ingreso hospitalario por agravamiento de su insuficiencia cardíaca, frente al 26,5% en el grupo control, tratado con enalaprilo; esta diferencia – estadísticamente significativa – implica un descenso del riesgo relativo del 20% con respecto al enalaprilo, siendo la diferencia absoluta de 4,7 puntos porcentuales. Por otro lado, la tasa de mortalidad por cualquier causa fue del 17,0 vs. 19,8%, con una reducción absoluta de 2,8 puntos y relativa del 16%.
Desde el punto de vista de la seguridad, el complejo sacubitrilo/valsartán presenta un perfil toxicológico relativamente benigno, equiparable al del enalaprilo. Los eventos adversos más comunes son hipotensión, insuficiencia renal e hiperpotasemia.
Aparentemente, los datos clínicos son muy robustos; el estudio PARADIGMA-HF utiliza un comparador apropiado, los pacientes incluidos en él son representativos de los que se observan en la comunidad, con síntomas leves a moderados; los resultados son convincentes y reproducibles; y ha demostrado beneficios que son aplicables a los pacientes que actualmente están utilizando agentes activos sobre el sistema renina-angiotensina-aldosterona (ARA II e IECA). Por último, las sociedades de cardiología de Europa y de Estados Unidos consideran actualmente que sacubitril/valsartán es el enfoque preferido para la inhibición del sistema renina-angiotensina en pacientes con insuficiencia cardíaca crónica que actualmente están recibiendo un inhibidor de la ECA o ARA II (Packer, 2016).
Todo lo anterior sugiere que la introducción de sacubitril/valsartán en clínica supone una mejora sustancial dentro de un campo donde hay muy pocas novedades de interés farmacológico o terapéutico en las últimas décadas. La consistencia de los datos clínicos y la mejora de la supervivencia, aunque modesta, van acompañadas por un mecanismo farmacológico innovador, la inhibición de la neprilisina, capaz de impedir la degradación de los péptidos natriuréticos, potenciando así los efectos de estos últimos.
No obstante, precisamente el hecho de que sean diversos tejidos los que son capaces de expresar la neprilisina y, especialmente, por su efecto sobre la degradación del amiloide beta, su inhibición podría plantear la posibilidad de un efecto deletéreo sobre algunos de los mecanismos patológicos de la Enfermedad de Alzheimer. En este sentido, se podría considerar que el sacubitrilo, en tanto que inhibidor de la neprilisina, presenta un cierto riesgo potencial de reducir la degradación de amiloide beta, motivo por el cual esta cuestión se ha incluido dentro del plan de farmacovigilancia del medicamento. Por otro lado, se han detectado en estudios sobre animales (ratas) posible efectos adversos sobre el hueso y el riñón en especímenes jóvenes y, en particular, una reducción de la masa y de la elongación óseas; aunque no se ha detectado ningún efecto relevante en pacientes humanos adultos en esta materia y el medicamento solo está indicado en pacientes adultos, se ha sugerido (EMA, 2015) que no puede excluirse una interferencia, leve y transitoria en cualquier caso, sobre las primeras etapas de los procesos de consolidación ósea tras una fractura en adultos.
Aunque es evidente que quedan algunas cuestiones pendientes, parece que el complejo sacubitrilo/valsartán es una interesante innovación farmacológica y terapéutica en el campo de la insuficiencia cardiaca que, como decíamos anteriormente, no incorpora novedades verdaderamente relevantes con frecuencia.
|
VALORACIÓN |
|
SACUBITRILO/VALSARTAN
|
|
Grupo Terapéutico (ATC): C09DX. APARATO CARDIOVASCULAR. Agentes que actúan sobre el sistema renina-angiotensina: combinaciones de antagonistas de la angiotensina II. |
|
Indicaciones autorizadas: Tratamiento de la insuficiencia cardiaca crónica sintomática con fracción de eyección reducida, en adultos. |
|
INNOVACIÓN IMPORTANTE. Aportación sustancial a la terapéutica estándar |
BIBLIOGRAFÍA
Bibliografía
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Insuficiencia cardiaca. Panorama Actual Med. 2015; 39(387): 749-74.
- European Medicines Agency (EMA). Entresto®. European Public Assessment Report (EPAR). EMA/649986/2015; EMEA/H/C/004062. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/004062/WC500197538.pdf
- McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Solomon SD, Swedberg K, Zile MR; PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med. 2014; 371(11): 993-1004. doi: 10.1056/NEJMoa1409077.
- Packer M. Kicking the tyres of a heart failure trial: physician response to the approval of sacubitril/valsartan in the USA. Eur J Heart Fail. 2016 Aug 10. doi: 10.1002/ejhf.623. [Epub ahead of print]
- Schiering N, D’Arcy A, Villard F, Ramage P, Logel C, Cumin F, et al. Structure of neprilysin in complex with the active metabolite of sacubitril Scientific Reports. 2016; 6: 27909. doi:10.1038/srep27909
- Tamargo Menéndez J, Caballero Collado R, Delpón Mosquera E. Terapéutica de la insuficiencia cardiaca. En: Terapéutica farmacológica de los trastornos cardiovasculares, renales y hematológicos. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2012. pp. 283-300.
Artículos relacionados
-
27 Feb 2026Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
23 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





