Riociguat ADEMPAS® (Bayer)
 Nº384
Nº384
Resumen
El riociguat es un agente estimulante del enzima guanilato ciclasa soluble (GCs) en los vasos sanguíneos pulmonares, provocando una relajación de estos, lo que contribuye a disminuir la presión sanguínea en las arterias pulmonares. Ha sido autorizado como medicamento huérfano para el tratamiento de pacientes adultos en clase funcional II a III de la OMS con hipertensión pulmonar tromboembólica crónica inoperable, persistente o recurrente después de tratamiento quirúrgico, así como en monoterapia o en combinación con antagonistas de receptores de la endotelina, en el tratamiento de pacientes adultos con hipertensión arterial pulmonar de clase funcional II o III de la OMS; en ambos casos, para mejorar la capacidad para realizar ejercicio.
HIPERTENSIÓN PULMONAR
Los pulmones reciben flujo venoso sistémico desde la arteria pulmonar y sangre arterial a través de la circulación bronquial. La función de esta última es la irrigación sanguínea de las vías aéreas y el flujo a través de este sistema corresponde apenas al 1% del débito cardiaco. De la circulación pulmonar depende la oxigenación de la hemoglobina, la eliminación de partículas y bacterias y la eliminación de dióxido de carbono. La totalidad del débito cardíaco pasa a través de este sistema.
La circulación pulmonar se caracteriza por su gran capacitancia y baja presión y resistencia. En reposo, existen amplios territorios capilares sin flujo. El reclutamiento de territorios capilares sin perfusión previa (reclutamiento vascular) y la distensión capilar permiten incrementar el flujo pulmonar de forma muy ostensible sin que aumente la presión arterial pulmonar. En condiciones normales, la presión sistólica de la arteria pulmonar (a nivel del mar), está entre 18 y 25 mm Hg, mientras que la diastólica es de 8 a 10 mm de Hg. Por su parte, la presión venosa pulmonar media es de 6 a 10 mm Hg. Esto supone que la diferencia de presión arterio-venosa que mueve al débito cardíaco a través del lecho pulmonar es de 2 a 10 mm Hg.
Según la Sociedad Española de Cardiología, la hipertensión pulmonar se define como la existencia de una presión media en la arteria pulmonar (PAPm) mayor de 25 mm Hg en reposo o de más de 30 mm Hg durante el ejercicio. En realidad, la hipertensión pulmonar es más un estado fisiopatológico que una enfermedad, presentándose en las etapas avanzadas de gran parte de las enfermedades cardiacas y pulmonares. No obstante, existe también como una enfermedad primaria o idiopática, que se caracteriza por tener una presión de capilar pulmonar venoso normal y cuya causa desconocida.
Existen una serie de condiciones que se asocian a mayor incidencia de hipertensión pulmonar, con características histológicas, clínicas, hemodinámicas y pronóstico semejante a la hipertensión pulmonar primaria. Este cuadro clínico observa en algunas enfermedades del tejido conectivo, SIDA, cirrosis y con algunos anorexígenos de tipo anfetamínico y cocaína.
Los principales síntomas asociados a la hipertensión pulmonar son la disnea de esfuerzo y fatigabilidad ante cualquier ejercicio físico, dolor torácico, síncope e insuficiencia cardiaca derecha. La disnea y fatigabilidad fácil se deben a la dificultad para entregar oxígeno durante actividad física como resultado de la inhabilidad para aumentar el débito cardíaco cuando la demanda aumenta en pacientes con enfermedad pulmonar pura y además por aumento de la presión venosa pulmonar en los pacientes con HTP secundaria. Por su parte, el dolor torácico se produce por isquemia ventricular derecha, por flujo coronario reducido ante una masa ventricular aumentada, y presiones sistólicas y diastólicas elevadas. El síncope, que frecuentemente se relaciona al esfuerzo, se produce por un débito muy disminuido, con caída del flujo cerebral, y puede ser exacerbado por la vasodilatación periférica durante el esfuerzo físico. Por su parte, la insuficiencia cardiaca derecha se produce por claudicación del ventrículo derecho.
En la hipertensión pulmonar secundaria los síntomas suelen ser poco llamativos, generalmente eclipsados por los de la enfermedad de base. La presión en la arteria pulmonar (PAP) depende de la resistencia vascular pulmonar (RVP), el gasto cardíaco (GC) y la presión del flujo de salida (PFS) poscapilar. Cualquier aumento en algunos de estos términos conducirá a hipertensión pulmonar, en la medida que los mecanismos de distensión y reclutamiento vascular pulmonar no puedan responder de forma compensatoria.
El aumento de la RVP implica una pérdida de área conjunta del territorio vascular arterial, que puede originarse por una obstrucción vascular, como sucede con los trombos pulmonares, por un estrechamiento de la luz vascular, como ocurre con la vasoconstricción arterial o bien por un engrosamiento de la pared vascular que también estrecha la luz arterial. El incremento del GC sucede cuando existen grandes cortocircuitos vasculares de izquierda a derecha, secundarios a importantes defectos del tabique cardíaco u otras malformaciones congénitas cardiovasculares. No obstante, la causa más común de hipertensión pulmonar es el aumento de la PFS, generalmente secundario a disfunción ventricular izquierda, con menor frecuencia por enfermedad de la válvula mitral y sólo en muy raras ocasiones por afectación del territorio venoso pulmonar.
La hipertensión pulmonar primaria tiene una incidencia bajísima, de apenas 2/1.000.000 personas, es algo más común en mujeres (1,7:1) y se presenta más frecuentemente entre la tercera y cuarta década de la vida. Considerada en conjunto, la hipertensión arterial primaria y secundaria tiene una prevalencia de 15-52 casos por millón de habitantes.
En condiciones normales la célula del endotelio pulmonar mantiene a la célula muscular lisa en estado de relajación. En la hipertensión pulmonar primaria existe una anomalía del endotelio vascular pulmonar en que se produce un aumento de los mediadores endoteliales vasoconstrictores, así como de los mediadores plaquetarios vasoconstrictores y una disminución de la actividad de canales de potasio del músculo liso, con aumento del calcio intracelular y aumento del tono vascular. Esto impide o dificulta la obtención de un estado de relajación del músculo liso, y en un estado procoagulante que facilita el desarrollo de trombosis.
Algunos estudios sugieren que la hipertensión pulmonar primaria puede ocurrir en hasta el 33% de los pacientes con esclerodermia difusa. De hecho, la hipertensión pulmonar puede ser una causa principal de muerte en estos pacientes.
La hipertensión pulmonar secundaria a enfermedad respiratoria suele ser de grado moderado, con cifras PAP media inferiores a 40 mm Hg. El mecanismo causante de este tipo de hipertensión es la vasoconstricción hipóxica del lecho arterial pulmonar. Otros mecanismos, como la pérdida de vasos pulmonares en el enfisema, la compresión capilar en zonas hiperinsufladas o la hiperviscosidad causada por policitemia pueden agravarla.
La enfermedad cardiaca suele ser la causa más frecuente de hipertensión pulmonar, especialmente el fallo ventricular izquierdo secundario a hipertensión arterial sistémica o enfermedad coronaria; menos habitual es la enfermedad mitral o las tumoraciones cardíacas como el mixoma.
La obstrucción vascular pulmonar ha de ser extensa para que se desarrolle hipertensión pulmonar ya que, con pulmones sanos, el lecho vascular pulmonar puede obliterarse más del 50 % sin que se eleve de forma significativa la presión de la arteria pulmonar. En estos casos, la obstrucción vascular suele ser secundaria a tromboembolias pulmonares. En este sentido, la hipertensión pulmonar tromboembólica crónica constituye una rara forma de hipertensión pulmonar, que se caracteriza por una remodelación microvascular arterial pulmonar, una desregulación en la proliferación celular vascular y trombosis in situ, todo lo cual conduce a un incremento de la resistencia vascular pulmonar, un anormal tono vascular pulmonar, una disfunción o insuficiencia progresiva del ventrículo derecho y, en última instancia, la muerte del paciente. La hipertensión pulmonar tromboembólica crónica puede ocurrir en pacientes tras la producción de émbolos pulmonares o de trombosis venosa profunda e incluso en las áreas vasculares pulmonares no ocluidas se manifiesta la hipertensión pulmonar. Se estima que esta forma de hipertensión pulmonar se desarrolla en los siguientes dos años en el 1-4% de las personas que han experimentado una embolia pulmonar aguda (EMA, 2014).
La valoración funcional de la hipertensión pulmonar se realiza en cuatro niveles o clases, desarrolladas a partir de la clasificación de la New York Heart Association (NYHA), modificada por la Organización Mundial de la Salud (OMS). Esta valoración es considerada como altamente predictiva de la supervivencia de los pacientes.
- Clase I. Sin limitación de la actividad física. La actividad física no produce disnea ni fatiga, dolor torácico o síntomas de síncope.
- Clase II. Limitación ligera de la actividad física. El paciente es capaz de pasear cómodamente, pero una actividad física normal produce disnea, cansancio, dolor torácico o casi síncope.
- Clase III. Limitación marcada de la actividad física. El pacientes está cómodo en estado de reposo, pero cualquier actividad física, incluso menor de lo normal, produce disnea, cansancio, dolor torácico o casi síncope.
- Clase IV. Los pacientes son incapaces de realizar cualquier actividad sin presentar síntomas. Presentan síntomas de insuficiencia cardiaca derecha, pueden tener disnea y/o cansancio incluso en reposo, aumentan el malestar con cualquier actividad física.
Los niveles plasmáticos de la endotelina-1 (ET-1) se correlaciona con la hemodinámica y con la gravedad de las manifestaciones clínicas de la hipertensión arterial pulmonar y de la hipertensión pulmonar tromboembólica crónica (Hoeper, 2015). Las endotelinas (ET) son una familia de neurohormonas, de las que la endotelina-1 (ET-1) es la forma más comúnmente sintetizada en las células endoteliales de los vasos sanguíneos, estando dirigida la mayor parte hacia la zona abluminal del vaso, donde se une a receptores específicos de las células musculares lisas vasculares. La endotelina-1 desarrolla un potente efecto vasoconstrictor (de hecho, es considerada como el vasoconstrictor endógeno más potente, por encima de la noradrenalina y de la angiotensina II), como consecuencia de su acción agonista sobre dos tipos de receptores ETA y ETB, de los que los ETA son considerados como los principales responsables de la acción vasoconstrictora. Esta acción persiste incluso después de que la endotelina-1 se separa del receptor, probablemente como consecuencia de que las concentraciones intracelulares de calcio se mantienen elevadas.
Además del efecto vasoconstrictor agudo, la endotelina-1 es capaz de modular a largo plazo la función celular muscular lisa, a través la afectación de los mecanismos de transducción de las señales nucleares. De hecho, esta última acción moduladora es considerada como la responsable de su participación en la patogénesis de algunas alteraciones proliferativas de las capas internas vasculares, como es el caso de la aterosclerosis, así como en cambios adaptativos que conducen a una remodelación vascular y a una hipertrofia cardiaca. Ha podido constatarse que en hipertensión arterial pulmonar, así como en insuficiencia cardiaca, las concentraciones de endotelina-1 están directamente relacionadas con la gravedad y el pronóstico de estas enfermedades.
En definitiva, las acciones primarias ligadas a los efectos de la ET-1 sobre los receptores ETA son la vasoconstricción y la proliferación, mientras que sobre los ETB son vasodilatación, antiproliferación y eliminación de la ET-1. En los pacientes con hipertensión pulmonar, las concentraciones plasmáticas de ET-1 se encuentran multiplicadas por diez y ello se correlaciona con el aumento de la presión en la aurícula derecha y con la gravedad de la enfermedad; de hecho, las concentraciones de ET-1 están fuertemente incrementadas en el tejido pulmonar de estos pacientes, fundamentalmente en el endotelio de las arterias pulmonares.
Otro elemento fundamental en la regulación de la vasodilatación a nivel pulmonar es el óxido nítrico (NO), que se une a la guanilato ciclasa soluble (sGC), la cual es responsable de la síntesis del GMP cíclico (GMPc, guanosina monofosfato cíclica), el cual es un mediador vasoactivo que, a través de la vía catalizada por la proteína cinasa dependiente de GMPc y la fosfatasa de la miosina de cadena ligera, provoca la desfosforilación de la miosina – la proteína contráctil – en la musculatura vascular, dando lugar a una relajación de la pared vascular y, en consecuencia, produciendo vasodilatación. Asimismo, el óxido nítrico es capaz de acortar la duración del efecto vasoconstrictor de la endotelina-1, mediante la normalización del calcio intracelular. Sin embargo, el GMPc es metabolizado en el interior celular por un tipo específico de GMPc fosfodiesterasa, concretamente la de tipo 5 (PDE5), presente en las células musculares lisas presentes en numerosas estructuras orgánicas (vasos sanguíneos, tráquea, vísceras y plaquetas, así como en los cuerpos cavernosos del pene). En definitiva, la concentración de GMPc y, en consecuencia, el estado de relajación-contracción de las células musculares lisas vasculares (vasodilatación-vasoconstricción), depende del equilibrio entre la formación y destrucción de GMPc por la sGC y la PDE5, respectivamente.
En la hipertensión pulmonar, la disfunción endotelial provoca una reducción de la producción de óxido nítrico (NO) y, en consecuencia, una insuficiente estimulación de la vía NO-sCG-GMPc; de hecho, en los pacientes con hipertensión pulmonar se han encontrado niveles reducidos de NO endógeno.
El tratamiento de la hipertensión pulmonar no tiene carácter curativo por el momento. En general, estos pacientes deben evitar los ejercicios intensos y los desplazamientos a grandes alturas, aunque pueden permitirse los viajes en aviones convencionales presurizados. Se recomienda evitar aquellos fármacos que puedan agravar la hipertensión pulmonar, tales como los descongestionantes nasofaríngeos, los antihipertensivos que tengan actividad cardiodepresora – como los betabloqueantes – y los AINE. Asimismo, debe evitarse el embarazo debido a que las sobrecargas hemodinámicas del embarazo, sobre todo del posparto inmediato, son mal toleradas.
En el caso específico de la hipertensión pulmonar tromboembólica crónica, tampoco se dispone de ningún tratamiento curativo, más allá de la eliminación quirúrgica (endarterectomía pulmonar) del material obstructivo vascular; sin embargo muchos de los pacientes no son susceptibles de intervención quirúrgica y hasta un 15% de aquellos que sí lo son siguen presentando hipertensión pulmonar tras la intervención. Lamentablemente, para estos pacientes no hay ningún tratamiento farmacológico actualmente autorizado.
Los vasodilatadores se utilizan para obtener un descenso de la presión de la arteria pulmonar y un incremento del gasto cardiaco, sin hipotensión sistémica. La respuesta al tratamiento vasodilatador en un determinado paciente es impredecible, por lo que es obligado llevar a cabo el test agudo durante el cateterismo con agentes de corta duración, antes de iniciar el tratamiento a largo plazo. Los fármacos empleados para el test agudo son epoprostenol IV, adenosina IV y óxido nítrico (NO) inhalado.
El empleo de antagonistas del calcio (bloqueantes de los canales lentos del calcio) sólo está recomendado en pacientes que responden al test agudo, pero no han demostrado su utilidad en el resto de pacientes. Los más utilizados son el nifedipino y el diltiazem, que producen una mejoría sostenida en un 25 a un 30% de los pacientes, siendo en general las dosis requeridas para obtener efectos beneficiosos más altas que las utilizadas en la hipertensión arterial o en la enfermedad coronaria. El uso de verapamilo no está recomendado, debido en parte a sus efectos inotrópicos negativos.
La perfusión intravenosa de epoprostenol (prostaciclina, PGI2) permite mantener la mejora en la hemodinámica y aumenta la tolerancia al ejercicio, alargando la supervivencia en los cuadros de hipertensión pulmonar grave (clase funcional III-IV) de los pacientes que no han respondido al test vasodilatador agudo. Tiene la dificultad de precisar una administración en infusión intravenosa continua, debido a su corta vida media (3-5 min) y a que es inactivo por vía oral. El desarrollo de tolerancia es frecuente, por lo que las dosis deben ir incrementándose de forma escalonada durante el primer año para evitar su desarrollo.
Hay evidencias clínicas de que la anticoagulación mejora la supervivencia en todos los grupos de pacientes con hipertensión pulmonar, especialmente en aquellos que no responden al test vasodilatador agudo de los pacientes con hipertensión pulmonar primaria. En tales casos se recomienda anticoagulación oral con derivados cumarínicos, hasta mantener un índice normalizado de actividad de protombina (INR) entre 1,5 y 21.
Bosentán, ambrisentán y sitaxentán2 son antagonistas selectivos de los receptores ETA (ARE) y ETB (BRE) de la endotelina. Son capaces de reducir los síntomas asociados a la hipertensión pulmonar, conduciendo a un aumento significativo en el índice cardiaco asociado a una reducción significativa en la presión arterial pulmonar, resistencia vascular pulmonar y presión auricular derecha.
Aunque se ha postulado que la mayor especificidad hacia los receptores ETA que hacia los ETB de sitaxentán (6.500) frente a la de bosentán (100), podría suponer una cierta ventaja al bloquear los efectos vasoconstrictores de la endotelina 1 sobre los receptores ETA, manteniendo los efectos vasodilatadores y de aclaramiento correspondientes a la activación de los receptores ETB, no se ha demostrado por el momento que esto tenga relevancia clínica.
Los inhibidores de la fosfodiesterasa 5 (PDE5) se han convertido en una interesante opción en el tratamiento de la hipertensión pulmonar. El primero en ser autorizado para esta indicación fue el sildenafilo, que ha demostrado mejorar los síntomas, la tolerancia al ejercicio y la calidad de vida de los pacientes. El fármaco provoca un incremento de los niveles de GMPc en las células musculares lisas vasculares y, en consecuencia, da lugar a una relajación de la musculatura lisa vascular pulmonar, reduciendo la presión que el flujo sanguíneo ejerce sobre las paredes de los vasos pulmonares. Asimismo, previene la formación de obstrucciones de origen plaquetario y relaja la musculatura lisa vascular periférica, todo ello en presencia de óxido nítrico. Tras el sildenafilo, fue comercializado en esta indicación el tadalafilo, que presenta similares características farmacológicas y la presunta la ventaja de requerir una única administración oral diaria, frente a las tres del sildenafilo, algo que siempre es valorable para la comodidad y cumplimiento terapéutico de los pacientes (Cuéllar, 2011).
Un meta-análisis ha analizado (Galiè, 2009) el impacto de los prostanoides (epoprostenol), antagonistas de endotelina (bosentán, etc.) y inhibidores de la PDE5 (sildenafilo) sobre la evolución de la hipertensión pulmonar, observando una reducción global del 43% en el riesgo de muerte en estos pacientes, por el tratamiento farmacológico. En particular, el sildenafilo fue asociado a una reducción del 61% vs. placebo.
Adicionalmente a los anteriores medicamentos, los diuréticos pueden reducir el volumen intravascular y la congestión hepática; por ello pueden ser útiles para reducir la precarga en pacientes con fallo derecho, particularmente cuando se producen congestión hepática y ascitis, no recomendándose su uso cuando no existe insuficiencia cardíaca derecha. Por su parte, el uso de cardiotónicos en la hipertensión pulmonar primaria y el cor pulmonale cada vez es más infrecuente, debido a que hay pocas evidencias que justifiquen su utilización en estos casos.
En los cuadros resistentes al tratamiento, la cirugía es una alternativa terapéutica a considerar. El trasplante pulmonar uni o bilateral, así como el combinado de corazón y pulmón, presentan rangos de supervivencia similares (65-70% al año). La formación de un shunt derecha-izquierda mediante la realización de una septostomía auricular disminuye las presiones de llenado del corazón derecho en pacientes con insuficiencia cardíaca derecha grave que no responden al tratamiento médico.
Actualmente el pronóstico de la hipertensión arterial pulmonar no tratada es malo. La media de supervivencia tras el diagnóstico es de 2,8 años, aunque hay pacientes que pueden sobrevivir mucho más tiempo, particularmente con el uso de los nuevos fármacos. La anticoagulación casi duplica el rango de supervivencia, y los pacientes que responden al tratamiento con antagonistas del calcio presentan una supervivencia del 95% a los 5 años. El epoprostenol aumenta la supervivencia de los pacientes que no responden a los vasodilatadores orales y se asocia a una supervivencia a los 5 años, similar a la del trasplante de pulmón o incluso mejor.
ACCIÓN Y MECANISMO
El riociguat es un agente estimulante del enzima guanilato ciclasa soluble (GCs) en los vasos sanguíneos pulmonares, provocando una relajación de estos, lo que contribuye a disminuir la presión sanguínea en las arterias pulmonares. Ha sido autorizado para el tratamiento de pacientes adultos en clase funcional II a III de la OMS con hipertensión pulmonar tromboembólica crónica inoperable, persistente o recurrente después de tratamiento quirúrgico, así como en monoterapia o en combinación con antagonistas de receptores de la endotelina, en el tratamiento de pacientes adultos con hipertensión arterial pulmonar de clase funcional II o III de la OMS; en ambos casos, para mejorar la capacidad para realizar ejercicio.
Junto con la endotelina-1 (ET-1), el óxido nítrico (NO) es fundamental en la regulación de la vasodilatación a nivel pulmonar; se une a la guanilato ciclasa soluble (sGC), la cual es responsable de la síntesis del GMP cíclico (GMPc), que actúa como mediador vasoactivo a través de la vía catalizada por la proteína cinasa dependiente de GMPc y la fosfatasa de la miosina de cadena ligera, provocando la desfosforilación de la miosina – la proteína contráctil – en la musculatura vascular, dando lugar a una relajación de la pared vascular y, en consecuencia, produciendo vasodilatación. Asimismo, el óxido nítrico (NO) es capaz de acortar la duración del efecto vasoconstrictor de la endotelina-1, mediante la normalización del calcio intracelular. En la hipertensión pulmonar, la disfunción endotelial provoca una reducción de la producción de óxido nítrico (NO) y, en consecuencia, una insuficiente estimulación de la vía NO-sCG-GMPc; de hecho, en los pacientes con hipertensión pulmonar se han encontrado niveles reducidos de NO endógeno. Sin embargo, el efecto estimulante del riociguat sobre la guanilato ciclasa soluble es independiente de la concentración de óxido nítrico (NO), aunque actúa de forma sinérgica con éste.
ASPECTOS MOLECULARES
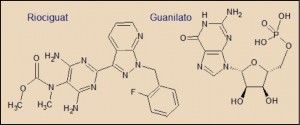
Químicamente, el riociguat procede de una serie de benzimidazoles inicialmente descritos en la década los 70 del pasado siglo; a partir de estas series se desarrollaron derivados indazólicos, mucho más potentes y selectivos que los primeros como estimulantes de la guanilato ciclasa soluble (sGC).
La estructura química del riociguat recuerda, a través de su núcleo indazólico, al núcleo purínico del guanilato; sin embargo, no se conoce con detalle el mecanismo a través del cual el riociguat estimula la actividad de la guanilato ciclasa soluble (sGC).
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del riociguat han sido adecuadamente contrastadas en las indicaciones autorizadas mediante dos ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multicéntricos, doblemente ciegos y controlados con placebo. En ambos se ajustó la dosis oral de riociguat de forma progresiva y personalizada a lo largo de 8 semanas, comenzando por 1 mg/8 h, con ajustes de 0,5 mg por dosis cada dos semanas, en función de la presión arterial sistólica de los pacientes, hasta un máximo de 2,5 mg/8 h.
La variable primaria de eficacia utilizada en ambos estudios fue la variación experimentada con el test de la marcha de 6 minutos (6MWT, 6 minutes walking test), desde el inicio del tratamiento (incluyendo la fase de ajuste posológico) hasta el final del mismo. Dicho test 6MWT es una prueba funcional cardiorrespiratoria ampliamente utilizada en clínica para conocer la evolución y calidad de vida en personas con diferentes tipos de enfermedades cardiorrespiratorias. Se trata de una prueba bien tolerada, que refleja de forma fiable la capacidad de cada persona para desarrollar las actividades cotidianas; en concreto, mide la distancia máxima que puede recorrer un individuo durante 6 minutos en una superficie llana.
Como variables secundarias de eficacia se han utilizado las variaciones experimentadas en la resistencia vascular pulmonar y en la concentración de la fracción N-terminal del péptido natriurético cerebral o de tipo B (NT-proBNP). Esta última es una neurohormona cardíaca secretada en los ventrículos y liberada en respuesta a la expansión de volumen, sobrecarga de presión e isquemia. Se sintetiza como prepropéptido de 134 aminoácidos, que se rompe en proBNP (de 108 aminoácidos); tras su liberación se divide en el fragmento N-terminal (NT-proBNP) y BNP (molécula biológicamente activa). La determinación de los niveles séricos de NT-proBNP es utilizada con fines diagnósticos en pacientes con insuficiencia cardíaca; en este sentido, en España se ha establecido (Verdú, 2012), como punto de corte estadístico entre pacientes con y sin insuficiencia cardiaca el nivel de 280 pg/ml.
El primero de estos estudios clínicos (Ghofrani, 2013a; CHEST-1) incluyó a 261 pacientes con hipertensión pulmonar tromboembólica crónica inoperable o hipertensión pulmonar recurrente o persistente tras una endarterectomía pulmonar, con valores basales de 6MWT entre 150 y 450 m y de resistencia vascular pulmonar mayor de 300 din.s.cm-5, medida al menos 90 días después del comienzo del tratamiento anticoagulante y una presión arterial pulmonar mayor de 25 mmHg.
La duración del tratamiento fue de 16 semanas y las principales características demográficas y antropométricas fueron: 32/39% (riociguat/placebo) varones, 69/74% blancos-caucásicos, mediana de 62/61 años (43/41% mayores de 64 años), mediana de 74/77 kg, mediana de índice de peso corporal (IMC) de 26,6/26,5 kg/m2, 32/28% de clase funcional II de la OMS y 62/68% de la III, con un 6MWD <380 del 63/57% y mediana de 711/691 din.s.cm-5 de resistencia vascular pulmonar; un 70/77% eran pacientes inoperables quirúrgicamente.
Los resultados mostraron una variación de la 6MWD de +38,9 m con riociguat y -5,5 con placebo, lo que implica una diferencia de 45,7 m (IC95% 24,7 a 66,6; p<0,0001). Asimismo, la variación en la resistencia vascular pulmonar fue de -226 din.s.cm-5 con riociguat vs. +23 con placebo, lo cual supone una diferencia de -246 din.s.cm-5 (IC95% -303 a -190; p<0,0001); por lo que respecta a la variación de la concentración de NT-proBNP fue de -291 pg/ml vs. +76, con una diferencia entre riociguat y placebo de -444 pg/ml 5 (IC95% -843 a -45; p=0,0293).
El segundo estudio (Ghofrani, 2013b; PATENT-1) incluyó a 443 pacientes con hipertensión arterial pulmonar sintomática no tratados previamente o tratados con antagonistas del receptor de endotelina-1 o análogos de prostaciclina, con valores basales de 6MWT entre 150 y 450 m y de resistencia vascular pulmonar mayor de 300 din.s.cm-5 y una presión arterial pulmonar mayor de 25 mmHg. Se ajustó la dosis oral de riociguat de forma progresiva y personalizada a lo largo de 8 semanas, comenzando por 1 mg/8 h, con ajustes de 0,5 mg por dosis cada dos semanas, en función de la presión arterial sistólica de los pacientes, hasta un máximo de 1,53 o de 2,5 mg/8 h.
La duración del tratamiento fue de 12 semanas y las principales características demográficas y antropométricas fueron: 20-22% varones, 52-63 blancos-caucásicos, mediana de 49-53 años, 30-43% de clase funcional II de la OMS y 46-62% de la III, con un 6MWD <380 m el 42-55% y mediana de 791-848 din.s.cm-5 de resistencia vascular pulmonar.
Los resultados mostraron una variación de la 6MWD de +29,6 m con riociguat (2,5 mg) y -5,6 con placebo, lo que implica una diferencia de 35,6 m (IC95% 20,1 a 51,5; p<0,0001). Asimismo, la variación en la resistencia vascular pulmonar fue de -223 din.s.cm-5 con riociguat vs. -9 con placebo, lo cual supone una diferencia de -226 din.s.cm-5 (IC95% -281 a -170; p<0,0001); por lo que respecta a la variación de la concentración de NT-proBNP fue de -198 pg/ml vs. +232, con una diferencia entre riociguat y placebo de -432 pg/ml (IC95% -782 a -82; p<0,0001).
|
Tabla 1. Estudios clínicos de fase III con riociguat
|
||
|
Comparador |
Placebo |
Placebo |
|
Indicación estudiada |
Hipertensión pulmonar tromboembólica crónica |
Hipertensión arterial pulmonar |
|
Pacientes aleatorizados |
261 |
443 |
|
Duración estudio |
16 semanas |
12 semanas |
|
Tipo de estudio |
Doble ciego |
Doble ciego |
|
Edad (% pacientes ≥65 años) |
61-62 años (41-43%) |
49-53 años |
|
Sexo: varones |
32-39% |
20-22% |
|
Raza blanca/caucásica |
69-74% |
52-63% |
|
% pac. Clase funcional III OMS |
62-68% |
46-62% |
|
% pac 6MWD <380 m |
57-63% |
42-55% |
|
Resistencia vascular pulmonar |
691-711 din.s.cm-5 |
791-848 din.s.cm-5 |
|
Variación de 6MWD |
Riociguat: +38,9 m Placebo: -5,5 m Diferencia: +45,7 m |
Riociguat: +29,6 m Placebo: -5,6 m Diferencia: +35,6 m |
|
Variación de la Resistencia Vascular Pulmonar |
Riociguat: -226 din.s.cm-5 Placebo: +23 din.s.cm-5 Diferencia: -246 din.s.cm-5 |
Riociguat: -223 din.s.cm-5 Placebo: -9 din.s.cm-5 Diferencia: -226 din.s.cm-5 |
|
Variación de la concentración de NT-proBNP |
Riociguat: -291 pg/ml Placebo: +76 pg/ml Diferencia: --444 pg/ml |
Riociguat: -198 pg/ml Placebo: +232 pg/ml Diferencia: --432 pg/ml |
|
Referencias |
Ghofrani, 2013a; CHEST-1 |
Ghofrani, 2013b; PATENT-1 |
Todas lasdiferencias entre los datos correspondientes a riociguat y placebo fueron estadísticamente significativas.
Asimismo, se ha estudiado (Marra, 2015) el efecto a largo plazo del tratamiento con riociguat sobre el tamaño y la función de la parte derecha del corazón (ventrículo y aurícula) en pacientes con hipertensión pulmonar tromboembólica crónica y con hipertensión arterial pulmonar. Para ello, se han agrupado los pacientes incluidos en los ensayos clínicos anteriores y en otros previos de fase II, que continuaron el tratamiento con riociguat durante 3-12 meses, incluyendo un total de 39 pacientes, de los que 22 (56%) no habían recibido previamente al riociguat ningún tratamiento farmacológico específico para la hipertensión pulmonar.
Los resultados mostraron una reducción del área ventricular derecha de 2,1 cm2 (-7,4%) a los tres meses, 4,2 (-16,1%) a los seis meses y 5,9 cm2 (-22,1%) a los doce; también se apreció una reducción media del área auricular derecha de 3,5 cm2 (-16,8%) a los doce meses. Asimismo, la TAPSE4 mejoró significativamente a los seis meses (+2 mm; +12%) y a los 12 meses (+3,6 mm; +21%).
Desde el punto de vista de la seguridad, el riociguat presenta un perfil toxicológico caracterizados por frecuentes eventos adversos aunque generalmente leves o moderados, transitorios y tratables fácilmente. Los más frecuentemente descritos son la cefalea (19% vs. 12% con placebo)5, los mareos (13/12%), la dispepsia (14/7,3%), el edema periférico (4,1%/5,6%), las náuseas (7,8/6,1%), la hipotensión (7,8/0,9%), los vómitos (4,1/1,9%) y la diarrea (3,9/5,1%).
La incidencia global de eventos adversos graves fue del 15,1/17,3% (riociguat/placebo), siendo los más comunes la insuficiencia cardiaca derecha (2,2/1,9%), el síncope (1,4/3,7%) y la hemoptisis (1,0/0,0%).
ASPECTOS INNOVADORES
El riociguat es un agente estimulante del enzima guanilato ciclasa soluble (GCs) en los vasos sanguíneos pulmonares, provocando una relajación de estos, lo que contribuye a disminuir la presión sanguínea en las arterias pulmonares. Ha sido autorizado como medicamento huérfano para el tratamiento de pacientes adultos en clase funcional II a III de la OMS con hipertensión pulmonar tromboembólica crónica inoperable, persistente o recurrente después de tratamiento quirúrgico, así como en monoterapia o en combinación con antagonistas de receptores de la endotelina, en el tratamiento de pacientes adultos con hipertensión arterial pulmonar de clase funcional II o III de la OMS; en ambos casos, para mejorar la capacidad para realizar ejercicio.
Los datos clínicos disponibles indican efectos significativos en la variable clínica principal (la distancia caminada durante 6 minutos: 6MWD), particularmente en la hipertensión pulmonar tromboembólica crónica (+46 m de media, lo que supone una mejora en torno al 12-15%); en los pacientes con hipertensión arterial pulmonar, pretratados o no, la mejora es más moderada (+30 metros, en término medio). La representatividad clínica de este favorable efecto sobre la variable principal se ha visto reforzada por mejoras significativas en la resistencia vascular pulmonar y en la concentración de la fracción N-terminal del péptido natriurético cerebral o de tipo B (NT-proBNP); asimismo, se ha observado en un pequeño grupo de pacientes tratados durante un año una reducción del área cardiaca derecha (-22% del ventrículo y -17% de la aurícula) y mejora del estatus cardiaco determinado mediante ecocardiografía (TAPSE). Los resultados obtenidos en hipertensión arterial pulmonar son similares en pacientes no tratados anteriormente (naïve) como en combinación con antagonistas del receptor de endotelina (ARE) o con derivados de prostaciclina.
Estos resultados con el test 6MWD están en el mismo nivel de magnitud que los encontrados con tadalafilo y otros fármacos utilizados en hipertensión pulmonar (Galiè, 2009).
El perfil toxicológico del riociguat está en línea con otros agentes activos sobre GMPc y son debidos fundamentalmente a su efecto vasodilatador (cefalea, mareos, edema periférico, etc.); aunque frecuentes, no parecen ser especialmente relevantes. No obstante, un 1% de los pacientes presente crisis de hemoptisis, que reflejan hemorragias pulmonares. Asimismo, es preciso tener en cuenta que el fármaco no debe ser usado en combinación con inhibidores de la fosfodiesterasa 5 (IPD5), ya que podrían incrementar notablemente la toxicidad y, por otro lado, el riociguat muestra un perfil complejo de interacciones potenciales, especialmente con fármacos metabolizados por las isoenzimas CYP1A1 y CYP3A4 del citocromo P450, o implicadas a través de la glucoproteína P.
Se trata del primer medicamento en recibir la autorización para el tratamiento de la hipertensión pulmonar tromboembólica crónica inoperable, persistente o recurrente después de tratamiento quirúrgico. Además, también es el cabeza de serie de un nuevo grupo de medicamentos que inaugura un mecanismo de acción, la estimulación del enzima guanilato ciclasa soluble. No obstante, en puridad, este mecanismo no puede ser considerado como enteramente innovador, dado que su efecto se traduce en un incremento de los niveles intracelulares de GMPc, exactamente igual que hacen los inhibidores de la fosfodiesterasa 5 (IPD5, como el sildenafilo o el tadalafilo), aunque el riociguat lo hace incrementando su síntesis y estos últimos lo consiguen impidiendo su destrucción.
En definitiva, el riociguat aparece como una opción en monoterapia a considerar en pacientes con hipertensión pulmonar no tratados previamente en clase funcional II a III de la OMS o en combinación con antagonistas de receptores de la endotelina (bosentán, etc.) o prostanoides inhalados en pacientes sintomáticos con hipertensión arterial pulmonar en clase funcional III o IV (Makowski, 2015). Por su parte, según el Informe de Posicionamiento Terapéutico (AEMPS, 2015), el riociguat ha mostrado superioridad frente a placebo en la capacidad de ejercicio, en la mejora de la clase funcional y en los parámetros hemodinámicos, aunque existe cierta incertidumbre sobre su eficacia en los pacientes en clase funcional II y en los pacientes con hipertensión pulmonar tromboembólica crónica persistente o recurrente después del tratamiento quirúrgico.
|
VALORACIÓN |
|
|
RIOCIGUAT
|
|
|
Grupo Terapéutico (ATC): C02KX. APARATO CARDIOVASCULAR. Antihipertensivos: antihipertensivos para la hipertensión arterial pulmonar. |
|
|
Indicaciones autorizadas: Tratamiento de pacientes adultos en clase funcional II a III de la OMS con hipertensión pulmonar tromboembólica crónica inoperable, persistente o recurrente después de tratamiento quirúrgico, para mejorar la capacidad para realizar ejercicio. También está indicado, en monoterapia o en combinación con antagonistas de receptores de la endotelina, en el tratamiento de pacientes adultos con hipertensión arterial pulmonar de clase funcional II o III de la OMS para mejorar la capacidad para realizar ejercicio. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales |
♣ ♣ |
|
Novedad clínica: Utilidad en cuadros refractarios a los tratamientos actuales o en pacientes en los que el tratamiento estándar está contraindicado. |
⇑ |
|
Novedad molecular: Mecanismo de acción parcialmente diferente (con “dianas terapéuticas” parcialmente coincidentes con otros fármacos). |
⇑ |
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de riociguat (Adempas®) en el tratamiento de la hipertensión pulmonar tromboembólica crónica. Fecha de publicación: 10 de junio de 2015. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-riociguat-Adempas-GCPT.pdf
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Tadalafilo (Adcirca®) en hipertensión pulmonar. Panorama Actual Med. 2011; 35(340): 53-61.
- European Medicines Agency (EMA). Adempas®. European Public Assessment Report (EPAR). EMA/51814/2014; EMEA/H/C/002737. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002737/WC500165036.pdf
- Galiè N, Manes A, Negro L, Palazzini M, Bacchi-Reggiani ML, Branzi A. A meta-analysis of randomized controlled trials in pulmonary arterial hypertension. Eur Heart J. 2009; 30(4): 394-403.
- Ghofrani HA, D’Armini AM, Grimminger F, Hoeper MM, Jansa P, Kim NH, Mayer E, Simonneau G, Wilkins MR, Fritsch A, Neuser D, Weimann G, Wang C; CHEST-1 Study Group. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. N Engl J Med. 2013; 369(4): 319-29. doi: 10.1056/NEJMoa1209657.
- Ghofrani HA, Galiè N, Grimminger F, Grünig E, Humbert M, Jing ZC, Keogh AM, Langleben D, Kilama MO, Fritsch A, Neuser D, Rubin LJ; PATENT-1 Study Group. Riociguat for the treatment of pulmonary arterial hypertension. N Engl J Med. 2013; 369(4): 330-40. doi: 10.1056/NEJMoa1209655.
- Hoeper MM. Pharmacological therapy for patients with chronic thromboembolic pulmonary hypertension. Eur Respir Rev. 2015; 24(136): 272-82.
- Makowski CT, Rissmiller RW, Bullington WM. Riociguat: a novel new drug for treatment of pulmonary hypertension. Pharmacotherapy. 2015; 35(5): 502-19. doi: 10.1002/phar.1592.
- Marra AM, Egenlauf B, Ehlken N, Fischer C, Eichstaedt C, Nagel C, et al. Change of right heart size and function by long-term therapy with riociguat in patients with pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension. Int J Cardiol. 2015; 195: 19-26. doi: 10.1016/j.ijcard.2015.05.105.
- Verdú, JM, Comín-Colet J, Domingo M, Lupón J, Gómez M, Molina M, et al. Punto de corte óptimo de NT-proBNP para el diagnóstico de insuficiencia cardiaca mediante un test de determinación rápida en atención primaria. Rev Esp Cardiol. 2012; 65: 613-9. DOI: 10.1016/j.recesp.2012.01.019
1 Hay autores que recomiendan un INR de 2-3 en este tipo de pacientes.
2 El día 10 de diciembre de 2010 fue suspendida la comercialización de sitaxentán. Nota de la Agencia Española de Medicamentos y Productos Sanitarios, ref. MUH (FV)/15/2010.
3 Aunque no se utilizó este grupo a efectos de validación estadística.
4 La TAPSE (Tricuspid Annular Plane Systolic Excursion) o desplazamiento sistólico del anillo tricúspide, es una determinación ecocardiográfica de la fracción de eyección del ventrículo derecho.
5 Los porcentajes reseñados se refieren a la tasa de eventos adversos relacionados directamente con el tratamiento.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





