Reslizumab ▼ Cinqaero® (Lilly) en asma eosinofílica
 Nº406
Nº406
Resumen
El reslizumab es un anticuerpo monoclonal que se une selectivamente y con elevada afinidad a la interleucina 5 (IL-5), impidiendo su acoplamiento con el receptor y con ello las acciones de la IL-5 sobre el ciclo biológico de los leucocitos eosinófilos. Ha sido autorizado para el tratamiento adicional en pacientes adultos con asma eosinofílica grave insuficientemente controlada con el tratamiento con corticosteroides inhalados en dosis altas más otro medicamento para el tratamiento de mantenimiento. Los datos procedentes de dos ensayos clínicos controlados con placebo muestran que el empleo de reslizumab es capaz de reducir en torno al 54% la tasa de exacerbaciones en pacientes con cuadros graves de asma eosinofílica mal controlados con altas dosis de corticosteroides inhalados o incluso con sistémicos. Desde el punto de vista de la seguridad, el reslizumab presenta un perfil toxicológico relativamente benigno, con una incidencia de eventos adversos similar a la del placebo, fundamentalmente de carácter leve o moderador, y transitorios. Aunque las comparaciones indirectas solo pueden tener un carácter cualitativo, todo hace pensar que no hay diferencias sustanciales entre mepolizumab y reslizumab, ni tan siquiera en la frecuencia de administración (una vez cada cuatro semanas), aunque el segundo requiere la perfusión IV mientras que el primero es fácilmente administrado por vía subcutánea. En ambos casos, los potenciales respondedores al tratamiento son aquellos pacientes con persistente eosinofilia sistémica y en epitelio respiratorio, usuarios de altas dosis de corticosteroides en inhalación y sistémicos, con un inadecuado control de los síntomas, con un alto impacto sobre su calidad de vida y con varias exacerbaciones asmáticas al año que obligan a la hospitalización o la consulta de urgencia.
ASPECTOS FISIOPATOLÓGICOS
El asma es un síndrome que comparten manifestaciones clínicas similares en apariencia pero de causas diferenciadas. Ello supone que sea complejo el alcanzar una definición precisa y exacta de la enfermedad, existiendo varias definiciones para la misma. Se define como una enfermedad inflamatoria crónica de las vías respiratorias, en cuya patogenia intervienen diversas células y mediadores de la inflamación, condicionada en parte por factores genéticos y que cursa con hiperrespuesta bronquial y una obstrucción variable al flujo aéreo, total o parcialmente reversible, ya sea por la acción medicamentosa o espontáneamente (Cuéllar, 2016).
El asma es un problema de salud de elevada prevalencia y, aunque las formas graves de la enfermedad solo suponen el 10% de todos los casos, en el resto hay importantes implicaciones en la esperanza y calidad de vida de las personas que la padecen, generando un importante consumo de recursos sanitarios y notables costes sociales. Según la Organización Mundial de la Salud (OMS), el asma es la séptima enfermedad más prevalente en el mundo, con cerca de 235 millones de afectados. La cifra de afectados en Europa es de alrededor de 29 millones. Además, supone la quinta causa de muerte en los países desarrollados. En el territorio español, la prevalencia de síntomas asmáticos en niños se ha mantenido constante en los niños de 13-14 años, mientras que ha sufrido un aumento significativo en el grupo de 6-7 años. En los adultos la prevalencia es inferior a la de los países anglosajones y centroeuropeos. El Estudio Europeo de Salud Respiratoria constató en nuestro país unas tasas que van desde 4,7% en Albacete hasta el 1% en Huelva. Y lo que es más preocupante: un 52% de las personas con asma no habían sido diagnosticadas y hasta un 26% de éstas, a pesar de padecer síntomas frecuentes, no seguía ningún tratamiento.
El asma en adultos se clasifica, por el grado de gravedad, en cuatro categorías: intermitente, persistente leve, persistente moderada y persistente grave. En los niños se definen dos patrones principales: asma episódica y asma persistente. El asma episódica puede ser ocasional o frecuente, dependiendo del número de crisis que presente. El asma persistente en el niño no puede considerarse como leve, sino que al menos es moderada o grave. Existe un fenotipo mixto EPOC-asma, caracterizado por la presencia de una obstrucción no completamente reversible al flujo aéreo, acompañada de síntomas o signos de una reversibilidad aumentada de la obstrucción.
Los síntomas y signos clínicos característicos del asma son:
- Obstrucción bronquial reversible, con manifestación clínica como episodios de disnea y tos. El término reversible indica que responde bien a la medicación broncodilatadora. Se considera aceptable una respuesta de FEV11 superior al 15%.
- Inflamación: Las alteraciones histológicas consisten básicamente en: a) infiltración de la mucosa por eosinófilos activados que segregan diversos productos citotóxicos (anión superóxido, proteína básica mayor, proteína catiónica, peroxidasa y neurotoxina), linfocitos T-helper (CD4+) y mastocitos; b) descamación de células epiteliales; y c) engrosamiento de la membrana basal por incremento de los depósitos de colágeno de los tipos I, III y V, junto con fibronectina.
- Hiperreactividad bronquial: la descamación y el daño del epitelio de las vías aéreas permite la exposición directa a irritantes de las terminaciones nerviosas subepiteliales, lo cual provoca reflejos axónicos locales y reflejos vagales que pueden producir broncoconstricción, hipersecreción de moco, tos y vasodilatación con extravasación, lo que ocasiona edema e infiltración de células inflamatorias. La hiperreactividad bronquial se ha atribuido a distintas causas (entre otras, a anormalidades de la inervación adrenérgica, a alteraciones en las catecolaminas circulantes, a defectos de los receptores β-adrenérgicos y/o al aumento del tono vagal).
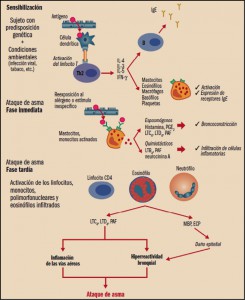
Figura 1. Eventos celulares en el asma. ECP: proteína catiónica del eosinófilo;
IFN-γ: interferón γ; IgE: inmunoglobulina E; IL-2, 3, 4: interleucina 2, 3, 4;
LTB4, LTC4, LTD4: leucotrienos B4, C4, D4; MBP: proteína básica mayor;
PAF: factor activador de plaquetas; PGE2: prostaglandina E2; Th2: linfocitos T helper 2.
En un ataque de asma se produce un desequilibrio en la relación ventilación-perfusión con un aumento del gradiente alveolo-arterial de oxígeno, lo cual implica la disminución de la presión parcial de O2 en sangre. Además, este desacoplamiento ventilación-perfusión implica un aumento del espacio muerto fisiológico y, si la ventilación alveolar no aumenta lo suficiente, se produce un aumento de la presión parcial de dióxido de carbono (PCO2). En suma, la hipoxemia que acompaña el ataque de asma suele ser moderada y responde favorablemente al aumento de la concentración de oxígeno inspirado. La evolución de la PCO2 depende de la gravedad de la obstrucción al flujo aéreo y la aparición de fatiga muscular respiratoria.
La obstrucción bronquial que se produce en un ataque agudo de asma exige un aumento significativo del trabajo respiratorio como consecuencia del incremento en la resistencia pulmonar como en la carga elástica pulmonar, así como una menor eficiencia en la contracción del diafragma debido a la pérdida parcial de su curvatura por la hiperinsuflación pulmonar.
En realidad, el asma no es una enfermedad única, sino más bien un síndrome con una amplia heterogeneidad de fenotipos y endotipos, ligados a diversos mecanismos celulares y biomoleculares. El asma ha pasado de ser considerada una reacción de hipersensibilidad de tipo I, en la que lo importante era el episodio de broncoespasmo desencadenado por la liberación de mediadores tras la desgranulación del mastocito al producirse la reacción alérgeno-inmunoglobulina E (IgE) específica, a ser interpretada en la actualidad como un proceso inflamatorio crónico de las vías aéreas puesto en marcha por una serie de factores desencadenantes, entre los que cabe destacar determinadas actividades profesionales, ejercicio físico, infecciones, fármacos (betabloqueantes y, especialmente, AINE, en particular el ácido acetilsalicílico), reflujo gastroesofágico y ciertos factores emocionales. Sin embargo, con mucho, el factor más frecuentemente desencadenante del asma es la alergia.
Los alérgenos involucrados son proteínas de los reinos animal y vegetal. En España, los procedentes de los ácaros (Dermatophagoides pteronyssinus y D. farinae) son los alérgenos más comunes. Otros alérgenos proceden de pólenes (gramíneas [Secale cereale, Triticum sativum, etc.], hierbas [Plantago lanceolata, Parietaria judaica], árboles [Corylus avellana, Olea sp.]), hongos [Alternaria sp., Aspergillus sp., Cladosporium sp., etc.] y animales [epitelios y fluidos biológicos de gato, perro, rata, etc.].
El proceso de asma alérgico comienza con la sensibilización. En individuos con predisposición genética (susceptibilidad a antígenos como el polen, el polvo doméstico, etc.) y en determinadas condiciones ambientales (infección viral, humo de tabaco, etc.), se produce la interacción del antígeno con las células dendríticas y la posterior activación de la población de linfocitos T, los cuales generan citocinas que promueven la diferenciación y activación de los eosinófilos (interleucina 5, IL-5), la expresión de receptores de la IgE en los mastocitos y esosinófilos (IL-4), la expresión por parte del epitelio de receptores que atraen a los eosinófilos (IL-4) y la producción y liberación de IgE por parte de linfocitos B.
La reexposición al alérgeno produce un episodio agudo o ataque de asma, el cual se presenta en dos fases – inmediata y tardía –, aunque en algunos sujetos sólo se produce una única fase. La fase inmediata se caracteriza por la aparición de un espasmo en el músculo liso bronquial. Se produce porque el antígeno interactúa con el mastocito que había expresado y fijado la IgE a sus receptores en la sensibilización, liberando principalmente histamina, leucotrienos C4 y D4 (LTC4 y LTD4), responsables del broncoespasmo; aunque también son liberados otros mediadores (prostaglandina D2 [PGD2], neurocinina A, LTB4), los cuales provocan una migración de células inflamatorias – eosinófilos y monocitos – hacia esa zona anatómica. La fase tardía o respuesta diferida ocurre en un tiempo variable desde la inicial exposición al antígeno (6-8 horas). Suele ser nocturna. Esta fase es claramente la progresión de una reacción inflamatoria iniciada en la primera fase, la cual conlleva un acúmulo local de eosinófilos. Se piensa que los gránulos de los eosinófilos infiltrantes liberan mediadores citotóxicos que afectan al epitelio respiratorio ciliado.
Como se ve, son numerosas las células inflamatorias implicadas en el asma:
- Eosinófilos: Representan el 1-6% de todos los leucocitos circulantes. La prevalencia de la inflamación eosinofílica identifica un fenotipo de asma, que representa el 40-60% de todos los casos de asma; cuyo nivel de gravedad se correlaciona con la cantidad de eosinófilos en sangre y esputo. En estos pacientes los eosinófilos activados, mientras que su apoptosis está inhibida, e contienen enzimas inflamatorias responsables del daño epitelial y generan mediadores que amplifican la respuesta inflamatoria. Los eosinófilos disponen de receptores de tipo IgE que son capaces de internalizar los complejos antígeno-anticuerpo, liberando mediadores inflamatorios. Tienen gránulos que contienen diversos mediadores de las reacciones alérgicas, tales como histaminasa y arilsulfatasa. Asimismo, son capaces de segregar leucotrienos, que juegan un papel importante en la fisiopatología del asma, al provocar broncoconstricción e hipersecreción de moco. El ciclo biológico completo de los eosinófilos, desde su producción en la médula ósea hasta alcanzar el lugar donde se ha producido un proceso inflamatorio, de la producción a su reclutamiento, de la activación a la apoptosis, está estrictamente modulado por la interleucina 5 (IL-5) y su receptor específico (IL-5R).
- Células dendríticas: Existen dos poblaciones bien diferenciadas, la mieloide (tipo 1), originada en la médula ósea y la plasmocitoide (tipo 2), originada en tejido linfoide. Ambos tipos son detectables en la sangre, pero los asmáticos presentan un exceso de tipo 2 (plasmocitoides). El alérgeno es capaz de activarlas de forma directa, ya que pueden desplegar en su superficie receptores de alta afinidad para la IgE. Dada la cercanía que existe entre los cuerpos de las células dendríticas, las células epiteliales y las terminales nerviosas no mielinizadas, es posible que estas células desempeñen un rol en los fenómenos de hiperreactividad bronquial e inflamación neurogénica.
- Células epiteliales: El epitelio de las vías aéreas no ejerce una simple función de barrera, sino que es capaz de sintetizar diversas sustancias con acción biológica como el ácido araquidónico, óxido nítrico, endotelinas, citocinas y factores de crecimiento. Así es capaz de modular la función del músculo liso.
- Linfocitos T: Están elevados en la vía aérea, con un desequilibrio en la relación de células CD4+ en comparación con las CD8+.
- Mastocitos: Están aumentados, tanto en el epitelio como infiltrando el músculo liso de la pared. Su activación da lugar a la liberación de mediadores con efecto broncoconstrictor y proinflamatorio. Producen citocinas que mantienen y promueven la inflamación.
- Neutrófilos: Están elevados en la vía aérea de algunos pacientes con asma grave, durante las exacerbaciones, en caso de tabaquismo y en casos de asma relacionada con el trabajo.
- Macrófagos: Pueden ser activados por alérgenos a través de receptores de baja afinidad para la IgE y liberar sus mediadores, que amplifican la respuesta inflamatoria.
- Fibroblastos: Por los estímulos de citocinas como la IL-4 y la IL-13, se convierten en células inflamatorias activadas, participando tanto en la inflamación como en la remodelación. El número de fibroblastos y miofibroblastos activados en casos de asma se halla aumentado, fenómeno que adquiere aún mayor intensidad después de una provocación con alérgenos.
El objetivo principal del tratamiento del asma es lograr y mantener el control de la enfermedad lo antes posible, además de prevenir las exacerbaciones y la obstrucción crónica al flujo aéreo y reducir su mortalidad. Las exacerbaciones (ataques o crisis) de asma son episodios agudos o subagudos caracterizados por un aumento progresivo de uno o más de los síntomas típicos (disnea, tos, sibilancias y opresión torácica) acompañados de una disminución del flujo espiratorio (FEV1). Según la rapidez de instauración de las crisis, existen dos tipos: las de instauración lenta (normalmente en días o semanas) y las de instauración rápida (en menos de 3 horas), que deben identificarse por tener causas, patogenia y pronóstico diferentes.
Las crisis de instauración lenta (más del 80% de las que acuden a urgencias) se deben frecuentemente a infecciones respiratorias altas o a un mal control de la enfermedad por mala adhesión terapéutica; el mecanismo fundamental del deterioro es la inflamación y la respuesta al tratamiento es también lenta; mientras que las de instauración rápida se deben a alérgenos inhalados, ingestión de fármacos (AINE o fármacos betabloqueantes), alimentos (por los aditivos y conservantes) o estrés emocional; el mecanismo es el broncoespasmo y, aunque tienen una mayor gravedad inicial (con riesgo de intubación y muerte), la respuesta al tratamiento es mejor y más rápida. La intensidad de las exacerbaciones es variable, cursando en ocasiones con síntomas leves e indetectables por el paciente y en otras con episodios muy graves que ponen en peligro su vida.
El objetivo inmediato del tratamiento de una crisis es preservar la vida del paciente revirtiendo la obstrucción al flujo aéreo y la hipoxemia si está presente, de la forma más rápida posible, y posteriormente instaurar o revisar el plan terapéutico para prevenir nuevas crisis. La pauta de tratamiento en la exacerbación leve debe incluir la administración de broncodilatadores agonistas β2-adrenérgicos de acción rápida, glucocorticoides orales y oxígeno (si es necesario). Los agonistas β2-adrenérgicos de acción corta inhalados son los fármacos broncodilatadores más eficaces y rápidos en el tratamiento de la exacerbación asmática. Si en las primeras 2 horas del tratamiento se constata una evolución favorable (desaparición de síntomas, FEV1 superior al 80% del teórico o del mejor valor personal del paciente) y ésta se mantiene durante 3-4 horas, no son necesarios más tratamientos. Sin embargo, en pacientes no controlados adecuadamente con combinaciones inhaladas de corticosteroides y agonistas β2-adrenérgicos de acción corta administradas a demanda, puede recurrirse a combinaciones similares en las que el agonista β2 sea de acción prolongada (salmeterol, formoterol, vilanterol, etc.).
En el tratamiento de mantenimiento del asma se distinguen varios escalones de complejidad creciente, según la respuesta que manifieste el paciente. En todos ellos, no obstante, se pueden utilizar agonistas β2-adrenérgicos de acción corta administradas a demanda:
- Glucocorticoide inhalado a dosis bajas; alternativamente: antileucotrieno (montelukast, zafirlukast).
- Glucocorticoide inhalado a dosis bajas + agonista β2-adrenérgico de acción larga; alternativamente: glucocorticoide inhalado a dosis medias o glucocorticoide inhalado a dosis bajas + antileucotrieno.
- Glucocorticoide inhalado a dosis medias + agonista β2-adrenérgico de acción larga; alternativamente: glucocorticoide inhalado a dosis medias + antileucotrieno.
- Glucocorticoide inhalado a dosis altas + agonista β2-adrenérgico de acción larga; añadir antileucotrieno y/o teofilina y/u omalizumab.
- Glucocorticoide inhalado a dosis altas + agonista β2-adrenérgico de acción larga + glucocorticoides orales; añadir antileucotrieno y/o teofilina y/u omalizumab.
El uso de glucocorticoides sistémicos acelera la resolución de las exacerbaciones. Excepto en crisis muy leves, deben administrarse siempre, especialmente si: a) no se consigue una reversión de la obstrucción de las vías respiratorias con agonistas β2-adrenérgicos de acción rápida inhalados; b) el paciente estaba tomando ya glucocorticoides orales; c) el paciente ha tratado ya su pérdida de control previa con otras opciones terapéuticas sin éxito; d) existen antecedentes de exacerbaciones previas que requirieron glucocorticoides orales.
Los anticuerpos monoclonales han abierto un importante capítulo en el tratamiento de mantenimiento del asma. Básicamente, se contemplan las siguientes vías inmunofarmacológicas:
- Impedir la unión de la inmunoglobulina (Ig) E a sus receptores en los mastocitos y basófilos inhibiendo la reacción de hipersensibilidad inmediata y la subsiguiente cascada inflamatoria: omalizumab.
- Bloquear la producción o actividad de citocinas proinflamatorias implicadas, como la IL-5: mepolizumab, reslizumab.
- Antagonizar el efecto de ciertos neuropéptidos, sobre todo receptores de neurocininas implicadas en la inflamación neurogénica.
Finalmente, la inmunoterapia con alérgenos específicos es un tratamiento de mantenimiento indicado en el asma alérgica bien controlada, siempre que se haya demostrado una sensibilización mediada por la inmunoglobulina E frente a aeroalérgenos comunes, y se utilicen extractos bien estandarizados.
ACCIÓN Y MECANISMO
El reslizumab es un anticuerpo monoclonal que se une selectivamente y con elevada afinidad a la interleucina 5 (IL-5), impidiendo su acoplamiento con el receptor y con ello las acciones de la IL-5 sobre el ciclo biológico de los leucocitos eosinófilos. Ha sido autorizado para el tratamiento adicional en pacientes adultos con asma eosinofílica grave insuficientemente controlada con el tratamiento con corticosteroides inhalados en dosis altas más otro medicamento para el tratamiento de mantenimiento
La prevalencia de la inflamación eosinofílica identifica un fenotipo de asma, que representa el 40-60% de todos los casos de asma; cuyo nivel de gravedad se correlaciona con la cantidad de eosinófilos en sangre y esputo. En estos pacientes los eosinófilos activados, mientras que su apoptosis está inhibida, e contienen enzimas inflamatorias responsables del daño epitelial y generan mediadores que amplifican la respuesta inflamatoria. Los eosinófilos disponen de receptores de tipo IgE que son capaces de internalizar los complejos antígeno-anticuerpo, liberando mediadores inflamatorios. Tienen gránulos que contienen diversos mediadores de las reacciones alérgicas, tales como histaminasa y arilsulfatasa. Asimismo, son capaces de segregar leucotrienos, que juegan un papel importante en la fisiopatología del asma, al provocar broncoconstricción e hipersecreción de moco. El ciclo biológico completo de los eosinófilos, desde su producción en la médula ósea hasta alcanzar el lugar donde se ha producido un proceso inflamatorio, de la producción a su reclutamiento, de la activación a la apoptosis, está estrictamente modulado por la interleucina 5 (IL-5).
ASPECTOS MOLECULARES
El reslizumab es un anticuerpo monoclonal humanizado de tipo IgG4 κ formado por dos cadenas peptídicas pesadas idénticas y otras dos ligeras, también idénticas, unidas por 16 puentes disulfuro [-S-S-] (cuatro intercatenarios y 12 intracatenarios). Presenta una N-glicosilación en el dominio CH2 de la cadena pesada, en la asparagina en posición 293 (Asn293) formado por oligosacáridos complejos mayoritariamente fucosilados.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas del reslizumab han sido adecuadamente contrastadas en las indicaciones autorizadas mediante dos ensayos clínicos principales de fase 3 (confirmatorios de eficacia y seguridad), duplicados, multicéntricos, doblemente ciegos, de grupos paralelos, aleatorios y controlados con placebo. Ambos ensayos incluyeron pacientes asmáticos de 12 a 75 años de edad (de 128 centros de investigación clínica en el estudio 1 y 104 centros del estudio 2) de Asia, Australia, América del Norte, América del Sur, Sudáfrica y Europa, cuyo asma estaba inadecuadamente controlada por dosis medianas a altas de terapia basada en corticosteroides inhalados y que tenían 400 eosinófilos por μl o más en sangre y una o más exacerbaciones en el año anterior. Los pacientes fueron asignados aleatoriamente (1:1) para recibir reslizumab intravenoso (3,0 mg/kg) o placebo cada 4 semanas durante 1 año mediante asignación aleatoria central computarizada (Castro, 2015). La variable primaria de eficacia clínica fue la frecuencia de exacerbaciones clínicas asmáticas a lo largo del año de tratamiento, definidas como un empeoramiento del cuadro que requiriese el uso sistémico de corticosteroides o un incremento superior al 100% en la dosis de corticosteroides inhalados durante al menos tres días o la hospitalización o visita clínica de urgencia acompañada de un empeoramiento de los signos clínicos y síntomas del asma. De los 2.597 pacientes examinados, 953 fueron asignados aleatoriamente para recibir reslizumab (n = 477 [245 en el estudio 1 y 232 en el estudio 2]) o placebo (n = 476 [244 y 232]).
En el primero de los estudios, el porcentaje de pacientes que experimentaron al menos una exacerbación asmática fue del 54,1% entre los tratados con placebo y del 37,6% con reslizumab, lo que supone una reducción del 50% (p < 0,0001). Asimismo, la variación del FEV1 (flujo espiratorio forzado en un segundo) experimentada a las 16 semanas fue de 0,110 vs 0,248 L (+0,137 L a favor de reslizumab; p < 0,001), la variación de la puntuación del cuestionario del control asmático fue de –0,676 vs –0,941 (–0,266; p = 0,0001), la del cuestionario de calidad de vida asmática fue de 0,695 vs 0,933 (+0,238; p = 0,0143) y la del recuento de eosinófilos fue de –0,118 vs –0,548 × 109/L (–0,466; p < 0,0001).
En el segundo estudio, el porcentaje de pacientes que experimentaron al menos una exacerbación asmática fue del 45,1 vs 25,4%, lo que supone una reducción del 59% (p < 0,0001). Por su parte, la variación del FEV1 fue de 0,094 vs 0,187 L (+0,093 L a favor de reslizumab; p = 0,037), la variación de la puntuación del cuestionario del control asmático fue de –0,660 vs –0,857 (–0,196; p = 0,0032), la del cuestionario de calidad de vida asmática fue de 0,777 vs 0,987 (+0,209; p = 0,0259) y la del recuento de eosinófilos fue de –0,076 vs –0,555 × 109/L (–0,479; p < 0,0001).
Desde el punto de vista de la seguridad, el reslizumab presenta un perfil toxicológico relativamente benigno, con una incidencia de eventos adversos similar a la del placebo, fundamentalmente de carácter leve o moderado, y transitorios. Los eventos adversos más frecuentes fueron empeoramiento de los síntomas de asma (52% para el placebo y 40% para el reslizumab en el estudio 1; 51 vs 29% en el estudio 2), infecciones del tracto respiratorio (13 vs 16%; 7 vs 3%) y nasofaringitis (14 vs 11%; 24 vs 19%). Dos pacientes del grupo de reslizumab tuvieron reacciones anafilácticas; ambos respondieron al tratamiento estándar en el centro del estudio y se resolvieron, y los pacientes fueron retirados del estudio.
ASPECTOS INNOVADORES
El reslizumab es un anticuerpo monoclonal que se une selectivamente y con elevada afinidad a la interleucina 5 (IL-5), impidiendo su acoplamiento con el receptor y con ello las acciones de la IL-5 sobre el ciclo biológico de los leucocitos eosinófilos. Ha sido autorizado para el tratamiento adicional en pacientes adultos con asma eosinofílica grave insuficientemente controlada con el tratamiento con corticosteroides inhalados en dosis altas más otro medicamento para el tratamiento de mantenimiento.
Los datos procedentes de dos ensayos clínicos controlados con placebo muestran que el empleo de reslizumab es capaz de reducir en torno al 54% la tasa de exacerbaciones en pacientes con cuadros graves de asma eosinofílica mal controlados con altas dosis de corticosteroides inhalados o incluso con sistémicos. A ello cabe agregar mejoras significativas en las puntuaciones de los cuestionarios de control asmático y calidad de vida asmática, así como una reducción del recuento de eosinófilos (–0,475.109/L). Aunque los datos clínicos disponible de pacientes mayores de 65 años son limitados, no parece que este tipo de pacientes responda peor que los adultos menores de 65.
Desde el punto de vista de la seguridad, el reslizumab presenta un perfil toxicológico relativamente benigno, con una incidencia de eventos adversos similar a la del placebo, fundamentalmente de carácter leve o moderador, y transitorios. Los eventos adversos más frecuentemente descritos fueron empeoramiento de los síntomas de asma (52% para el placebo y 40% para el reslizumab en el estudio 1; 51 vs 29% en el estudio 2), infecciones del tracto respiratorio (13 vs 16%; 7 vs 3%) y nasofaringitis (14 vs 11%; 24 vs 19%).
La inflamación eosinofílica identifica un fenotipo de asma que representa el 40-60% de todos los casos, cuyo nivel de gravedad se correlaciona con la cantidad de eosinófilos en sangre y esputo. En estos pacientes, los eosinófilos activados, además de tener su apoptosis inhibida, contienen enzimas inflamatorias capaces de dañar el epitelio respiratorio y generan mediadores que amplifican la respuesta inflamatoria. Asimismo, son capaces de segregar leucotrienos, que juegan un papel importante en la fisiopatología del asma, al provocar broncoconstricción e hipersecreción de moco.
Hace aproximadamente un año fue incorporado el mepolizumab (Nucala®), un anticuerpo monoclonal contra la cadena α del receptor de la interleucina 5 (IL-5Rα), impidiendo las acciones de la IL-5 sobre el ciclo biológico de los leucocitos eosinófilos, autorizándose para el tratamiento adicional en pacientes adultos con asma eosinofílica refractaria grave. Aunque el reslizumab es un anticuerpo frente a la IL-5, y no frente a su receptor (IL-5R), el efecto biológico es el mismo, en tanto que ambos mecanismos inhabilitan la vía de la IL-5, que regula el ciclo biológico completo de los eosinófilos, desde su producción en la médula ósea hasta alcanzar el lugar donde se ha producido un proceso inflamatorio, de la producción a su reclutamiento, de la activación a la apoptosis.
Por estos motivos, parece razonable considerar al mepolizumab como el medicamento de referencia del grupo. Como suele ocurrir con los medicamentos que son cabeza de serie de nuevas líneas farmacológicas, no hay datos clínicos directamente comparativos por el momento, por lo que no queda más remedio que recurrir a las comparaciones indirectas de estudios clínicos realizados en condiciones y pacientes similares. En este sentido, los datos procedentes de dos ensayos clínicos controlados con placebo muestran que el empleo de mepolizumab (dosis mensuales de 100 mg SC) es capaz de reducir en torno al 50% la tasa de exacerbaciones en pacientes con cuadros graves de asma eosinofílica mal controlados con altas dosis de corticosteroides inhalados o incluso con sistémicos, así como en pacientes previamente tratados con omalizumab, reduciendo en algún grado las necesidades de utilización de corticosteroides sistémicos (Cuéllar, 2016). Como ocurre con reslizumab, el mepolizumab tiene una buena tolerabilidad general e incluso con una menor incidencia global de eventos adversos que el propio placebo.
Aunque las comparaciones indirectas solo pueden tener un carácter cualitativo, todo hace pensar que no hay diferencias sustanciales entre mepolizumab y reslizumab, ni tan siquiera en la frecuencia de administración (una vez cada cuatro semanas), aunque el segundo requiere la perfusión IV mientras que el primero es fácilmente administrado por vía subcutánea. En ambos casos, los potenciales respondedores al tratamiento son aquellos pacientes con persistente eosinofilia sistémica y en epitelio respiratorio, usuarios de altas dosis de corticosteroides en inhalación y sistémicos, con un inadecuado control de los síntomas, con un alto impacto sobre su calidad de vida y con varias exacerbaciones asmáticas al año que obligan a la hospitalización o la consulta de urgencia.
|
VALORACIÓN |
|
RESLIZUMAB
|
|
Grupo Terapéutico (ATC): R03DX. APARATO RESPIRATORIO. Agentes contra padecimientos obstructivos de las vías respiratorias: otros. |
|
Indicaciones autorizadas: Tratamiento adicional en pacientes adultos con asma eosinofílica grave insuficientemente controlada con el tratamiento con corticosteroides inhalados en dosis altas más otro medicamento para el tratamiento de mantenimiento. |
|
SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Mepolizumab |
Nucala |
GlaxoSmithKline |
2016 |
|
Reslizumab |
Cinqaero |
Teva |
2017 |
BIBLIOGRAFÍA
Bibliografía
- Castro M, Zangrilli J, Wechsler ME, Bateman ED, Brusselle GG, Bardin P, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir Med. 2015; 3(5): 355-66. doi: 10.1016/S2213-2600(15)00042-9.
- Cuéllar Rodríguez S. Mepolizumab (Nucala®) en asma eosinofílica. Panorama Actual Med 2016; 40(397): 916-22.
- European Medicines Agency (EMA). Cinqaero®. European Public Assessment Report (EPAR). EMA/450050/2016; EMEA/H/C/003912. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003912/WC500212252.pdf
- Yanagibashi T, Satoh M, Nagai Y, Koike M, Takatsu K. Allergic diseases: From bench to clinic – Contribution of the discovery of interleukin-5. Cytokine. 2017; 98: 59-70. doi: 10.1016/j.cyto.2016.11.011.
1 FEV1: Volumen espiratorio máximo en el primer segundo de la espirometría forzada.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





