Regorafenib STIVARGA® (Bayer)
 Nº382
Nº382
Resumen
El regoranib es un inhibidor de un amplio grupo de tirosina cinasas. Ha sido autorizado para el tratamiento de pacientes adultos con cáncer colorrectal metastásico que han sido previamente tratados con las terapias disponibles o no se les considera candidatos adecuados a dichas terapias, incluyendo quimioterapia basada en fluoropirimidinas, terapia anti-VEGF y terapia anti-EFGR; también está indicado en pacientes adultos con tumores del estroma gastrointestinal (GIST) irresecables o metastásicos que progresaron durante el tratamiento previo con imatinib y sunitinib o son intolerantes al mismo. Se trata del primer inhibidor de tirosina cinasas que demuestra algún grado de beneficio clínico en términos de supervivencia en los pacientes con cáncer colorrectal metastásico con progresión tumoral pese a haber sido intensamente tratados con los medicamentos de referencia actuales. En esta misma línea, debe valorarse el modesto pero significativo efecto beneficioso en los pacientes con tumores estromales gastrointestinales (GIST) progresivos tras el empleo de imatinib, que presentan un pronóstico manifiestamente desfavorable y para los que actualmente no hay opciones terapéuticas contrastadas. Un nuevo elemento más dentro de la amplia nómina de inhibidores de tirosina cinasas disponible, que aporta un modesto beneficio clínico en situaciones terminales que actualmente carecen de tratamientos bien establecidos.
CÁNCER COLORRECTAL
El cáncer colorrectal representará en 2015 el tipo de cáncer más comúnmente diagnosticado en España, con un 15,0% (34.096/227.076) de todos los nuevos casos de cáncer diagnosticados (IARC, 2014), por delante del cáncer de próstata (29.602; 13,0%) y el de pulmón (28.324; 12,5%); en torno a 55 nuevos casos anuales por cada 100.000 varones españoles y unos 30 para las mujeres. En cuanto a la mortalidad, el número de varones españoles que se estima que morirán en 2015 debido a un cáncer colorrectal es de 15.501, lo que supone el 14,3% de todas las defunciones previstas por cáncer en 2015 (108.390), solo por debajo del cáncer de pulmón (22.368; 20,6%). En Europa, el número de casos previstos de cáncer colorrectal en 2015 es de 494.255, lo que representa un 12,7% de los 3.877.124 casos de cáncer; por lo que respecta al número de muertes asociadas a este tipo de cáncer, la previsión para 2015 arroja valores de 239.848, un 11,8% del total de muertes por cáncer en varones (2.026.026).
Entre los principales factores de riesgo asociados al cáncer colorrectal destacan ciertas alteraciones genéticas (hasta un 30% de los pacientes tienen carga familiar y el 5% de los casos se debe a síndromes hereditarios), la enfermedad inflamatoria intestinal (colitis ulcerosa, enfermedad de Crohn), el consumo de alcohol y tabaco, la obesidad, la dieta rica en grasas y baja en fibra, etc. La mayoría de los casos se diagnostican entre los 65 y los 75 años, con un máximo a los 70, aunque se registran casos desde los 35-40 años. Aproximadamente, entre el 20% y el 25% de los pacientes presenta metástasis en el momento del diagnóstico y más del 50% de los pacientes diagnosticados en estadios iniciales acabará desarrollándolas. El grado de evolución (estadio) de la enfermedad es el principal factor pronóstico, con tasas de supervivencia a los cinco años por encima del 90% en el estadio I y de menos del 10% en el IV.
El tratamiento inicial de la enfermedad localizada es la cirugía, resecando la mitad del colon (hemicolectomía derecha o izquierda) donde se localice el tumor, o todo el colon (colectomía total o subtotal) cuando haya varios tumores localizados en diferentes lados del colon. Tras la cirugía, la tasa de supervivencia a los 5 años varía mucho, en función del estadio de la enfermedad, yendo desde un 90% para aquellos en los estadios más iniciales, hasta menos del 30% en los pacientes con más de 4 ganglios afectados (estadio IIIc) (Lamarca, 2011).
Con la quimioterapia postoperatoria (adyuvante) se trata de reducir el riesgo de recurrencia de la enfermedad y aumentar la supervivencia de los pacientes. Su utilidad en tumores con afectación ganglionar (estadios III) ha quedado demostrada en múltiples ensayos clínicos. En aquellos tumores en los que no haya ganglios afectados, pero el tumor infiltre capas profundas de la pared del colon (estadios II), el beneficio de este tratamiento es más controvertido y solo está indicado cuando existan factores de riesgo (perforación u obstrucción intestinal, menos de 12 ganglios resecados, infiltración de vasos linfáticos o nervios por el tumor, tumor cercano a los bordes de la cirugía, etc.).
Los fármacos que han demostrado utilidad en el tratamiento adyuvante del cáncer de colon son las fluoropirimidinas (fluorouracilo –5-FU–, capecitabina y tegafur-uracilo –UFT–) y el oxaliplatino. El irinotecán, utilizado en el cáncer de colon metastásico, no es útil en tumores localizados. Inicialmente se utilizaron combinaciones de 5-FU con ácido folínico (leucovorina, LV) en diversos esquemas (bolo o infusión continua), con un mejor perfil de toxicidad en aquellos de infusión continua. Las fluoropirimidinas orales (capecitabina, UFT) han demostrado ser al menos tan eficaces como las combinaciones de 5-FU y LV, con la ventaja de una administración más cómoda. Posteriormente, se demostró que la adición de oxaliplatino a los esquemas de 5-FU y LV (esquema FOLFOX) aumentaba la supervivencia libre de enfermedad y la supervivencia global frente a esquemas con 5-FU y LV. La combinación de capecitabina y oxaliplatino (esquema CAPOX) también se ha mostrado superior a 5-FU y LV. Por ello, el estándar de tratamiento adyuvante actualmente consiste en 6 meses de quimioterapia mediante la pauta FOLFOX, o bien CAPOX como alternativa.
Como ya se indicado, hasta un cuarto de los pacientes con tumores de colon presentan metástasis (las más frecuentes, hepáticas y pulmonares) en el momento del diagnóstico, a pesar de lo cual, puede ser subsidiario de cirugía: si el tumor primario causa problemas (obstrucción, sangrado, etc.) puede realizarse, en el caso de que sea posible, una extirpación del mismo, o una cirugía paliativa sin resección tumoral para restituir el tránsito intestinal (colostomía de descarga).
Por el momento, no existe tratamiento curativo para el cáncer colorrectal mestastásico, aunque puede prolongarse la vida del paciente de forma significativa, pasando de 6 meses (supervivencia media sin tratamiento) hasta un promedio de 20 con quimioterapia selectiva.
Además de los fármacos ya comentados previamente (fluoropirimidinas y oxaliplatino), son útiles en el tratamiento de la enfermedad metastásica el irinotecán y determinados anticuerpos monoclonales. En este sentido, se ha observado que la supervivencia de los pacientes es mayor cuantos más fármacos lleguen a recibir a lo largo de la evolución de la enfermedad. Por ello, lo habitual es administrar combinaciones de quimioterapia (fluoropirimidina combinada con oxaliplatino o irinotecán). Cuando la enfermedad progresa a un tratamiento concreto, se cambia de esquema de quimioterapia.
Se han diseñado múltiples esquemas de tratamiento. Algunos de ellos (FOLFOX y CAPOX) ya se han mencionado para el tratamiento de la enfermedad localizada, pero otros, basados en el uso de irinotecán combinado con 5-FU (FOLFIRI, IFL), sólo son útiles en la enfermedad metastásica. La elección de una u otra combinación debe realizarse en función del perfil de toxicidad deseado, pues no existen diferencias en cuanto a supervivencia en función del esquema de quimioterapia elegido inicialmente. El esquema FOLFIRI utiliza 180 mg/m2 de irinotecán en perfusión intravenosa, durante 90 minutos, y 400 mg/m2 de ácido folínico en perfusión intravenosa, durante 2 horas, al mismo tiempo el día 1, seguido de 400 mg/m2 de fluorouracilo en bolo intravenoso, seguido de 2400 mg/m2 en perfusión intravenosa continua durante 46 horas, completando un ciclo de dos semanas. Por su parte, el esquema IFL se basa en la administración durante el primer día de cada semana de irinotecán, fluorouracilo y ácido folínico, durante 4 de cada 6 semanas.
Los esquemas basados en oxaliplatino (FOLFOX, CAPOX) tienen como principal efecto adverso la neurotoxicidad, mientras que las combinaciones con irinotecán (FOLFIRI, IFL) producen fundamentalmente toxicidad gastrointestinal (diarrea) y alopecia. Cuando la toxicidad de estas combinaciones de quimioterapia sea intolerable, pero la enfermedad haya respondido, puede retirarse el fármaco más tóxico (oxaliplatino o irinotecán) dejando como mantenimiento el fluorouracilo hasta que la enfermedad progrese. En lo que a los fármacos quimioterápicos clásicos se refiere, el raltitrexed y la mitomicina son también una opción a tener en cuenta.
El desarrollo de nuevos anticuerpos monolonales selectivos está incrementando las opciones terapéuticas disponibles y, en particular, el cáncer colorrectal metastásico es uno de los tumores donde el uso de estos fármacos está más desarrollado. El bevacizumab, combinado con quimioterapia basada en irinotecán (FOLFIRI o IFL), ha demostrado mejorar los resultados de la quimioterapia sola, aumentando la supervivencia global de los pacientes. También existen datos favorables en la combinación con esquemas con oxaliplatino (CAPOX o FOLFOX), retrasando la progresión de la enfermedad.
En el caso del cetuximab, para que este anticuerpo anti-EGFR (receptor del factor de crecimiento epidérmico) sea útil, los pacientes tienen que mantener sin mutaciones el gen KRAS (Kirsten Rat Sarcoma). En caso de existir mutaciones de KRAS, ésta se encuentra activada de manera constante e independiente del EGFR, por lo que su bloqueo por cetuximab no resulta útil. Al igual que bevacizumab, este fármaco, en combinación con irinotecán, mejora los resultados de supervivencia en los pacientes con KRAS no mutado. Otro fármaco anti-EGFR usado en estos pacientes es el panitumumab, que requiere para su uso, al igual que para el cetuximab, descartar la existencia de mutación de KRAS. Está admitido su uso en monoterapia tras progresión a primera línea. Los efectos secundarios son muy similares a los del cetuximab, excepto por una muy baja incidencia de reacciones de hipersensibilidad, por lo que no precisa premedicación.
El aflibercept es una proteína de fusión recombinante, formada por porciones de los lugares de unión del factor de crecimiento del endotelio vascular (VEGF) de los dominios extracelulares de los receptores humanos VEGFR-1 y 2, fusionados con una porción Fc de la IgG1 humana. El fármaco actúa como un receptor soluble que se une al VEGF-A, actuando de señuelo, con una afinidad más alta que sus receptores nativos, con lo que previene la unión de los ligandos endógenos a dichos receptores y, de esta forma, bloquea la señalización correspondiente. Todo ello da lugar a un bloqueo de la proliferación de células endoteliales, inhibiendo, así, el crecimiento de nuevos vasos (neovasos tumorales) que proporcionan oxígeno y nutrientes a los tumores (Cuéllar, 2013). Para el cáncer colorrectal se utiliza en combinación con quimioterapia con irinotecán-fluorouracilo-ácido folínico (FOLFIRI).
TUMORES DEL ESTROMA GASTROINTESTINAL (GIST)
Los GIST (gastrointestinal stromal tumor) son tumores que surgen de las células estromales (las que forman el tejido de sostén) del tracto gastrointestinal; forman parte de los sarcomas (tumores de tejidos blandos), que afectan al tejido conectivo, cuya función fisiológica es ligar y rellenar otros tejidos, tales como el adiposo, el muscular, el nervioso o los vasos sanguíneos. Habida cuenta de que el tejido conectivo se encuentra diseminado por prácticamente todo el organismo, los sarcomas de tejidos blandos tienen una distribución muy amplia.
En el caso específico de los GIST, se trata de tumores del tejido conectivo presente a lo largo de todo en el tubo digestivo, desde el estómago hasta el ano. Suelen permanecer clínicamente silentes hasta que alcanza un tamaño considerable, provocando obstrucciones, opresiones, hemorragias y roturas orgánicas. Frecuentemente se diagnostica a partir de los 50 años de edad y con algo más de frecuencia en hombres que en mujeres. Los lugares más frecuentes de aparición son estómago (50-70%), intestino delgado (20-30%), esófago (5%), recto (5%) y colon (2%). En ocasiones, los GIST primarios pueden aparecer en la membrana de otros órganos abdominales, como el peritoneo, o en órganos como el hígado, el páncreas, los ovarios, el útero y la próstata. Habida cuenta de su crecimiento silente, en la actualidad aproximadamente en el 50% de los diagnósticos ya hay metástasis, mayoritariamente localizadas en hígado (60-70%) y peritoneo (20-25%).
Los GIST representan aproximadamente el 1% de todos los tumores gastrointestinales y es el más común de todos los de origen mesenquimatoso en esta localización. La incidencia de GIST en España se estima entre 300 y 700 nuevos casos al año, es decir, entre 0,7 y 1,5 casos por cada 100.000 habitantes al año.
La enfermedad aparece cuando las células intersticiales de Cajal se malignifican. Estas células, que se encuentran en la pared del tubo digestivo formando parte del sistema nervioso autónomo, son responsables de trasladar las señales de éste al tracto gastrointestinal, para estimular su movimiento (peristaltismo), facilitando el paso de los alimentos a su través.
La gran mayoría de los casos de GIST (más del 90%) están relacionados con una mutación del protooncogen c-KIT, que codifica la expresión del receptor KIT (RTK), una glucoproteína de membrana (CD117) implicada en el control de la proliferación de las células intersticiales de Cajal y otras (pigmentarias, hematopoyéticas, gonadales). El KIT es una tirosina cinasa receptora específica del llamado Factor de Células Precursoras (SCF, stem cell factor), implicado en el desarrollo de las células precursoras hematopoyéticas, gonadales y pigmentarias. La mutación supone que el receptor KIT permanece activado permanentemente, incluso en ausencia de cualquier estímulo, siendo insensibles a los mecanismos de control fisiológicos celulares. Esto determina una anormal proliferación celular y la inhibición de los mecanismos apoptóticos (Cuéllar, 2007). Todavía hoy se desconocen las posibles causas ambientales que provocan la mutación del receptor KIT; solo una mínima parte de los casos de GIST parecen ser debidos a factores hereditarios.
El tratamiento es fundamentalmente quirúrgico. Tras ello, se utiliza imatinib durante un año para reducir el riesgo de recidiva; también se emplea en pacientes con tumores irresecables o con metástasis en otros órganos, cuando la cirugía es improcedente; como alternativa para los pacientes que desarrollan resistencia o intolerancia al imatinib se emplea sunitinib (Lamarca, 2011).
ACCIÓN Y MECANISMO
El regoranib es un inhibidor de un amplio grupo de tirosina cinasas (TK), incluyendo las que forman parte de receptores de ligandos endógenos implicados en la angiogénesis tumoral (VEGFR1, 2 y 3; TIE2, FGFR1 Y PDGFRB), la oncogénesis (KIT, RET, RAF-1, BRAF) y el microambiente tumoral (PDGFR, FGFR). Este conjunto de efectos antiangiogénicos y antioncogénicos determina un efecto antineoplásico neto de regoranib, así como de sus dos principales metabolitos (aunque estos últimos presentan un perfil de actividad sobre las TK diferente del propio regoranib, lo que, de hecho, amplía el espectro de actividad inhibidora de tirosina cinasas (TKI) del fármaco.
El medicamento ha sido autorizado para el tratamiento de pacientes adultos con cáncer colorrectal metastásico que han sido previamente tratados con las terapias disponibles o no se les considera candidatos adecuados a dichas terapias, incluyendo quimioterapia basada en fluoropirimidinas, terapia anti-VEGF y terapia anti-EFGR; también está indicado en pacientes adultos con tumores del estroma gastrointestinal (GIST) irresecables o metastásicos que progresaron durante el tratamiento previo con imatinib y sunitinib o son intolerantes al mismo.
La consecuencia farmacológica principal de la inhibición de las tirosina cinasas (TK) mencionadas es una inhibición de los procesos de angiogénesis tumoral y el bloqueo la estimulación de las células tumorales y endoteliales. Las anomalías observadas en varios TK mutantes están involucradas en el complicado proceso de carcinogénesis de varios tipos de tumores sólidos, incluyendo la proliferación celular incontrolada, la migración celular, invasión del estroma, angiogénesis y resistencia a la apoptosis. En el caso particular de los tumores del estroma gastrointestinal (GIST), las mutaciones activadoras del KIT están presenten en más del 90% de los casos. Los principales receptores acoplados a tirosina cinasas implicados en la acción del regoranib son:
- Los VEGFR1, 2 y 3 son receptores de tirosina cinasas de la misma familia bioquímica (VEGFR). El sistema de señalización ligandos/receptores VEGFR desempeña un papel clave en el desarrollo vascular y en la regulación de la permeabilidad vascular. El VEGFR1 actúa como receptor del VEGF (factor de crecimiento activo en angiogénesis, vasculogénesis y crecimiento celular endotelial; induce la proliferación celular endotelial, promueve la migración celular, inhibe la apoptosis e induce la permeabilidad de los vasos sanguíneos), del VEGFB (factor de crecimiento para células endoteliales) y del PGF (factor de crecimiento activo en angiogénesis y crecimiento celular endotelial; también promueve el crecimiento de las células tumorales). La activación del VEGFR2 induce la autofosforilación del receptor y su activación. Por su parte, el VEGFR3k tiene una función clave en la linfangiogénesis adulta y en el desarrollo de la red vascular y del sistema cardiovascular durante el desarrollo embrionario; promueve la proliferación, supervivencia y migración de las células endoteliales, y regula los brotes angiogénicos.
- El TIE2 forma parte de la familia de receptores TIE; actúa específicamente como receptor de la angiopoyetina 1 (implicado en la angiogénesis). Este receptor es expresado casi exclusivamente por células endoteliales y concretamente en las células musculares lisas del endotelio, donde desarrolla funciones críticas relacionadas con la comunicación celular en el proceso de morfogénesis venosa.
- El FGFR1 es el receptor del Factor de Crecimiento de Fibroblastos, implicado en la génesis de las extremidades.
- El PDGFRB (PDGFRβ) forma parte de la familia de receptores del Factor de Crecimiento Derivado de Plaquetas (PDGF). La activación de este receptor por el ligando induce la dimerización del mismo y su autofosforilación, regulando el crecimiento celular y la reorganización, migración y diferenciación de la actina.
- El KIT también forma parte de la misma familia que los PDGFR. Es un receptor para el factor de células madre y juega un papel crítico en el desarrollo del sistema de células precursoras hematopoyéticas, mastocitos, melanocitos y células germinales. Sus ligandos inducen la autofosforilación del receptor, su dimerización y activación. Las mutaciones que impiden la actividad tirosina cinasa del c-KIT se asocian con hiperplasia y tumorigénesis; que en el caso de los tumores estromales gastrointestinales están presenten en más del 90% de los casos.
- El RET es un receptor tirosina cinasa protooncogénico. Es el receptor natural del GDNF (factor neurotrópico derivado de líneas celulares gliales. Parece ser fundamental para el desarrollo del riñón y de las células derivadas de la cresta neural; en este sentido, debe recordarse que los GIST aparecen cuando las células intersticiales de Cajal se malignifican. Estas células se encuentran en la pared del tubo digestivo formando parte del sistema nervioso autónomo (donde son responsables de trasladar las señales de éste al tracto gastrointestinal, para estimular el peristaltismo).
- RAF1 (c-RAF) es una serina/treonine proteína cinase con características de protooncogén, que forma parte del sistema de señalización RAS (Rat Sarcoma). Su actuación es determinante en numerosos procesos ligados a la proliferación, diferenciación, apoptosis, supervivencia y transformación oncogénica de las células. BARF es una tirosina cinasa de la misma familia que, en condiciones fisiológicas, juega un papel en las respuestas postsinápticas de las neuronas del hipocampo, pero la existencia de mutaciones proporciona un efecto oncogénico; de hecho, se detectan mutaciones activadoras en aproximadamente el 10% de los cánceres colorrectales, pulmonares y gliomas.
ASPECTOS MOLECULARES
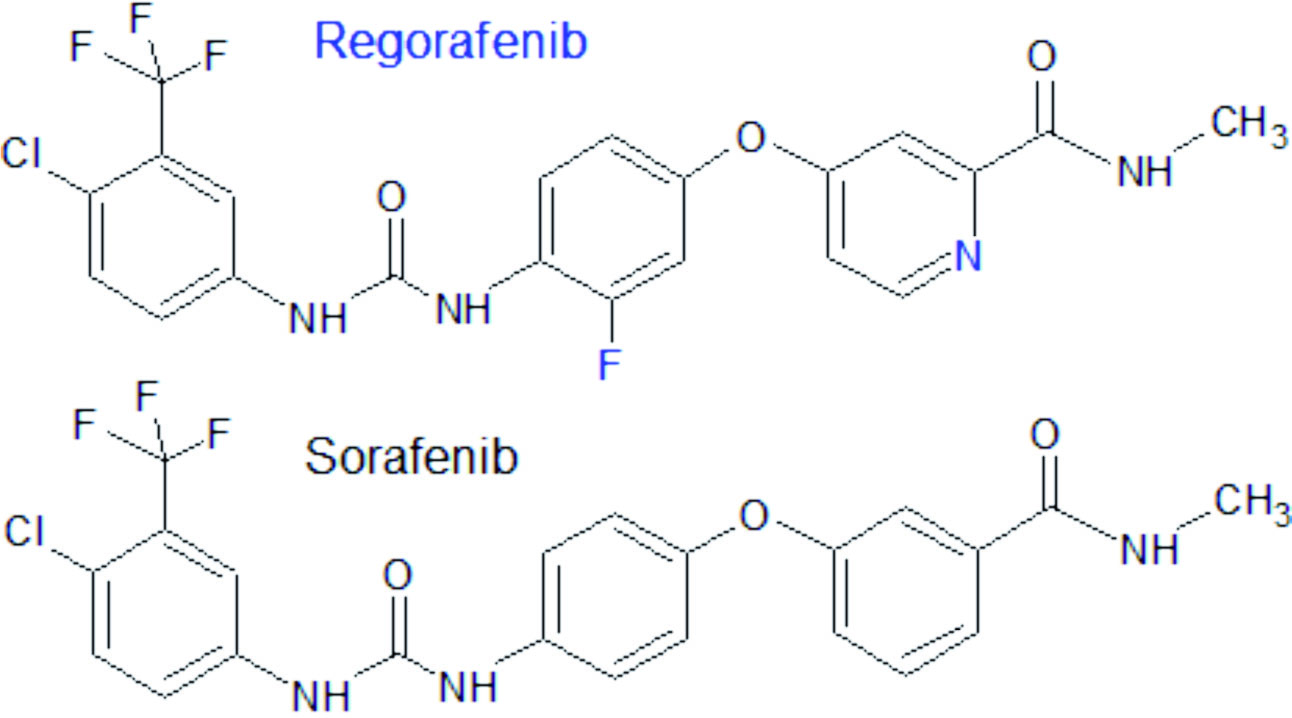
El regorafenib es un inhibidor de tirosina cinasas con una evidente relación estructural con el sorafenib (desarrollado por el mismo laboratorio titular del regorafenib, Bayer).
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínica del regorafenib han sido adecuadamente contrastadas en las dos indicaciones autorizadas, mediante sendos ensayos clínicos multicéntricos, multinacionales, aleatorizados y controlados con placebo.
Eficacia
Con la indicación de cáncer colorrectal metastásico, el estudio (CORRECT; Grothey, 2013) fue desarrollado sobre un total de 753 pacientes con adenocarcinoma colorrectal metastásico histológica o citológicamente confirmado, que habían experimentado progresión tumoral en los últimos tres meses tras la administración de terapia antineoplásica estándar, incluyendo fluoropirimidinas, oxaliplatino, irinotecán, bevacizumab y cetuximab o panitumumab (en el caso de KRAS no mutado o desconocido). El 60-62% eran varones, 78-79% de raza blanca, con una mediana de edad de 61 años (61-65% tenían menos de 65 años), habían transcurrido una mediana de 129-133 semanas desde el diagnóstico de metástasis y de 4,5 a 5,0 semanas desde la progresión tumoral; un 54-62% tenían KRAS mutado y la misma proporción tenían BRAF mutado.
Todos los pacientes recibieron el mejor tratamiento de mantenimiento, junto con placebo o con regorafenib (160 mg/24 h, oral, durante las primeras tres semanas de cada ciclo de cuatro). Como variable primaria de eficacia se determinó la supervivencia global de los pacientes (mediana de tiempo transcurrido desde el comienzo del tratamiento hasta la muerte por cualquier causa); como variables secundarias de eficacia se midieron la supervivencia libre de progresión tumoral (mediana de tiempo transcurrido desde el inicio del tratamiento hasta la primera observación clínica o radiológica de progresión tumoral, o muerte por cualquier causa), la tasa de respuestas objetivas (completas y parciales) y la tasa de control de la enfermedad (tasa de respuestas objetivas más la de estabilización), etc.
Los últimos resultados registrados (segundo análisis intermedio) mostraron una supervivencia global de 194 días (6,5 meses de 30 días) con regorafenib vs. 152 días (5,1 meses) con placebo, lo que implica una diferencia de 42 días (1,4 meses) favorable al regorafenib, con una reducción del riesgo de muerte del 21%, estadísticamente significativa (HR=0,790; IC95% 0,664 a 0,939; p=0,003791). Con estos datos, el porcentaje de pacientes vivos al cabo de 6 meses era del 52,2% (IC95% 0,479 a 0,566) con regorafenib vs. 43,1% (IC95% 0,369 a 0,492), mientras que a los 12 meses era del 24,1% (IC95% 0,198 a 0,283) vs. 17,0% (IC95% 0,114 a 0,226). En todos los subgrupos analizados (sexo, estatus de KRAS o BRAF, tiempo desde el diagnóstico, etc.) se obtuvieron respuestas significativamente más favorables con regorafenib; no obstante, los resultados fueron mejores en los pacientes sin mutación KRAS (reducción del riesgo de mortalidad del 35% vs. 23%), y en los tumores primarios de colon vs. recto (30% vs. 5%)
En cuanto a la supervivencia libre de progresión tumoral fue de 59 días (1,97 meses) con regorafenib vs. 52 días (1,73 meses) con placebo, una diferencia de 7 días favorable al regorafenib. La tasa de respuestas objetivas no fue significativamente diferente (1% vs. 0,4%), pero sí lo fue la de control de la enfermedad, favorable al regorafenib (41% vs. 14,9%). Los datos relativos a la calidad de vida de los pacientes no mostraron diferencias significativas entre ambos tratamientos.
Por lo que respecta a los tumores de estroma gastrointestinal, GIST, el estudio (GIRD; Demetri, 2013) fue desarrollado sobre un total de 199 pacientes con GIST metastásico y/o irresecable que habían experimentado progresión tumoral tras la administración de imatinib o presentasen intolerancia a éste. Como en el estudio anterior, los pacientes recibieron el mejor tratamiento de mantenimiento, junto con placebo o con regorafenib (160 mg/24 h, oral, durante las primeras tres semanas de cada ciclo de cuatro). Como variable primaria de eficacia se determinó la supervivencia libre de progresión tumoral, mientras que como variables secundarias se midieron la supervivencia global, la tasa de respuestas objetivas y la tasa de control de la enfermedad (tasa de respuestas objetivas más la de estabilización), entre otras. El 64% eran varones, 68% de raza blanca, con una mediana de edad de 64 años (68% tenían menos de 65 años), habían transcurrido una mediana de 14,4 semanas desde la progresión tumoral más reciente; un 64% tenía metástasis y un 87% presentaba más de una localización tumoral; un 72% había estado utilizando imatinib durante al menos 18 meses y hasta un 43% habían utilizado cuatro o más líneas de tratamiento.
Los resultados obtenidos mostraron una mediana de supervivencia libre de progresión tumoral de 147 días (IC95% 122 a 173; 4,9 meses) con regorafenib vs. 28 (IC95% 28 a 32; 0,93 meses), lo que supone una reducción del riesgo de progresión tumoral del 73% (HR=0,268; IC95% 0,185 a 388; p<0,0001); sin embargo, la mediana de supervivencia global fue de 529 días en ambos casos. Por lo que respecta a la mediana de tiempo transcurrido hasta evidencia radiológica de progresión tumoral, fue de 165 días (IC95% 125 a 174; 5,5 meses) con regorafenib vs. 28 (IC95% 28 a 34; 0,93 meses), lo que supone una reducción del riesgo de progresión tumoral del 75% (HR=0,248; IC95% 0,170 a 364; p<0,0001); finalmente, la tasa de respuestas objetivas fue del 4,5% (IC95% 1,7 a 9,6) vs. 1,5% (IC95% 0,0 a 8,2), cuya diferencia no fue estadísticamente significativa.
Seguridad
En conjunto, los efectos adversos más frecuentemente asociados al regorafenib (por encima del 30% de los pacientes) son debilidad, cansancio, anorexia, síndrome mano-pie1, diarrea, infecciones, hipertensión y disfonía. En el ensayo clínico realizado sobre pacientes con cáncer colorrectal, la incidencia de los principales eventos adversos fue de: síndrome mano-pie (45% con regorafenib vs. 7,1% con placebo), diarrea (34 vs. 8,3%), anorexia (30 vs. 15%), fatiga (29 vs. 19%), disfonía (28 vs. 5,5%), hipertensión (28 vs. 5,9%), astenia (20 vs. 8,7%), etc. En cuanto al nivel de gravedad, el porcentaje de pacientes con algún evento adverso relacionado con el tratamiento de grado 3 o mayor fue del 55% vs. 14%, considerándose graves en el 12% vs. 3,6% y conduciendo a la suspensión del tratamiento en el 8,2% vs. 1,2%, o a una modificación de la posología en el 56% vs. 9,1%.
Por su parte, en los pacientes con GIST, la incidencia de los principales eventos adversos fue de: síndrome mano-pie (66 vs. 27% con placebo), diarrea (46 vs. 9,1%), anorexia (31 vs. 21%), fatiga (37 vs. 29%), disfonía (38 vs. 9,1%), hipertensión (59 vs. 27%), astenia (16 vs. 12%), etc. En cuanto al nivel de gravedad, el porcentaje de pacientes con algún evento adverso relacionado con el tratamiento de grado 3 o mayor fue del 61% vs. 10%, considerándose graves en el 8,3% vs. 3,0% y conduciendo a la suspensión del tratamiento en el 2,3% vs. 1,5%, o a una modificación de la posología en el 63% vs. 9,1%.
ASPECTOS INNOVADORES
El regoranib es un inhibidor de un amplio grupo de tirosina cinasas (TK), incluyendo las que forman parte de receptores de ligandos endógenos implicados en la angiogénesis tumoral (VEGFR1, 2 y 3; TIE2, FGFR1 Y PDGFRB), la oncogénesis (KIT, RET, RAF-1, BRAF) y el microambiente tumoral (PDGFR, FGFR). El medicamento ha sido autorizado para el tratamiento de pacientes adultos con cáncer colorrectal metastásico que han sido previamente tratados con las terapias disponibles o no se les considera candidatos adecuados a dichas terapias, incluyendo quimioterapia basada en fluoropirimidinas, terapia anti-VEGF y terapia anti-EFGR; también está indicado en pacientes adultos con tumores del estroma gastrointestinal (GIST) irresecables o metastásicos que progresaron durante el tratamiento previo con imatinib y sunitinib o son intolerantes al mismo.
El ensayo pivotal en pacientes con cáncer colorrectal metastásico progresivo tras los tratamientos estándar actuales, ha mostrado efectos modestos aunque clínicamente relevantes y estadísticamente significativos, incrementando en torno a 1,4 meses la supervivencia global en estos pacientes, con tasa de supervivencia a los 12 meses del 24 vs. 17% frente al placebo. Aunque es obvio que la mejora alcanzada es muy discreta, es preciso tener en cuenta la condición de estos pacientes, para las que prácticamente no quedan ya opciones terapéuticas.
Aunque los datos apuntan una mejor respuesta en pacientes sin mutaciones del gen KRAS y en aquellos con localización primaria del tumor a nivel del colon (frente a la localización rectal), son necesarios nuevos estudios adicionales para confirmar – en su caso – estos extremos. Sea como fuere, se hace necesario conocer el estatus mutacional del gen KRAS antes de iniciar el tratamiento con regorafenib.
En cualquier caso, los datos relativos a la calidad de vida no muestran diferencias significativas con el placebo, lo que hace que la pequeña mejora en términos de eficacia no sea percibida por el propio paciente. A ello, con toda seguridad, contribuye la elevada incidencia de efectos adversos (debilidad, cansancio, anorexia, síndrome mano-pie, diarrea, infecciones, hipertensión y disfonía, etc.), que obliga a tratamientos adicionales, a frecuentes ajustes posológicos (más de la mitad de los pacientes) o incluso a la suspensión definitiva del tratamiento (2-8%).
Por lo que respecta al tratamiento de pacientes con tumores estromales gastrointestinales refractarios o intolerantes al imatinib (tratamiento de elección), los resultados obtenidos en el correspondiente ensayo pivotal muestran una mejora significativa de la supervivencia libre de progresión tumoral, pasando de una mediana de 28 días con placebo a los 147 con regorafenib; es decir, 119 días (4 meses) adicionales, lo que es clínicamente relevante.
Según el Informe de Posicionamiento Terapéutico (AEMPS, 2015), el regorafenib puede representar una opción de tratamiento en los pacientes con cáncer colorrectal metastásico que tengan una expectativa de vida de al menos 3 meses, siempre y cuando se ajusten a los criterios de inclusión del estudio clínico pivotal; es decir, haber sido previamente tratados con quimioterapia con fluoropirimidina, oxaliplatino, irinotecan, bevacizumab y cetuximab o panitumumab (RAS no mutado) a menos que estuviese contraindicado o se hubiese interrumpido el tratamiento por toxicidad inaceptable; asimismo, deben haber experimentado progresión durante o dentro de los tres meses siguientes a la administración de la última terapia y, en el caso de los pacientes tratados con oxaliplatino en adyuvancia, tienen que haber progresado durante o en los 6 meses tras la finalización de la terapia adyuvante. Si el paciente ha progresado tras los 6 meses de la finalización de la adyuvancia, deberá haber sido retratado con una terapia basada en oxaliplatino.
Con todo, el regorafenib es el primer inhibidor de tirosina cinasas (TKI) que demuestra algún grado de beneficio clínico en términos de supervivencia en los pacientes con cáncer colorrectal metastásico con progresión tumoral pese a haber sido intensamente tratados con los medicamentos de referencia actuales (Ettrich, 2014). En esta misma línea, debe valorarse el modesto pero significativo efecto beneficioso en los pacientes con tumores estromales gastrointestinales (GIST) progresivos tras el empleo de imatinib, que presentan un pronóstico manifiestamente desfavorable, hasta el punto de que actualmente no hay opciones contrastadas para esta indicación (Ferraro, 2014).
En definitiva, un nuevo elemento más dentro de la amplia nómina de inhibidores de tirosina cinasas, que aporta un modesto beneficio clínico en condiciones claramente terminales que actualmente carecen de tratamientos bien establecidos.
|
VALORACIÓN |
|
|
REGORAFENIB ► STIVARGA®(Bayer) |
|
|
Grupo Terapéutico (ATC): L01XE. TERAPIA ANTINEOPLÁSICA Y AGENTES INMUNOMODULADORES. Citostáticos: inhibidores directos de la proteína cinasa. |
|
|
Indicaciones autorizadas:Tratamiento de pacientes adultos con cáncer colorrectal metastásico que han sido previamente tratados con las terapias disponibles o no se les considera candidatos adecuados a dichas terapias, incluyendo quimioterapia basada en fluoropirimidinas, terapia anti-VEGF y terapia anti-EFGR; también está indicado en pacientes adultos con tumores del estroma gastrointestinal (GIST) irresecables o metastásicos que progresaron durante el tratamiento previo con imatinib y sunitinib o son intolerantes al mismo. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣ ♣ |
|
Novedad clínica: Mejora la eficacia clínica del tratamiento farmacológico estándar. |
⇑ |
| FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA | |||
| Fármaco | Medicamento® | Laboratorio | Año |
| Imatinib | Glivec | Novartis | 2002 |
| Erlotinib | Tarceva | Roche | 2006 |
| Sunitinib | Sutent | Pfizer | 2007 |
| Dasatinib | Sprycel | Bristol Myers Squibb | 2007 |
| Sorafenib | Nexavar | Bayer | 2007 |
| Lapatinib | Tyverb | Glaxo | 2008 |
| Nilotinib | Tasigna | Novartis | 2008 |
| Gefitinib | Iressa | AstraZeneca | 2010 |
| Pazopanib | Votrient | Glaxo | 2011 |
| Crizotinib | Xalkori | Pfizer | 2014 |
| Vemurafenib | Zelboraf | Roche | 2014 |
| Dabrafenib | Tafinlar | GlaxoSmithKline | 2014 |
| Axitinib | Inlyta | Pfizer | 2014 |
| Afatinib | Giotrif | Boehringer Ingelheim | 2014 |
| Ruxolitinib | Jakavi | Novartis | 2015 |
| Vandetanib | Caprelsa | AstraZeneca | 2015 |
| Regorafenib | Stivarga | Bayer | 2015 |
BIBLIOGRAFÍA
1 Síndrome caracterizado por erupciones exantemáticas y sensación de hormigueo en las palmas de las manos y en las plantas de los pies.Bibliografía
- Agencia Española de Medicamentos y Productos Sanitatios (AEMPS). Informe de Posicionamiento Terapéutico de regorafenib (Stiverga®) en cáncer colorrectal. Fecha de publicación: 4 de marzo de 2015. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-regorafenib-Stivarga.pdf
- Consejo General de Colegios Oficiales de Farmacéuticos.Bot PLUS WEB.https://botplusweb.portalfarma.com/
- Cuéllar Rodríguez S. Sunitinib (Sutent®) en carcinoma de células renales y tumores malignos de estroma gastrointestinal (GIST). Panorama Actual Med. 2007; 31(301): 136-43.
- Cuéllar Rodriguez S. Aflibercept (Zaltrap®) en cáncer de colon. Panorama Actual del Medicamento. 2013; 37(366): 745-50.
- Demetri GD, Reichardt P, Kang YK, Blay JY, Rutkowski P, Gelderblom H, et al; GRID study investigators. Efficacy and safety of regorafenib for advanced gastrointestinal stromal tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013; 381(9863): 295-302. doi: 10.1016/S0140-6736(12)61857-1.
- Ettrich TJ, Seufferlein T. Regorafenib. Recent Results Cancer Res. 2014; 201: 185-96. doi: 10.1007/978-3-642-54490-3_10.
-
European Medicines Agency (EMA). Stivarga®. European Public Assessment Report (EPAR). EMA/571785/2014; EMEA/H/C/002573.
- – http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Assessment_Report_-_Variation/human/002573/WC500173131.pdf
-
– http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002573/WC500149166.pdf
- Ferraro D, Zalcberg J. Regorafenib in gastrointestinal stromal tumors: clinical evidence and place in therapy. Ther Adv Med Oncol. 2014; 6(5): 222-8. doi: 10.1177/1758834014544892.
- Grothey A, Van Cutsem E, Sobrero A, Siena S, Falcone A, Ychou M, et al; CORRECT Study Group. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013; 381(9863): 303-12. doi: 10.1016/S0140-6736(12)61900-X.
- International Agency for Research on Cancer (IARC). GLOBOCAN 2012: Estimated Cancer Incidence, Mortality and Prevalence in 2012; Prediction for 2015. http://globocan.iarc.fr/Pages/burden_sel.aspx
- Lamarca Lete Á, Hindi Muñiz N, Barriuso Feijoó J. Terapéutica del cáncer colorrectal y otros cánceres digestivos. En: Terapéutica farmacológica de los trastornos neoplásicos e inmunológicos. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid; 2011. p. 245-64.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares