Ramucirumab CYRAMZA® (Lilly)
 Nº389
Nº389
Resumen
El ramucirumab es un anticuerpo monoclonal que se une específicamente al receptor tipo 2 del Factor de Crecimiento de Endotelio Vascular (Vascular Endothelial Growth Factor, VEFG), implicado en el desarrollo de diversos tumores. Ha sido autorizado, como medicamento huérfano, en combinación con paclitaxel (o en monoterapia para pacientes en los que el paclitaxel no es apropiado), para el tratamiento de pacientes adultos con cáncer gástrico avanzado o adenocarcinoma de la unión gastroesofágica con progresión de la enfermedad tras quimioterapia previa con platino y fluoropirimidina. El ramucirumab aporta una eficacia clínica modesta pero relevante para el tratamiento de pacientes con cáncer gástrico o de la unión gastroesofágica en fase avanzada o metastásica y con un perfil toxicológico aceptable, todo lo cual viene a reforzar el creciente papel de los agentes biológicos en la terapéutica del cáncer.
CÁNCER GÁSTRICO
El cáncer gástrico es uno de los tumores más frecuentes y representa la tercera causa de muerte por cáncer a nivel mundial, por detrás del cáncer de pulmón y el de hígado. Es especialmente frecuente en países del sudeste asiático, Sudamérica y Europa del Este, siendo más frecuente en varones que en mujeres (relación 2:1). Según la Agencia Internacional para la Investigación sobre el Cáncer (International Agency for Reasearch on Cancer, IARC), de la Organización Mundial de la Salud, se prevé que el número de nuevos casos de cáncer de estómago en 2015 será de un millón en todo el mundo, mientras que el de muertos por este motivo serán aproximadamente unos 785.000. En Europa, el número estimado de nuevos casos en 2015 será de 170.000 y 132.000 el de muertos por este motivo. Finalmente, las estimaciones para España indican que se diagnosticarán en 2015 unos 8.500 nuevos casos de cáncer de estómago (6ª cáncer más común), muriendo por este motivo unas 5.700 personas (3.500 varones y 2.200 mujeres).
Existen dos tipos histológicos de adenocarcinoma gástrico que es importante diferenciar, pues su etiología y comportamiento son distintos (Lamarca, 2011):
- Adenocarcinoma gástrico de tipo intestinal: la infección por Helicobacter pylori y algunos tipos de gastritis autoinmune dan lugar a una gastritis atrófica crónica, en la cual el pH del estómago aumenta y esto facilita la formación una serie de sustancias nocivas para el epitelio; otras situaciones, como el reflujo biliar, tienen consecuencias similares. El resultado de todo ello es que el epitelio normal del estómago se transforma en una mucosa pretumoral (displásica) y se acaba desarrollando tumores.
- Adenocarcinoma gástrico de tipo difuso: es más agresivo y no se conocen lesiones precursoras; es decir, no surge a partir de lesiones displásicas, como en el caso anterior.
Se conocen diversos factores de riesgo ambientales para el desarrollo de cáncer gástrico: el tabaco, la dieta rica en sal y grasas y baja en fibra, la obesidad y el nivel socioeconómico bajo. La presencia de úlceras gástricas o cirugías previas también favorece el desarrollo tumoral y también se conocen síndromes hereditarios (síndrome de Lynch, poliposis adenomatosa familiar, cáncer gástrico difuso hereditario, etc.) relacionados con el cáncer gástrico familiar.
Los pacientes con cáncer gástrico suelen presentar molestias gástricas y pérdida de peso. A veces, si el tumor es muy grande, puede generar problemas obstructivos, provocar náuseas y vómitos, etc. También puede aparecer anemia si el tumor sangra. La carcinomatosis peritoneal consiste en la siembra o diseminación del tumor en el peritoneo y puede provocar obstrucción o ascitis. Se estima (Price, 2012) que la supervivencia a los 5 años es del 24% para el conjunto de todos los pacientes diagnosticados, aunque el pronóstico para aquellos con cáncer gástrico avanzado es un año.
Para la adecuada estadificación de la enfermedad se utilizan las herramientas habituales como el TAC (tomografía axial computadorizada). Para conocer la profundidad exacta del tumor y establecer si es un tumor operable desde el inicio, se realiza la ecoendoscopia. En el cáncer gástrico puede hacer falta la realización de una laparoscopia exploradora para descartar la carcinomatosis peritoneal, que puede no verse ni en el TAC ni en pruebas más sensibles como la tomografía por emisión de positrones (PET, positron emission tomography).
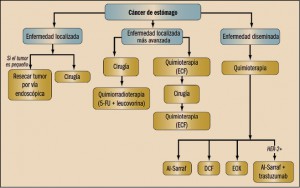
En aquellos pacientes con tumores poco profundos y sin afectación de los ganglios (enfermedad localizada), el tratamiento estándar es la cirugía. En casos seleccionados en los que la lesión sea pequeña (menos de 2 cm, con menos de 1 cm de profundidad) se puede resecar el tumor por vía endoscópica, evitando la agresividad de la cirugía. Sin embargo, en los tumores algo más avanzados, los que atraviesan la capa muscular propia del tejido, o cuando hay ganglios afectados, las opciones más ampliamente utilizadas son la quirúrgica y la farmacológica (quimioterapia), sin que a día de hoy se haya establecido cuál de ellas es superior. Dentro de la opción quirúrgica, se puede optar por una gastrectomía parcial o una total, en función de la extensión de la enfermedad con extirpación de ganglios linfáticos regionales (linfadenectomía), seguida de tratamiento adyuvante con quimiorradioterapia. El fármaco utilizado es el fluorouracilo (5-FU) por vía IV, asociado a ácido folínico1, antes, durante y tras finalizar la radioterapia.
Tras una cirugía correcta (resección completa con bordes libres de afectación tumoral), la supervivencia a largo plazo de los pacientes con enfermedad en estadios iniciales es del 70% aproximadamente. En pacientes con enfermedad más avanzada (afectación de capas profundas del estómago o de ganglios regionales) la supervivencia es del 30%; muchos de estos pacientes sufren recaídas de la enfermedad a nivel local y un tercio de ellos presentarán enfermedad metastásica en algún momento de su evolución. Con el objetivo de reducir esa tasa de recaídas y aumentar la supervivencia de los pacientes, tras la cirugía se plantea tratamiento complementario (adyuvante).
El esquema más ampliamente utilizado en quimioterapia es el ECF – epirubicina-cisplatino-fluorouracilo – antes (neoadyuvancia) y después (adyuvancia) de la cirugía (quimioterapia perioperatoria). El objetivo de esto (generalmente se administran tres ciclos previamente a la cirugía) es reducir al máximo el tamaño del tumor, facilitando con ello la intervención quirúrgica; posteriormente, mediante otros tres ciclos adicionales, se busca disminuir al máximo la tasa de recaídas. Este abordaje tiene las ventajas de reducir el tamaño del tumor – mejorando así los resultados de la cirugía – y ser mejor tolerado que el de la quimioterapia exclusivamente posoperatoria.
En los casos de enfermedad metastásica la cirugía no es curativa, por lo que estos pacientes son tratados en su mayoría exclusivamente con quimioterapia. El esquema de quimioterapia históricamente más activo es cisplatino-fluorouracilo (esquema más conocido como Al-Sarraf y ampliamente utilizado en tumores de cabeza y cuello). No obstante, progresivamente se han ido realizando cambios a este esquema, añadiendo docetaxel (esquema DCF: docetaxel, cisplatino, fluorouracilo), lo que ha incrementado la tasa de respuestas. En lugar de docetaxel, también se han añadido antraciclinas (epirubicina), asimismo con mejorar de la tasa de respuesta; de hecho, éste es el esquema utilizado en la quimioterapia perioperatoria. Sin embargo, este esquema es muy complicado de administrar, fundamentalmente debido a que la infusión IV de fluorouracilo era de 21 días. Para intentar tener un tratamiento más cómodo para el paciente, se ha sustituido el cisplatino por oxalipaltino y el fluorouracilo por la capecitabina, con una mejor tolerancia y facilidad en la administración sin perder la eficacia; por ello, el esquema EOX (epirubicina-oxaliplatino-capecitabina) es otra opción de tratamiento. Por último, aquellos tumores en cuyas células se sobreexpresa el receptor de membrana HER-2 son susceptibles de recibir trastuzumab junto con la quimioterapia, habiendo conseguido mejorar la tasa de respuestas y la supervivencia global.
Los tumores que se forman en el tercio inferior del esófago (los 10 cm próximos al estómago) son adenocarcinomas que, por su localización y comportamiento, son muy similares a los cánceres gástricos, por lo que su manejo es muy parecido al de éstos.
ACCIÓN Y MECANISMO
El ramucirumab es un anticuerpo monoclonal que se une específicamente al receptor tipo 2 del Factor de Crecimiento de Endotelio Vascular (Vascular Endothelial Growth Factor, VEFG), implicado en el desarrollo de diversos tumores. Ha sido autorizado, en combinación con paclitaxel (o en monoterapia para pacientes en los que el paclitaxel no es apropiado), para el tratamiento de pacientes adultos con cáncer gástrico avanzado o adenocarcinoma de la unión gastroesofágica con progresión de la enfermedad tras quimioterapia previa con platino y fluoropirimidina.
Los factores de crecimiento del endotelio vascular A, B, C y D (VEGF-A, VEGF-B, VEGF-C y VEGF-D) forman parte de la familia de factores angiogénicos VEGF, que pueden actuar como potentes factores mitogénicos, quimiotácticos y de permeabilidad vascular para las células endoteliales. Actúan a través de las tirosina cinasas de dos receptores, el VEGFR-1 y el VEGFR-2, presentes en la superficie de las células endoteliales. La activación excesiva de estos receptores por los diferentes VEFG puede dar lugar a una neovascularización patológica y una permeabilidad vascular excesiva, permitiendo la extravasación de macromoléculas desde los vasos tumorales.
El ramucirumab se une selectivamente a los receptores de tipo 2 (VEGFR-2), impidiendo su activación por los ligandos (principalmente VEGF-A, VEGF-C y VEGF-D), lo que da lugar a un bloqueo de la proliferación de células endoteliales, inhibiendo, así, el crecimiento de nuevos vasos (neovasos tumorales) que proporcionan oxígeno y nutrientes al tumor; asimismo, inhibe la proliferación inducida por dichos ligandos, así como la mitogénesis y la migración de células endoteliales.
ASPECTOS MOLECULARES
El ramucirumab es un anticuerpo monoclonal humano de tipo IgG1 que se une específicamente al dominio extracelular del receptor de tipo 2 del VEGF (VEGFR-2). Presenta la característica estructura en forma de Y, constituida por dos cadenas peptídicas pesadas (γ1, con 446 aminoácidos cada una) y otras dos ligeras (κ, con 214 aminoácidos cada una), interconectadas mediante 16 puentes disulfuro (-S-S-), 4 de ellos intercatenarios y 12 intracatenarios. Presenta dos puntos de N-glucosilación (en el aminoácido Asn296 de cada una de las dos cadenas pesadas), pero no presenta O-glucosilación. El peso molecular total del ramucirumab es de 146.756 Da.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad clínicas de ramucirumab han sido adecuadamente contrastadas en las indicaciones autorizadas mediante dos ensayos clínicos de fase 3 (confirmatorios de eficacia y seguridad), aleatorizados, multinacionales, multicéntricos, doblemente ciegos y controlados con placebo, en pacientes adultos con cáncer gástrico avanzado o adenocarcinoma de la unión gastroesofágica con progresión de la enfermedad tras quimioterapia previa con complejos de platino y una fluoropirimidina (mayoritariamente, fluorouracilo, 5-FU). En ambos casos, la variable clínica primaria fue la supervivencia global (periodo transcurrido desde el inicio del tratamiento hasta el fallecimiento, cualquiera que sea su causa); como variables secundarias se determinaron, entre otras, la supervivencia libre de progresión tumoral (tiempo desde el inicio del tratamiento hasta una progresión tumoral objetivamente establecida o la muerte por cualquier causa) y la tasa de respuesta objetiva (proporción de pacientes con una respuesta completa o parcial).
El estudio REGARD (Fuchs, 2014) fue acometido en 119 centros de 29 países en América (norte, centro y sur), Europa, Asia, Australia y África, sobre un total de 355 pacientes, a los que se sometió a monoterapia con ramucirumab, en dosis de 80 mg/kg cada dos semanas (IV). Por su parte, el estudio RAINBOW (Wilke, 2014) fue acometido en 170 centros de 27 países en América (norte y sur), Europa, Asia y Australia, sobre un total de 665 pacientes, a los que se sometió a terapia combinada de ramucirumab (80 mg/kg cada dos semanas) con paclitaxel (80 mg/m2, los días 1, 8 y 15 de cada ciclo de 28), ambos por vía IV.
|
Tabla 1. Estudios clínicos de fase 3 con ramucirumab controlados con placebo |
||
|
Tratamiento |
Monoterapia |
Asociado a Paclitaxel |
|
Nº pacientes (ITT*) |
355 |
655 |
|
Sexo (% varones) |
70% |
71% |
|
Edad (mediana, en años; % |
60 años (36%) |
61 años (37%) |
|
Raza (% blancos) |
77% |
61% |
|
Pérdida de peso ≥10% en los |
17% |
15% |
|
Localización del tumor primario |
Gástrica: 75% Unión gastroesofágica: 25% |
Gástrica: 79% Unión gastroesofágica: 21% |
|
Histología tumoral (% pacientes) |
Intestinal: 25% Difusa: 39% No determinada: 36% |
Intestinal: 42% Difusa: 37% Mixta/No determinada: 21% |
|
Metástasis (% pacientes ≥3 |
34% |
34% |
|
Localización de las metástasis |
Hepática: 45% Peritoneal: 31% |
Hepática: 43% Peritoneal: 47% Nódulos linfáticos: 63% Pulmón: 22% |
|
Supervivencia libre de progresión tumoral meses con el tratamiento previo (% pacientes) |
67% (<6 meses) |
30% (<4 meses) |
|
Supervivencia global (mediana; meses) |
Ramucirumab: 5,2 meses (IC95% 4,4 a 5,7) Placebo: 3,8 meses (IC95% 2,8 a 4,7) Tasa de riesgo: HR=0,78; IC95% 0,60 a 1,00; p=0,0473 |
Ramucirumab: 9,6 meses (IC95% 8,5 a 10,8) Placebo: 7,4 meses (IC95% 6,3 a 8,4) Tasa de riesgo: HR=0,81; IC95% 0,68 a 0,96; p=0,0169 |
|
Supervivencia libre de progresión tumoral (medana; meses) |
Ramucirumab: 2,1 meses (IC95% 1,5 a 2,7) Placebo: 1,3 meses (IC95% 1,3 a 1,4) Tasa de riesgo: HR=0,48; IC95% 0,38 a 0,61; p=0,0483 |
Ramucirumab: 4,4 meses (IC95% 4,2 a 5,3) Placebo: 2,9 meses (IC95% 2,8 a 3,0) Tasa de riesgo: HR=0,64; IC95% 0,54 a 0,75; p<0,0001 |
|
Referencia |
REGARD (Fuchs, 2014) |
RAINBOW (Wilke, 2014) |
* ITT: Análisis estadístico por intención de tratar.
Desde el punto de vista de la seguridad, el ramucirumab presenta un perfil toxicológico moderado, aunque con efectos adversos asociados frecuentes y, algunos, eventualmente graves.
En monoterapia y comparado con placebo (estudio REGARD), la proporción de pacientes con eventos adversos con un grado 3-4 de intensidad ocurridos durante el tratamiento con ramucirumab fue del 57% vs. 58% con placebo, suspendiéndose el tratamiento por este motivo en el 10,5 vs. 6,0%. En concreto, las reacciones adversas más comunes fueron diarrea (14,4% en total y 0,8% de grado 3-4 con ramucirumab vs. 8,7 y 1,7% con placebo), hipertensión (16,1/7,6% vs. 7,8/2,6%), cefalea (9,3/0% vs. 3,5/0%), hiponatremia (5,5/3,4% vs. 1,7/0,9%), neutropenia (4,7/2,1% vs. 0,9/0%), epistaxis (4,7/0% vs. 0,9/0%), erupciones exantemáticas (4,2/0% vs. 1,7/0%), obstrucción intestinal (2,1/1,7% vs. 0/0%) y episodios tromboembólicos arteriales (1,7/1,3% vs. 0/0%).
Por su parte, comparando la combinación de ramucirumab con paclitaxel vs. placebo con paclitaxel (estudio RAINBOW), la proporción de pacientes con eventos adversos con un grado 3-4 de intensidad ocurridos durante el tratamiento con ramucirumab fue del 82% vs. 63%, suspendiéndose el tratamiento por este motivo en el 31 vs. 24%. En concreto, las reacciones adversas más comunes fueron diarrea (57% en total y 12% de grado 3-4 con ramucirumab-paclitaxel vs. 44% y 5,5% con placebo-paclitaxel), neutropenia (54/41% vs. 31/19%), leucopenia (54/41% vs. 21/6,7%), diarrea (32/3,7% vs. 23/1,5%), epistaxis (31/0% vs. 7,0/0%), hipertensión (25/15% vs. 5,8/2,7%), edema periférico (25/1,5% vs. 14/0,6%), estomatitis (20/0,6% vs. 7,3/0,6%), proteinuria (17/1,2% vs. 6,1/0%), trombocitopenia (13/1,5% vs. 6,1/1,8%), hipoalbuminemia (11/1,2% vs. 4,9/0,9%) y hemorragia gastrointestinal (10,1/3,7% vs. 6,1/1,5%).
ASPECTOS INNOVADORES
El ramucirumab es un anticuerpo monoclonal que se une específicamente al receptor tipo 2 del Factor de Crecimiento de Endotelio Vascular (Vascular Endothelial Growth Factor, VEFG), implicado en el desarrollo de diversos tumores. Ha sido autorizado, como medicamento huérfano, en combinación con paclitaxel (o en monoterapia para pacientes en los que el paclitaxel no es apropiado), para el tratamiento de pacientes adultos con cáncer gástrico avanzado o adenocarcinoma de la unión gastroesofágica con progresión de la enfermedad tras quimioterapia previa con platino y fluoropirimidina.
La eficacia ha sido adecuadamente demostrada mediante dos ensayos clínicos aleatorizados, multicéntricos y controlados con placebo, tanto en monoterapia como en asociación al paclitaxel. En monoterapia se ha conseguido un aumento de 1,4 meses de supervivencia global sobre la obtenida con placebo, reduciendo asimismo el riesgo de progresión tumoral en un 52%, con un 40% de los pacientes tratados con ramucirumab libre de progresión tumoral a los 12 meses vs. 16% con placebo. En combinación con paclitaxel los resultados han sido algo mejores2, habiendo conseguido una supervivencia global (mediana) de 2,2 meses más que con paclitaxel solo, reduciendo el riesgo de progresión tumoral en un 37%. En ambos casos, las mejoras conseguidas se apreciaron en varios subgrupos de la población estudiada.
Desde el punto de vista de la seguridad, el ramucirumab presenta un perfil toxicológico moderado, en línea con lo esperado para los anticuerpos monoclonales anti-VEGF, siendo los efectos adversos más comunes fatiga, neutropenia, leucopenia, diarrea, epistaxis e hipertensión. En monoterapia con ramucirumab, la proporción de pacientes con eventos adversos con un grado 3-4 es prácticamente la misma que con placebo, suspendiéndose el tratamiento por este motivo en el 10,5 vs. 6,0%. En combinación de paclitaxel, la proporción de pacientes con eventos adversos con un grado 3-4 con ramucirumab-paclitaxel fue del 82% vs. 63% con paclitaxel solo, suspendiéndose el tratamiento por este motivo en el 31 vs. 24%.
Aunque la mejora de la supervivencia global conseguida con rimucirumab es modesta (1,4 meses en monoterapia y 2,2 meses en combinación con paclitaxel), edbe tenerse presente que actualmente la supervivencia de los pacientes con cáncer gástrico avanzado o metastásico es muy corta (Satolli, 2015). En cualquier caso, se trata del primer fármaco biológico que ha demostrado mejorar significativamente – aunque sea de forma modesta – la supervivencia de los pacientes con cáncer, tanto en monoterapia como en combinación con quimioterapia, en pacientes en los que no se ha determinado la expresión de marcadores oncogénicos, en especial del HER2 (Young, 2015). En este sentido, el trastuzumab, en combinación con capecitabina o fluoracilo y cisplatino, está indicado para el tratamiento de pacientes adultos con adenocarcinoma gástrico o unión gastroesofágica metastásico, HER2-positivo, siempre que no hayan recibido un tratamiento previo para metástasis. Debe tenerse en cuenta que las tasas de positividad de HER2 en cáncer gástrico oscilan entre un 7% y un 43%, por lo que la utilización de tratuzumab en esta indicación requiere procedimientos analíticos adicionales, generalmente mediante tinción inmunohistoquímica (IHQ) e hibridación in situ con fluorescencia (FISH) o hibridación in situ por colorimetría (CISH).
En definitiva, una nueva incorporación que aporta una eficacia clínica modesta pero relevante para el tratamiento de pacientes con cáncer gástrico o de la unión gastroesofágica en fase avanzada o metastásica y con un perfil toxicológico aceptable, todo lo cual viene a reforzar el creciente papel de los agentes biológicos en la terapéutica del cáncer.
|
VALORACIÓN |
|
|
Ramucirumab
|
|
|
Grupo Terapéutico (ATC): L01XC. TERAPIA ANTINEOPLÁSICA Y AGENTES INMUNOMODULADORES. Citostáticos: Anticuerpos monoclonales. |
|
|
Indicaciones autorizadas: En combinación con paclitaxel (o en monoterapia para pacientes en los que el paclitaxel no es apropiado), está indicado para el tratamiento de pacientes adultos con cáncer gástrico avanzado o adenocarcinoma de la unión gastroesofágica con |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales |
♣ ♣ |
|
Novedad clínica: Mejora la eficacia clínica del tratamiento farmacológico estándar. |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Bavacizumab |
Avastin |
Roche |
2005 |
|
Ranibizumab |
Lucentis |
Novartis |
2007 |
|
Aflibercept |
Zaltrap |
Sanofi Aventis |
2013 |
|
Ramucirumab |
Cyramza |
Lilly |
2015 |
BIBLIOGRAFÍA
Bibliografía
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- European Medicines Agency (EMA). Cyranza®. European Public Assessment Report (EPAR). EMA/596202/2014; EMEA/H/C/002829. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002829/WC500180726.pdf
- Fuchs CS, Tomasek J, Yong CJ, Dumitru F, Passalacqua R, Goswami C, et al; REGARD Trial Investigators. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet. 2014; 383(9911): 31-9. doi: 10.1016/S0140-6736(13)61719-5.
- International Agency for Reasearch on Cancer (IARC). World Health Organization. GLOBOCAN 2012; Estimated Cancer Incidence, Mortality and Prevalence in 2012. http://globocan.iarc.fr/Pages/burden_sel.aspx
- Lamarca Lete A, Hindi Muñiz N, Barriuso Feijoó J. Terapéutica del cáncer colorrectal y otros cánceres digestivos. En: Terapéutica farmacológica de los trastornos neoplásicos e inmunológicos. Consejo General de Colegios Oficiales de Farmacéuticos. Madrid; 2011. p. 245-64.
- Price TJ, Shapiro JD, Segelov E, Karapetis CS, Pavlakis N, Van Cutsem, et al. Management of advanced gastric cancer. Expert Rev Gastroenterol Hepatol. 2012; 6(2): 199-209.
- Satolli MA, Buffoni L, Spadi R, Roato I. Gastric cancer: The times they are a-changin’. World J Gastrointest Oncol. 2015; 7(11): 303-16.
- Wilke H, Muro K, Van Cutsem E, Oh SC, Bodoky G, Shimada Y, et al; RAINBOW Study Group. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014; 15(11): 1224-35. doi: 10.1016/S1470-2045(14)70420-6.
- Young K, Smyth E, Chau I. Ramucirumab for advanced gastric cancer or gastro-oesophageal junction adenocarcinoma. Therap Adv Gastroenterol. 2015; 8(6): 373-83. doi: 10.1177/1756283X15592586.
1 El ácido folínico o leucovorina se utiliza, entre otras indicaciones autorizadas, en la modulación bioquímica del fluorouracilo, concretamente para aumentar su actividad citotóxica. El fluorouracilo inhibe la timidilato sintasa (TS), un enzima clave involucrada en la biosíntesis de bases nucleicas pirimidínicas, mientras que el ácido folínico potencia la inhibición de la TS aumentando el depósito intracelular de folatos y estabilizando, por tanto, el complejo fluorouracilo-TS.
2 De hecho, en el informe (EPAR) de la EMA se ha recogido la posición divergente de algunos miembros (minoritarios, en cualquier caso) del CHMP sobre la monoterapia con ramucirumab, en el sentido de que – en opinión de tales miembros – no hay evidencia de que, cuando la combinación con paclitaxel no es apropiada, la monoterapia con ramucirumab sea superior a otra quimioterapia alternativa.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares





