Ombitasvir/Paritaprevir/Ritonavir VIEKIRAX® (Abbvie) y Dasabuvir EXVIERA® (Abbvie)
 Nº383
Nº383
Resumen
Viekirax® es una combinación a dosis fijas de ombitasvir (12,5 mg), paritaprevir (75 mg) y ritonavir (50 mg), en forma de comprimidos; por su parte, Exviera® contiene dasabuvir (250 mg), también en forma de comprimidos. Ambos medicamentos – Viekirax® y Exviera® – se utilizan siempre conjuntamente, formando parte de un tratamiento integrado de la hepatitis C crónica. Todos los fármacos citados son agentes antivirales activos frente al virus de la hepatitis C (VHC), salvo el ritonavir cuya función es la de potenciar la presencia del paritaprevir, reduciendo el ritmo de eliminación de este último. El paritaprevir actúa inhibiendo específicamente el complejo de serina proteasa NS3/4A, el ombitasvir actúa inhibiendo la NS5A, mientras que el ritonavir es utilizado en la formulación únicamente con el objetivo de incrementar la biodisponibilidad global del paritaprevir, bloqueando el metabolismo hepático de este último; por su parte, el dasabuvir actúa inhibiendo selectivamente la proteína NS5B, una ARN polimerasa dependiente del ARN viral, lo que impide la replicación del material genético viral. La eficacia de esta asociación ha sido ampliamente demostrada en pacientes con hepatitis C crónica con VHC de genotipo 1, tanto en pacientes cirróticos como no cirróticos, pretratados o no con ribavirina e interferón alfa. Desde el punto de vista de la seguridad clínica, la asociación presenta un perfil toxicológico muy benigno, al que la ribavirina puede incrementar la incidencia de anemia. El perfil de interacciones es complejo, debido al ritonavir, y debe ser manejado con cuidado, dado el elevado número de medicamentos susceptibles de interaccionar significativamente.
ACCIÓN Y MECANISMO
Viekirax® es una combinación a dosis fijas de ombitasvir (12,5 mg), paritaprevir (75 mg) y ritonavir (50 mg), en forma de comprimidos; por su parte, Exviera® contiene dasabuvir (250 mg), también en forma de comprimidos. Ambos medicamentos – Viekirax® y Exviera® – se utilizan siempre conjuntamente, formando parte de un tratamiento integrado de la hepatitis C crónica. Todos los fármacos citados son agentes antivirales activos frente al virus de la hepatitis C (VHC), salvo el ritonavir cuya función es la de potenciar la presencia del paritaprevir, reduciendo el ritmo de eliminación de este último.
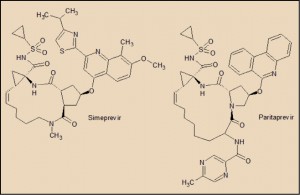
El paritaprevir actúa inhibiendo específicamente el complejo de serina proteasa NS3/4A, lo que impide la replicación viral. La proteína NS3 del VHC es una enzima multifuncional ya que presenta en el primer tercio de su estructura, una actividad de proteasa de serina y en el resto función de ARN helicasa DexH/D que revierte el enrollamiento de cadenas dobles de ARN formadas durante la replicación viral. El extremo NS4A es una proteína que se asocia con las cadenas de NS3 y provoca una reorganización en su estructura, optimizando así la actividad de proteasa de NS3; además NS4A promueve la localización del complejo NS3/4A a la membrana del retículo endoplásmico donde es procesada la poliproteína del VHC. El fármaco es especialmente activo frente a los genotipos 1a, 1b y 4a (con valores CI501 entre 0,16 y 0,43 nM), aunque también tiene efectos significativos sobre los genotipos 2a, 2b y 3a (CI50 entre 2,4 y 14,5 nM). De forma similar a como ocurre con otros inhibidores de la NS3/4A, como el simeprevir, la resistencia del VHC al paritaprevir está directamente relacionada con mutaciones que conducen a determinadas variaciones en la secuencia peptídica de la proteasa NS3, en particular de los aminoácidos localizados en las posiciones 155 y 168. Se considera que el paritaprevir tiene una baja a moderada barrera a la resistencia; de hecho, en la mayoría en los casos de fallo virológico se han registrado cepas variantes resistentes al fármaco.
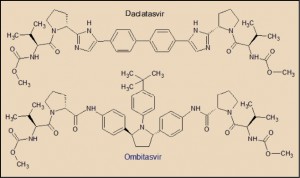
El ombitasvir actúa inhibiendo específicamente la proteína NS5A, alterando su localización subcelular, sus procesos de hiperfosforilación e inhibiendo la síntesis de ARN viral del VHC. La proteína NS5A es una proteína intensamente fosforilada que, una vez escindida de la poliproteína viral, localiza a las membranas donde se une a la fracción 3’-terminal del ARN viral recién sintetizado y participa en la replicación del genoma viral, en parte a través de interacciones con la ARN polimerasa dependiente del ARN viral (NS5B). El ombitasvir presenta una elevada actividad frente a los genotipos 1a (CI50 de 0,014 nM) y 1b (CI50 de 0,005 nM), aunque también es activo prácticamente sobre el resto de genotipos del VHC. Sin embargo, presenta una baja barrera a la resistencia viral, con mutaciones que conducen a determinadas variaciones en la secuencia peptídica de la proteasa NS5A, en particular de los aminoácidos localizados en las posiciones 28, 30 y 93.
El ritonavir es utilizado en la formulación del Viekirax® únicamente con el objetivo de incrementar la biodisponibilidad global del paritaprevir, bloqueando el metabolismo hepático de este último. En concreto, el ritonavir es un potente inhibidor de la isoenzima CYP3A del complejo citocromo P450 (CYP), el cual constituye una vía metabólica fundamental para el paritaprevir.
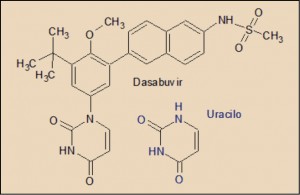
Por su parte, el dasabuvir actúa inhibiendo selectivamente la proteína NS5B, una ARN polimerasa dependiente del ARN viral, lo que impide la replicación del material genético viral. Dicha NS5B es responsable de producir la hebra de ARN complementaria – ARN(-) – que servirá de molde para fabricar las auténticas hebras de ARN viral – ARN(+) –, que a su vez podrán ser de nuevo replicados y traducidas, o bien empaquetados en las proteínas estructurales para formar nuevas partículas virales de VHC, que son liberadas mediante un proceso de exocitosis. El dasabuvir presenta una actividad más marcada frente a los genotipos 1a (CI50 de 2,2 nM) y 1b (CI50 de 10,7 nM), siendo prácticamente inactivo frente al resto de genotipos del VHC (CI50>900 nM). Presenta una baja barrera a la resistencia viral, con mutaciones que conducen a variaciones en la secuencia peptídica de la proteasa NS5B, en particular del aminoácidos localizado en las posición 556.
ASPECTOS MOLECULARES
El paritaprevir presenta una notable semejanza estructural con el simeprevir, igualmente inhibidor de la proteína NS3/4A. Ambos se caracterizan por presentar una estructura química compleja, caracterizado por la presencia de un anillo con un elevado número de eslabones (macrociclo), 14 en el caso del simeprevir y 15 en el paritaprevir. Ambas estructuras también presenta una insaturación en el anillo, del que forman parte, asimismo, dos estructuras anulares (un ciclopropano y un ciclopentano o una pirrolidina) que quedan integradas en el macrociclo.
Por su parte, el ombitasvir guarda un claro paralelismo estructural con el daclatasvir y ledipasvir, todos ellos inhibidores de la proteína NS5A del VHC. Presentan una característica estructura simétrica (daclatasvir y ombitasvir) o casi simétrica (ledipasvir), en la que destaca un núcleo central de alta densidad electrónica, el cual facilita la unión a la proteína NS5A, estabilizando su estructura y bloqueando sus funciones. Asimismo, se aprecian sendas estructuras en los extremos de la molécula que emulan secuencias peptídicas (son, en realidad, carbamatos), que facilitan la inserción del fármaco en los huecos (bolsillos) de la proteína NSA5.
Finalmente, el dasabuvir presenta una estructura que contiene un resto de uracilo, una de las cuatro bases nucleicas que constituyen el ARN; en este sentido, está relacionado estructuralmente con el sofosbuvir, también inhibidor de la proteína NS5B, como el dasabuvir. Ambos actúan como una falsa base nucleica que es capaz de bloquear a la ARN polimerasa dependiente del ARN viral, provocando la finalización prematura del proceso de replicación y, con ello, deteniendo la reproducción del VHC.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad de la combinación de Viekirax® y Exviera® hepatitis C crónica han sido contrastadas mediante seis ensayos clínicos principales de fase III, abiertos y aleatorizados, incluyendo un total de 2.308 pacientes con genotipo 1 (1a y 1b). Tres de los estudios fueron llevados a cabo en pacientes no tratados previamente (naïve) y sin cirrosis (SAPPHIRE-I, PEARL-III y PEARL-IV), 2 estudios en pacientes pretratados con peginterferón alfa y ribavirina y sin cirrosis (SAPPHIRE-II y PEARL-II) y un estudio en pacientes con cirrosis compensada que incluye tanto pacientes naïve como pacientes con tratamiento previo con peginterferón alfa y ribavirina (TURQUOISE-II).
En todos los casos, la variable primaria de eficacia utilizada fue la tasa de pacientes con respuesta virológica sostenida, es decir, aquellos con niveles séricos de menos de 25 copias/ml de ARN del VHC, medidos 12 semanas después de haber finalizado el tratamiento completo antiviral (RVS12). La pauta posológica oral empleada fue de 25 mg ombitasvir, 150 mg de paritaprevir y 100 mg de ritonavir (dos comprimidos al día de Viekirax®), una vez al día, y 250 mg de dasabuvir (un comprimido de Exviera®) cada 12 horas. En todos los casos se utilizó ribavirina (1000-1200 mg/día, según peso) o un placebo, salvo en el estudio TURQUOISE-II, en el que todos los pacientes recibieron ribavirina. La duración del tratamiento fue en todos los casos de 12 semanas, salvo en el vaso del estudio TURQUOISE-II, en el que se compararon pautas de 12 y de 24 semanas de duración.
En cuanto a las características demográficas y fisiopatológicas de estos estudios, la proporción de varones osciló entre un 46% y un 70%, un 84-94% eran de etnia caucásica, la mediana de edad osciló entre 49 y 58 años, con un 4-17% mayores de 64 años; el nivel de fibrosis hepática entre los pacientes era bajo, con un 64-77% de pacientes con niveles F0 o F1 (salvo el estudio TURQUOISE-II, en el que el 100% de los pacientes eran cirróticos: F4). La viremia media era de 6,31-6,57 log10 (2,04-3,72.106 virus/ml).
Pacientes no cirróticos y no tratados previamente (naïve)
El estudio SAPPHIRE-I (Feld, 2014) incluyó a 631 pacientes, de los que un 57% eran varones, un 91% eran caucásicos, tenían una mediana de edad de 49 años (un 19% tenía más de 64 años), un 77% tenían un grado de fibrosis hepática F0 o F1 y la viremia media era de 6,42 log10 (2,63.106 virus/ml). La tasa global de respuesta viral sostenida en el grupo de la ribavirina fue del 96,5% (IC95% 94,5 a 97,9); específicamente, en los pacientes con VHC 1a fue del 95,3% y en aquellos con 1b fue del 98,0%.
Por su parte, el estudio PEARL-III (Ferenci, 2014) incluyó a 431 pacientes con VHC de genotipo 1b, de los que un 46% eran varones, un 94% eran caucásicos, tenían una mediana de edad de 50 años (un 8% tenía más de 64 años), un 70% tenían un grado de fibrosis hepática F0 o F1 y la viremia media era de 6,31 log10 (2,04.106 virus/ml). La tasa global de respuesta viral sostenida en el grupo de la ribavirina fue del 99,5%, frente al 99,0% sin ribavirina.
Finalmente, el estudio PEARL-IV (Ferenci, 2014) incluyó a 305 pacientes con VHC de genotipo 1a, de los que un 65% eran varones, un 84% eran caucásicos, tenían una mediana de edad de 54 años (un 8% tenía más de 64 años), un 64% tenían un grado de fibrosis hepática F0 o F1 y la viremia media era de 6,57 log10 (3,72.106 virus/ml). La tasa global de respuesta viral sostenida en el grupo de la ribavirina fue del 97,0%, frente al 90,2% sin ribavirina.
Pacientes no cirróticos pero tratados previamente
El estudio SAPPHIRE-II (Zeuzem, 2014) incluyó a 394 pacientes, de los que un 56% eran varones, un 91% eran caucásicos, tenían una mediana de edad de 54 años (un 17% tenía más de 64 años), un 67% tenían un grado de fibrosis hepática F0 o F1 y la viremia media era de 6,55 log10 (3,55.106 virus/ml). La tasa global de respuesta viral sostenida en el grupo de la ribavirina fue del 96,3% (IC95% 94,2 a 98,4); específicamente, fue del 95,3% en los pacientes que habían experimentado previamente una recaída tras el éxito inicial con ribavirina/interferón alfa y del 95,2% en los refractarios a este desde el principio.
Por otro lado, el estudio PEARL-II (Andreone, 2014) incluyó a 179 pacientes con VHC de genotipo 1b, de los que un 55% eran varones, un 91% eran caucásicos, tenían una mediana de edad de 54 años (un 17% tenía más de 64 años), un 67% tenían un grado de fibrosis hepática F0 o F1 y la viremia media era de 6,52 log10 (3,31.106 virus/ml). La tasa de respuesta viral sostenida en el grupo de la ribavirina fue del 96,6% (IC95% 92,8 a 100) y en el grupo sin ribavirina fue del 100% (IC95% 95,9 a 100).
Pacientes cirróticos
El estudio TURQUOISE-II (Poordad, 2014) incluyó a 380 pacientes cirróticos (F4), de los que un 70% eran varones, un 95% eran caucásicos, tenían una mediana de edad de 58 años (un 13% tenía más de 64 años) y con una viremia media de 6,47 log10 (2,95.106 virus/ml). La tasa global de respuesta viral sostenida tras 12 semanas de tratamiento fue del 91,8% (IC97,5% 87,6 a 96,1). Específicamente, con VHC de genotipo 1a fue del 92,2% en los pacientes naïve y del 88,9% en los pretratados (93,3% en los que habían experimentado recaídas y 80% en los completamente refractarios); con VHC de genotipo 1b la tasa de respuesta fue del 100% en los pacientes naïve y del 97,8% en los pretratados (100% en los que habían experimentado recaídas y 96,9% en los parcial o completamente refractarios).
La tasa global de respuesta viral sostenida tras 24 semanas de tratamiento fue del 95,9% (IC97,5% 92,6 a 99,3). Específicamente, con VHC de genotipo 1a fue del 92,9% en los pacientes naïve y del 94,2% en los pretratados parcial o completamente refractarios; en aquellos con VHC 1b fue del 100% tanto en los pacientes naïve como en los pretratados.
Seguridad
La asociación de la combinación ombitasvir/paritaprevir/ritonavir y de la dasabuvir presenta un perfil toxicológico muy benigno, con una incidencia de eventos adversos graves de grado 3-4 del 2% (sin rabavirina) y del 3% (con ribavirina); en los estudios clínicos solo se suspendió el tratamiento por este motivo en el 0,4% (sin rabavirina) y 0,3% (con ribavirina) de los pacientes. Los eventos adversos más comunes fueron de carácter leve y transitorio: fatiga, astenia, cefalea, náusea, diarrea, prurito y exantema. La incidencia de anemia aumentó sustancialmente con la adición de ribavirina, observándose en un 6,7% sin ésta (en todos los casos, anemia leve) y en un 56% con ella (un 5% moderada o grave).
El perfil de interacciones de la asociación es compleja, debido fundamentalmente a la presencia del ritonavir, un reconocido inhibidor del citocromo CYP3A y de otros isoenzimas del citocromo P450 (CYP), que puede afectar al metabolismo hepático de numerosos medicamentos.
ASPECTOS INNOVADORES
Viekirax® es una combinación a dosis fijas de ombitasvir (12,5 mg), paritaprevir (75 mg) y ritonavir (50 mg), en forma de comprimidos; por su parte, Exviera® contiene dasabuvir (250 mg), también en forma de comprimidos. Ambos medicamentos – Viekirax® y Exviera® – se utilizan siempre conjuntamente, formando parte de un tratamiento integrado de la hepatitis C crónica. Todos los fármacos citados son agentes antivirales activos frente al virus de la hepatitis C (VHC), salvo el ritonavir cuya función es la de potenciar la presencia del paritaprevir, reduciendo el ritmo de eliminación de este último.
El paritaprevir actúa inhibiendo específicamente el complejo de serina proteasa NS3/4A, el ombitasvir actúa inhibiendo la NS5A, mientras que el ritonavir es utilizado en la formulación únicamente con el objetivo de incrementar la biodisponibilidad global del paritaprevir, bloqueando el metabolismo hepático de este último. Por su parte, el dasabuvir actúa inhibiendo selectivamente la proteína NS5B, una ARN polimerasa dependiente del ARN viral, lo que impide la replicación del material genético viral.
La eficacia de esta asociación ha sido ampliamente demostrada en pacientes con hepatitis C crónica con VHC de genotipo 1, tanto en pacientes cirróticos como no cirróticos, pretratados o no con ribavirina e interferón alfa. En este sentido, tras 12 semanas de tratamiento en pacientes no cirróticos con HCV 1a naïve la tasa de respuesta viral sostenida es del 99% (con o sin ribavirina), mientras que en pacientes insatisfactoriamente tratados previamente se alcanzaron tasas del 100% y 96,7% sin y con ribavirina, respectivamente. En los cuadros ligados a VHC de genotipo 1b, las tasas de respuesta en pacientes naïve son del 90,2% y 95,7% sin y con ribavirina, respectivamente, mientras que en pretratados sin respuesta satisfactoria es del 96,0% con ribavirina.
Por lo que respecta a pacientes cirróticos (en los que se utilizó también ribavirina conjuntamente), la tasa de respuesta en los pacientes con VHC 1a es del 100%, tanto en naïve como en no respondedores previamente, igualmente en tratamientos de 12 y de 24 semanas. Por lo que respecta a los cuadros ligados al VHC de genotipo 1b, las tasas de respuesta en pacientes naïve fueron del 92,2% y 92,9% a 12 y 24 semanas, respectivamente. Estas tasas fueron en pacientes previamente no respondedores del 85,5% (12 semanas) y 95,4% (24 semanas).
Desde el punto de vista de la seguridad clínica, la asociación de la combinación ombitasvir/paritaprevir/ritonavir y de la dasabuvir presenta un perfil toxicológico muy benigno, al que la ribavirina puede incrementar la incidencia de anemia. En cualquier caso, incluso con ribavirina, menos del 0,5% de los pacientes tienen que suspender el tratamiento por motivos toxicológicos. El perfil de interacciones es complejo, debido al ritonavir, y debe ser manejado con cuidado, dado el elevado número de medicamentos susceptibles de interaccionar significativamente.
Esta terapia basada en la asociación de un medicamento combinado a dosis fijas (ombitasvir/paritaprevir/ritonavir) con otro medicamento independiente (dasabuvir) está indicada especialmente, en igualdad de condiciones con otros tratamientos en pacientes (no hay estudios clínicos directamente comparativos) en pacientes con hepatitis C crónica infectados con VHC de genotipo 1 que han sido tratados previamente y recayeron posteriormente con terapia triple (peginterferón alfa, ribavirina y boceprevir o telaprevir) o no habían sido tratados con ésta. Su utilización en cuadros ligados al genotipo 4 del VHC también es aceptable. Asimismo, la asociación está indicada en pacientes con VHC de genotipo 1 y 4 con cirrosis, en aquellos con requerimiento de trasplante hepático y en los trasplantados hepáticos con recidiva.
La terapia combinada es la primera de las combinaciones a dosis fijas de inhibidores de NS3/NS4A (paritapravir) y de NS5A (ombitasvir; Viekirax®) en ser comercializada, usada conjuntamente con un inhibidor de NS5B (dasabuvir; Exviera®), aunque hay otras combinaciones a dosis fijas NS5A y NS5B (ledipasvir/sofosbuvir; Harvoni®). En principio, la justificación clínica de las combinaciones a dosis fijas es optimizar la adherencia al tratamiento, aunque en otros casos también se buscan efectos (interacciones entre los componentes, como el ritonavir sobre el paritaprevir) que optimicen el perfil farmacocinético de los fármacos.
La selección del mejor tratamiento en función del genotipo de VHC y de las condiciones clínicas de cada paciente (pretratamiento o no con antivirales de acción directa, cirrosis, trasplante hepático, etc.) se enfrenta a un conjunto de opciones, entre las que no es posible distinguir actualmente la más adecuada – en términos estrictamente clínicos y científicos – porque no se dispone de estudios clínicos directamente comparativos; pero, además, no lo es porque los niveles de eficacia y seguridad actualmente conseguidos son muy difíciles de superar.
Un ejemplo de esto último es la combinación de daclatasvir (Daklinza®, también inhibidor de la NS5A, como el ledipasvir) y sofosbuvir, que en pacientes con VHC de genotipo 1a/1b insatisfactoriamente pretratados o no tratados previamente, ontiene tasas de respuesta a las 12 y a las 24 semanas del 98-100% (Sulkowski, 2014); otro tanto puede decirse de la combinación entre simeprevir (Olysio®, inhibidor de la NS3/4A) y sofosbuvir, con tasas de respuesta del 92-94% en pacientes con hepatitis C crónica por VHC de genotipo 1 no pretratados o que previamente no habían respondido a peginterferón alfa y ribavirina (Lawitz, 2014).
Tal como se ha descrito en el artículo precedente, dedicado a la combinación ledipasvir/sofosbuvir (Harvoni®), los datos clínicos de ésta también muestran una elevada eficacia en pacientes con hepatitis crónica infectados con VHC de genotipo 1, con tasas superiores al 97% en pacientes no pretratados (naïve), con o sin cirrosis compensada, con tratamientos de 12 semanas de duración y con independencia del uso de ribavirina. Incluso, en pacientes naïve sin cirrosis se han alcanzado tasas del 94% con 8 semanas de tratamiento vs. 95% con 12 semanas. En pacientes pretratados insatisfactoriamente, las tasas de respuesta viral sostenida son del 94% (12 semanas) y 99% (24 semanas). Considerados globalmente, en los pacientes con cirrosis compensada se obtienen también resultados excelentes (95% con 12 semanas y 98% con 24 semanas). También se han obtenido altas tasas de respuesta en pacientes coinfectados con VHC y VIH.
Actualmente, más del 90% de los pacientes infectados con los genotipo 1 o 4 del VHC, con o sin cirrosis compensada o que hayan tenido un trasplante de hígado, pueden curarse mediante el uso de sofosbuvir combinado con simeprevir, daclatasvir o ledipasvir, o por la combinación de paritaprevir con ritonavir, ombitasvir y dasabuvir; incluso la adición de ribavirina parece acortar la duración del tratamiento. Sin embargo, la seguridad de estos fármacos no ha sido plenamente establecida en pacientes con cirrosis descompensada, por lo que no se aconseja el uso de los inhibidores de la proteasa en este grupo. Actualmente se está estudiando la utilización óptima de los regímenes sin interferón en pacientes con insuficiencia renal o después de un trasplante de riñón. Sin embargo, se necesitan nuevos y mejores medicamentos para el tratamiento de pacientes infectados con el genotipo 3 del VHC (Ferenci, 2015), lo que resulta relevante dado que en España el genotipo 3 está presente en el 20% de los casos de hepatitis C.
Por todo ello, en el mismo sentido de lo comentado para la combinación de ledipasvir/sofosbuvir (Harvoni®), la asociación de la combinación ombitasvir/paritaprevir/ritonavir (VIekirax®) con dasabuvir (Exviera®) no parece suponer una innovación significativa, aun teniendo en cuenta los elevadísimos niveles de eficacia y seguridad clínicas que presenta; en definitiva, se trata de una opción más a considerar en un ámbito donde existen ya varios fármacos que, asociados entre sí, presentan niveles muy altos de eficacia y de seguridad, en cualquier caso similares utilizando una misma vía y pauta posológica. Otra cosa diferente son los efectos económicos que cada uno de ellos produzca al competir en términos de coste de los tratamientos.
|
VALORACIÓN |
|
|
|
|
|
Grupo Terapéutico (ATC): J05AE. ANTIINFECCIOSOS SISTÉMICOS. Antivirales de acción directa: inhibidores de la proteasa. |
|
|
Indicaciones autorizadas: Tratamiento de la hepatitis C crónica en adultos. |
|
|
VALORACIÓN GLOBAL: INNOVACIÓN MODERADA. Aporta algunas mejoras, pero no implica cambios sustanciales en la terapéutica estándar. |
♣♣ |
|
Novedad clínica: Mejora la eficacia clínica del tratamiento farmacológico estándar |
⇑ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA |
|||
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Boceprevir |
Victrelis |
Merck Sharp Dohme |
2011 |
|
Telaprevir |
Incivo |
Janssen Cilag |
2011 |
|
Simeprevir |
Olysio |
Janssen Cilag |
2014 |
|
Sofosbuvir |
Sovaldi |
Gilead |
2014 |
|
Daclatasvir |
Daklinza |
Bristol-Myers Squibb |
2015 |
|
Ledipasvir/Sofosbuvir |
Harvoni |
Gilead |
2015 |
|
Ombitasvir/Paritaprevir/Ritonavir |
Viekirax |
Abbvie |
2015 |
|
Dasabuvir |
Exviera |
Abbvie |
2015 |
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de posicionamiento terapéutico de Viekirax® (ombitasvir/parataprevir/ritonavir) y Exviera® (dasabuvir). Fecha de publicación: 20 de marzo de 2015; fecha de corrección: 14 de abril de 2015. http://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-viekirax-exviera.pdf
- Andreone P, Colombo MG, Enejosa JV, Koksal I, Ferenci P, Maieron A, et al.ABT-450, ritonavir, ombitasvir, and dasabuvir achieves 97% and 100% sustained virologic response with or without ribavirin in treatment-experienced patients with HCV genotype 1b infection. Gastroenterology. 2014; 147(2): 359-365.e1. doi: 10.1053/j.gastro.2014.04.045.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- European Medicines Agency (EMA). Exviera®.European Public Assessment Report (EPAR). EMA/733671/2014; EMEA/H/C/003837. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003837/WC500182235.pdf
- European Medicines Agency (EMA). Viekirax®.European Public Assessment Report (EPAR). EMA/733678/2014; EMEA/H/C/003839. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003839/WC500183999.pdf
- Feld JJ, Kowdley KV, Coakley E, Sigal S, Nelson DR, Crawford D, et al.Treatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin. N Engl J Med. 2014; 370(17): 1594-603. doi: 10.1056/NEJMoa1315722.
- Ferenci P, Bernstein D, Lalezari J, Cohen D, Luo Y, Cooper C, et al; PEARL-IV Study.ABT-450/r-ombitasvir and dasabuvir with or without ribavirin for HCV. N Engl J Med. 2014; 370(21): 1983-92. doi: 10.1056/NEJMoa1402338.
- Ferenci P).Treatment of hepatitis C in difficult-to-treat patients. Nat Rev Gastroenterol Hepatol. 2015 Apr 21. doi: 10.1038/nrgastro.2015.53.
- Lawitz E, Sulkowski MS, Ghalib R, Rodriguez-Torres M, Younossi ZM, Corregidor A, et al.Simeprevir plus sofosbuvir, with or without ribavirin, to treat chronic infection with hepatitis C virus genotype 1 in non-responders to pegylated interferon and ribavirin and treatment-naive patients: the COSMOS randomised study. Lancet. 2014; 384(9956):1756-65. doi: 10.1016/S0140-6736(14)61036-9.
- Poordad F, Hezode C, Trinh R, Kowdley KV, Zeuzem S, Agarwal K, et al.ABT-450/r-ombitasvir and dasabuvir with ribavirin for hepatitis C with cirrhosis. N Engl J Med. 2014; 370(21): 1973-82. doi: 10.1056/NEJMoa1402869.
- Sulkowski MS, Gardiner DF, Rodriguez-Torres M, Reddy KR, Hassanein T, et al; AI444040 Study Group.Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. N Engl J Med. 2014; 370(3): 211-21. doi: 10.1056/NEJMoa1306218.
- Zeuzem S, Jacobson IM, Baykal T, Marinho RT, Poordad F, Bourlière M, et al Retreatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin. N Engl J Med. 2014; 370(17): 1604-14. doi: 10.1056/NEJMoa1401561.
1 EC50% es la concentración efectiva para inhibir el 50% de los virus.
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares