Olodaterol STRIVERDI RESPIMAT® (Boehringer Ingelheim)
 Nº381
Nº381
Resumen
El olodaterol es un agonista de acción prolongada de los receptores β2 adrenérgicos que ha sido autorizado para el tratamiento broncodilatador de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica (EPOC). Ha sido objeto de varios ensayos clínicos controlados con placebo y con comparadores activos (formoterol y tiotropio), mostrando una respuesta sobre los FEV1 pico y valle sustancial, mejorando en más de 100 ml, valor considerado como el umbral de la significación clínica. En este sentido, los efectos son equiparables a los de otros broncodilatadores de larga duración, tanto adrenérgicos (formoterol, indacaterol) como anticolinérgicos (tiotropio). El perfil de seguridad de la combinación está en línea con el de otros fármacos de esta familia y no se han observado eventos adversos específicos; en cualquier caso, la incidencia no es elevada y raramente es motivo de suspensión del tratamiento. El olodaterol requiere una única administración diaria, como el vilanterol, y como éste también ha demostrado producir efectos conjuntos con los anticolinérgicos broncodilatadores (tiotropio, glicopirronio, aclidinio) superiores a los producidos por cada agente por separado.
ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA (EPOC)
Según la guía GOLD (Global Initiative for Chronic Obstructive Lung Disease; GOLD, 2011), la EPOC es una entidad prevenible y tratable, caracterizada por una limitación persistente al flujo aéreo, generalmente progresiva y asociada a una respuesta inflamatoria exagerada de las vías aéreas y del parénquima pulmonar frente a partículas o gases nocivos. La limitación crónica al flujo aéreo se asocia, sobre todo, con el humo del tabaco como causa fundamental. Esta definición no utiliza los términos de enfisema1 y de bronquitis crónica2, y excluye el asma (que implica una limitación reversible al flujo aéreo). Los síntomas principales la EPOC son la disnea, la tos crónica y la expectoración crónica.
La prevalencia de la EPOC en España es similar a la encontrada en otros países europeos y en los Estados Unidos. Concretamente, en España es del 10% de la población entre 40 y 80 años; es decir, la EPOC afectaría a más de 2 millones de personas, que representan al 15 % de los varones y al 6% de las mujeres. En España, la EPOC representa la cuarta causa de mortalidad, con una tasa global de 33/100.000 habitantes, que aumenta a 176/100.000 habitantes en población de más de 75 años, e incluso algunos estudios señalan que pasará a ser la tercera causa de mortalidad para el 2020. Se trata, por tanto, de un problema clínico relevante, con importantes repercusiones socioeconómicas, lo que lo convierte en un importante problema de salud pública, que merece todo el interés de profesionales y autoridades sanitarias. La mayoría de los casos de EPOC están asociados al consumo de cigarrillos, si bien sólo el 15-20% de los fumadores desarrollan esta patología debido a diferencias en susceptibilidad de naturaleza aún desconocida, aunque se piensa que tienen una base genética o quizás ambiental.
Desde el punto de vista funcional, la resistencia al flujo aéreo en la EPOC contribuyen:
- La disminución de la luz bronquial por el engrosamiento de la pared y la hipersecreción de mucinas.
- La contracción de la musculatura lisa de las vías aéreas.
- La pérdida de elasticidad del parénquima pulmonar.
Los parámetros funcionales respiratorios más habitualmente utilizados en la descripción clínica de la EPOC son:
- Capacidad Vital (CV): volumen máximo de aire que el sujeto es capaz de inspirar y espirar en condiciones no forzadas, y corresponde a la suma VC + VRI +VRE:
- Volumen corriente (VC): cantidad de aire empleado en cada respiración (inspiración y espiración) normal (no forzada), lo que da idea del volumen de aire circulado en cada ciclo respiratorio. Habitualmente, el valor expresado representa el aire espirado, que no corresponde exactamente al inspirado, por ser un valor generalmente más estable que el inspirado. En término medio es de 0,5 litros.
- Volumen de Reserva Inspiratoria (VRI): máximo volumen de aire que puede ser inspirado. Se sitúa habitualmente en torno a 3 litros (con las consiguientes diferencias entre grupos de edad, desarrollo, etc.).
- Volumen de Reserva Espiratoria (VRE): volumen máximo de aire que es espirado en condiciones normal (sin forzar la respiración). En término medio, se sitúa sobre 1,7 l.
- Capacidad Vital Forzada (CVF): es el equivalente a la capacidad vital (CV), pero en condiciones forzadas y con la máxima rapidez que el sujeto pueda.
- Volumen Espiratorio Forzado en 1 segundo (VEF1): volumen de aire exhalado durante el primer segundo de una espiración forzada (máxima). Se considera como un parámetro fundamental para el diagnóstico y control de la evolución clínica de la EPOC. El diagnóstico clínico de EPOC implica la existencia de un cociente FEV1/CVF posbroncodilatador fijo de menos de 0,70. Una variante de este parámetro es el VEF1%, la fracción correspondiente del VEF1 entre la Capacidad Vital (CV), expresándolo en términos porcentuales (VEF1% = [VEF1/CV] x 100).
La gravedad de la limitación al flujo aéreo en la EPOC se categoriza en cuatro estadios o niveles:
- GOLD1 (leve): FEV1 ≥80% del valor de referencia.
- GOLD2 (moderada): FEV1: 50-79% del valor de referencia
- GOLD3 (grave): FEV1: 30-49% del valor de referencia
- GOLD4 (muy grave): FEV1 <30% del valor de referencia
Las exacerbaciones en EPOC se definen como un episodio agudo caracterizado por un empeoramiento de los síntomas respiratorios más allá de la variabilidad diaria, que obliga a un cambio del tratamiento habitual. El riesgo de exacerbaciones aumenta de forma proporcional al deterioro de la limitación al flujo aéreo.
En contraposición al asma bronquial, que es una inflamación eosinofílica crónica con obstrucción reversible de vías aéreas, la EPOC presenta un perfil de inflamación neutrofílica crónica con obstrucción no reversible. Los estudios histopatológicos muestran una implicación predominante de las vías respiratorias (bronquiolos) y del parénquima pulmonar, mientras que el asma implica inflamación de todas las vías respiratorias, aunque normalmente sin implicación del parénquima pulmonar. Existe una obstrucción de los bronquiolos, con fibrosis e infiltración con macrófagos y linfocitos T. Se produce la destrucción del parénquima pulmonar y un aumento de macrófagos y linfocitos T, con un mayor aumento de células CD8+ (citotóxicas) en comparación con las células CD4+ (coadyuvantes).
Cualquier opción terapéutica en la EPOC debe pasar por el abandono radical e inmediato del hábito tabáquico en el paciente, habida cuenta su decisivo papel en el origen y progresión de la enfermedad. Junto con el abandono definitivo del tabaquismo, la oxigenoterapia continua domiciliaria cuando la situación lo requiera3, son los dos elementos básicos para frenar la progresión de la enfermedad. El alivio sintomático y la mejoría de la calidad de vida se obtienen mediante el empleo de agentes broncodilatadores, la rehabilitación respiratoria y el soporte ventilatorio domiciliario (Cortijo, 2014).
La prevención de las exacerbaciones o reagudizaciones también es el objetivo de la utilización de broncodilatadores y de corticosteroides en inhalación.
Cuando las terapias farmacológicas y rehabilitadoras no son suficientes, se recurre a la cirugía de reducción pulmonar o, incluso, al trasplante. Cuando hay disnea o intolerancia al ejercicio físico, se recomienda el uso de agentes broncodilatadores de acción corta, en inhalación. La elección de agonistas beta2-adrenérgicos (salbutamol, terbutalina, etc.) o de anticolinérgicos (ipratropio) depende de la respuesta y de la incidencia de efectos adversos en cada paciente (Cuéllar, 2014). En caso de exacerbaciones o disnea persistente con la terapia anterior, las opciones dependen del grado de limitación del flujo respiratorio:
- FEV1 ≥ 50%: Las alternativas son
- Agonista beta2-adrenérgico de larga duración (indacaterol, formoterol, salmeterol, vilanterol, etc.), manteniendo el uso de los de acción corta, a demanda. En caso de falta de respuesta adecuada, puede añadirse un corticosteroide en inhalación, o un anticolinérgico de acción prolongada en inhalación en caso de baja respuesta o intolerancia al corticosteroide.
- Anticolinérgico de acción prolongada (tiotropio, etc.), descontinuando el uso de anticolinérgicos de acción corta. En caso de respuesta inadecuada, puede combinarse con un agonista beta2-adrenérgico de larga duración y un corticosteroide, todos ellos en inhalación.
- FEV1 ≤ 50%: Se aconseja el tratamiento sostenido con corticosteroides inhalados.
- Agonista beta2-adrenérgico de larga duración (indacaterol, formoterol, salmeterol, vilanterol, etc.) más un corticosteroide en inhalación, o un anticolinérgico de acción prolongada en inhalación en caso de baja respuesta o intolerancia al corticosteroide.
- Anticolinérgico de acción prolongada (tiotropio, etc.), descontinuando el uso de anticolinérgicos de acción corta. En caso de respuesta inadecuada, puede combinarse con un agonista beta2-adrenérgico de larga duración y un corticosteroide, todos ellos en inhalación.
Solo cuando la terapia inhalada sea insuficiente para mantener la calidad de vida de los pacientes, se debe recurrir a la terapia sistémica (oral o parenteral):
- Corticosteroides: no se recomienda su uso continuado en EPOC, salvo en aquellos casos en que no puede suspenderse el tratamiento, tras una exacerbación.
- Teofilina: Puede usarse en combinación con agonistas beta2-adrenérgicos y anticolinérgicos, teniendo siempre presente el amplio espectro de interacciones farmacológicas de este agente. Además, son menos efectivas y peor toleradas que los broncodilatadores en inhalación.
- Mucolíticos: Se considera aceptable su uso en pacientes con tos crónica productiva, siempre que produzcan una mejora sintomática apreciable. No se recomienda su uso para la prevención de las exacerbaciones.
- Inhibidores selectivos de la fosfodiesterasa 4 (PDE4): Roflumilast es un fármaco que es capaz de reducir la incidencia de exacerbaciones graves o muy graves en pacientes con EPOC e historial de exacerbaciones frecuentes.
- La vacuna de la gripe puede reducir la gravedad y la mortalidad de la EPOC. Por su parte, la neumocócica (polisacarídica) es aconsejable en pacientes con EPOC mayores de 65 años; además, también es útil (reduce el riesgo de neumonía) en pacientes más jóvenes con un FEV1 <40% del valor de referencia.
El pronóstico de los pacientes con EPOC depende del grado de obstrucción al flujo aéreo y del abandono del consumo de tabaco. La tasa de mortalidad a los 10 años de establecido el diagnóstico es superior al 50%. La evolución o historia natural de la EPOC sigue un curso lento, pero inexorable, en el que pueden sobrevenir episodios de exacerbación, con desarrollo de insuficiencia respiratoria e hipercapnia potencialmente graves, incluso mortales, que constituyen, por tanto, una urgencia médica en potencia.
ACCIÓN Y MECANISMO
El olodaterol es un agonista de acción prolongada de los receptores β2 adrenérgicos que ha sido autorizado para el tratamiento broncodilatador de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
El olodaterol presenta una elevada afinidad hacia los receptores β2 adrenérgicos, similar a la de vilanterol y salmeterol, pero superior a la del formoterol e indacaterol; igualmente, la selectividad relativa para receptores β2 adrenérgicos (240 veces mayor que para los β1 y 2.300 veces que para β3) es comparable a la de vilanterol y salmeterol, y mayor que la del formoterol e indacaterol.
Se conocen tres tipos de receptores adrenérgicos β: β1 (predominantes en el corazón), β2 (músculo liso) y β3 (relacionados con el metabolismo lipídico intracelular). La activación de todos los subtipos de receptores β desencadena un mecanismo de acción similar, mediante el cual la adenilciclasa ligada al receptor se activa y cataliza la conversión del trifosfato de adenosina (ATP) en adenosín monofosfato cíclico (AMPc), provocando, en el caso de los receptores β2 de las células musculares bronquiales, la relajación de éstas y, en consecuencia, una broncodilatación. Estudios de autorradiografía en pulmón humano han demostrado la presencia exclusiva de receptores β2 en el músculo liso de las vías aéreas, sobre todo en las vías periféricas, aunque existen también adrenoceptores β2 en el epitelio, la pared alveolar, las glándulas submucosas, el músculo liso vascular pulmonar, células con capacidad de liberar mediadores (mastocitos, basófilos, eosinófilos), y en los ganglios y las terminaciones nerviosas posganglionares colinérgicas.
Al margen del efecto broncodilatador ligado a la relajación del músculo liso bronquial, los fármacos agonistas β2 adrenérgicos son capaces de desarrollar otras acciones eventualmente útiles para el tratamiento de las patologías respiratorias: aumento del aclaramiento mucociliar, inhibición de la transmisión colinérgica, potenciación de la integridad vascular e inhibición de la liberación de mediadores bioquímicos (leucotrienos, prostaglandinas, histamina) por los mastocitos pulmonares.
ASPECTOS MOLECULARES
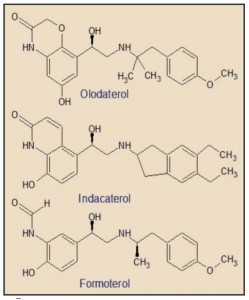
El olodaterol presenta una estructura que recuerda abiertamente a las del indacaterol y del formoterol. Todos los fármacos agonistas β2 adrenérgicos derivan de una estructura similar a la de la adrenalina, y por tanto se basan en el esqueleto de la feniloxietilamina. Por consiguiente, resulta indispensable la presencia de un grupo hidroxilo (-OH) en posición α con respecto al anillo aromático y que el grupo amino de la cadena lateral sea de tipo secundario (-NHR1) y no terciario (NR1R2), ya que precisa del átomo de H para estabilizar la estructura molecular formando un enlace por puente de hidrógeno con el grupo hidroxilo.
La potencia estimulante y la selectividad hacia los receptores β2 viene determinada básicamente por dos aspectos estructurales.
- Presencia de grupos hidroxilo (-OH) en meta (3 o 5) o para (4) del anillo aromático. Estos hidroxilos catecólicos forman enlaces por puente de hidrógeno con sendos restos serina de la cadena peptídica del receptor, estabilizando el complejo. En algunos derivados, uno de los grupos hidroxilo (-OH) es sustituido por su isóstero natural, el grupo amino (-NH2).
- Sustitución voluminosa del grupo amino secundario de la cadena lateral. Cuanto más voluminosa sea esta sustitución, tanto más selectivo será el fármaco hacia los diferentes receptores β. Si el resto es poco voluminoso, como el grupo isopropilo [-CH(CH3)2], los fármacos no muestran, en general, selectividad relativa hacia ninguno de los subtipos de receptor β (isoprenalina, clorprenalina, isoetarina, orciprenalina). Con restos más ramificados, como el terbutilo [-C(CH3)3], el grado de selectividad β2 comienza a ser significativo (terbutalina, salbutamol, etc). En mayor medida sucede cuando los restos contienen anillos aromáticos, tanto sin cadenas largas (formoterol, indacaterol, etc.), como con ellas (salmeterol, vilanterol). Estos restos voluminosos suelen aportar una mayor lipofilia a la molécula y facilita el acceso de ésta al receptor β2 adrenérgico.
EFICACIA Y SEGURIDAD CLÍNICAS
La eficacia y la seguridad del olodaterol en el tratamiento de mantenimiento de la EPOC han sido contrastadas en cinco parejas de ensayos clínicos replicados de fase III, de 6 a 52 semanas de duración, aleatorizados, de grupos paralelos, doblemente ciegos y controlados con placebo y/o comparadores activos (formoterol, tiotropio). Se utilizaron dosis de 5 o 10 µg/24 h administrados mediante inhalación utilizando para ello un dispositivo Respinat® (5 µg equivalen a dos pulsaciones).
Los pacientes incluidos en todos estos ensayos clínicos tenían una edad mínima de 40 años y habían sido diagnosticado de EPOC, con un historial de tabaquismo de al menos 10 años y una insuficiencia pulmonar de moderada a muy grave (estadios II a IV de la guía GOLD). En todos o en la mayoría de los estudios se permitió el uso concomitante de medicamentos pulmonares, a excepción de agonistas β2 adrenérgicos de acción prolongada. Las variables primarias de eficacia utilizadas consistieron en la variación sobre los valores basales del VEF1, los valores máximos ("pico"; área bajo la curva de 0 a 3 horas: AUC0-3) y estables ("valle") de las respuestas de la función pulmonar, y la variación sobre el valor basal predeterminado del VEF1 valle (pre-dosis). En los estudios más largos (48-52 semanas) se midieron también la disnea mediante el ITD (Índice de Transición de la Disnea) y la calidad de vida relacionada con la percepción de la salud (Cuestionario Respiratorio Saint Georges, SGRQ)
Olodaterol vs. placebo
Dos estudios replicados (Ferguson, 2014) de 48 semanas de duración, en el que los pacientes (624 y 642) recibieron 5 o 10 µg/24 h de olodaterol o placebo en inhalación. Los resultados mostraron un aumento medio en los primeros cinco minutos tras la administración de la dosis diaria de 130 ml en el VEF1 y la mejora de la función pulmonar se mantuvo durante 24 h (aumento medio del 162 ml en VEF1 AUC0-3 y de 71 ml en la VEF1 valle durante 24 horas, en comparación con placebo; p< 0,0001).
Olodaterol vs. formoterol
Dos estudios replicados (Feldman, 2014) de 6 semanas de duración, en el que los pacientes recibieron 5 o 10 µg/24 h de olodaterol, 12 µg/12 h de formoterol o placebo en inhalación. Los resultados mostraron un aumento medio tras la administración de 5 o 10 µg/24 h de olodaterol de 175 ml (205 con formoterol) en VEF1 AUC0-3 y de 137 ml (108 con formoterol) en VEF1 AUC0-24, y de 102 ml en el VEF1 valle, todos ellos en comparación con placebo.
Otro dos estudios replicados (Koch, 2014), en este caso de 48 semanas de duración, en el que los pacientes (904 y 934) recibieron 5 o 10 µg/24 h de olodaterol, 12 µg/12 h de formoterol o placebo en inhalación. Los resultados mostraron un aumento medio en los primeros cinco minutos tras la administración de 5 o 10 µg/24 h de olodaterol de 151 y165 ml en el VEF1 y la mejora de la función pulmonar se mantuvo durante 24 h (aumento medio del 129 y 154 ml en VEF1 AUC0-3 y de 53 y 85 ml en la VEF1 valle durante 24 horas, en comparación con placebo; p< 0,0001). Unos resultados similares se obtuvieron con formoterol. El análisis primario de los resultados no mostró la existencia de diferencias significativas en el índice de transición de la disnea (ITD) en relación al placebo, aunque al realizar un análisis post hoc de los resultados (tomando en cuenta las suspensiones del tratamiento) sí pudo apreciarse una diferencia estadísticamente significativa con el placebo. También se apreciaron variaciones significativas favorables en la calidad de vida (SGRQ) con olodaterol vs. placebo (+0,5 puntos), pero no se apreciaron con formoterol vs. placebo (+0,4).
Tiotropio±olodaterol
Dos estudios replicados (ZuWallack, 2014) de 12 semanas de duración, en el que los pacientes (1.132 y 1.135) recibieron 18 µg/24 h de tiotropio con 5 µg/24 h de olodaterol o placebo en inhalación. Los resultados mostraron una variación media de VEF1 AUC0-3 de 191-196 ml con tiotropio+placebo vs. 297-313 con tiotropio-olodaterol (diferencias de 106-117 ml; p>0,0001) y de VEF1 valle de 133-135 ml con tiotropio+placebo vs. 175-195 con tiotropio-olodaterol (diferencias de 40-62 ml; p>0,03). Asimismo, se observó una variación media de VEF1 pico de 270-271 ml con tiotropio+placebo vs. 371-389 con tiotropio-olodaterol (diferencias de 100-119 ml; p>0,0001). Por su parte, la diferencia en la puntuación SGRQ al final fue de -1,9 (43,1 vs- 41,2) favorable a la combinación.
Tiotropio vs. olodaterol vs. tiotropio+olodaterol
Finalmente, en otros dos estudios replicados (Buhl, 2015) de 52 semanas de duración, en el que los pacientes (2.624 y 2.538) recibieron combinaciones fijas de tiotropio y oldaterol (2,5/5 o 5/5 µg/24 h) o los componentes por separado (tiotropio 2,5 o 5 µg/24 h o olodarerol o 5 µg/24 h). Los resultados mostraron una mayor mejoría estadísticamente significativa de VEF1 AUC0-3 y de VEF1 valle de las combinaciones sobre los monocomponentes. Igualmente, se apreció una mayor mejoría significativa en la puntuación SGRQ.
Seguridad
El perfil de seguridad del medicamento es benigno, en línea con lo observado en otros agentes β2 adrenérgicos; de hecho, en muchos de los ensayos clínicos controlados con placebo, la incidencia de eventos adversos fue muy parecida para el olodaterol y el placebo. Los descritos, con poca frecuencia, son nasofaringitis, mareos, erupciones exantemáticas y, raramente, dolores articulares e hipertensión.
ASPECTOS INNOVADORES
El olodaterol es un agonista de acción prolongada de los receptores β2 adrenérgicos que ha sido autorizado para el tratamiento broncodilatador de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
Ha sido objeto de varios ensayos clínicos controlados con placebo y con comparadores activos (formoterol y tiotropio), mostrando una respuesta sobre los FEV1 pico y valle sustancial, mejorando en más de 100 ml, valor considerado como el umbral de la significación clínica (Jones, 2014). En este sentido, los efectos son equiparables a los de otros broncodilatadores de larga duración, tanto adrenérgicos (formoterol, indacaterol) como anticolinérgicos (tiotropio).
El perfil de seguridad de la combinación está en línea con el de otros fármacos de esta familia y no se han observado eventos adversos específicos; en cualquier caso, la incidencia no es elevada y raramente es motivo de suspensión del tratamiento.
El olodaterol requiere una única administración diaria, como el vilanterol, y como éste también ha demostrado producir efectos conjuntos con los anticolinérgicos broncodilatadores (tiotropio, glicopirronio, aclidinio) superiores a los producidos por cada agente por separado. Este tipo de combinaciones en un único dispositivo inhalador y con administración única diaria está convirtiéndose poco a poco en un estándar terapéutico en EPOC (Montuschi, 2015), junto con las combinaciones con corticosteroides. Aunque es evidente que el olodaterol es eficaz en la indicación autorizada y previsiblemente acabará formando parte de alguna de estas combinaciones, no parece aportar nada innovador.
|
VALORACIÓN |
|
|---|---|
|
Olodaterol ► STRIVERDI RESPIMAT® (Boehringer Ingelheim) |
|
|
Grupo Terapéutico (ATC): R03AC. APARATO RESPIRATORIO. Medicamentos contra alteraciones obstructivas pulmonares: agonistas beta-2 selectivos en inhalación. |
|
|
Indicaciones autorizadas: Tratamiento broncodilatador de mantenimiento en pacientes con enfermedad pulmonar obstructiva crónica (EPOC). |
|
|
VALORACIÓN GLOBAL: SIN INNOVACIÓN. No implica aparentemente ninguna mejora farmacológica ni clínica en el tratamiento de las indicaciones autorizadas. |
♣ |
|
FÁRMACOS RELACIONADOS REGISTRADOS ANTERIORMENTE EN ESPAÑA |
|||
|---|---|---|---|
|
Fármaco |
Medicamento® |
Laboratorio |
Año |
|
Terbutalina |
Tedipulmo |
Estedi |
1960 |
|
Salbutamol |
Ventolin |
GlaxoSmithKline |
1975 |
|
Salmeterol |
Serevent |
GlaxoSmithKline |
1992 |
|
Bambuterol |
Bambec |
AstraZaneca |
1993 |
|
Formoterol |
Foradil |
Novartis |
1998 |
|
Indacaterol |
Onbrez |
Novartis |
2010 |
|
Vilanterol* |
Relvar Ellipta |
GlaxoSmithKline |
2014 |
|
Olodaterol |
Striverdi Respimat |
Boehringer Ingelheim |
2015 |
* Solo está disponible en España en combinación con fluticasona.
BIBLIOGRAFÍA
Bibliografía
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Striverdi Respimat®. Sumario de características. http://www.aemps.gob.es/cima/pdfs/es/ft/78253/FT_78253.pdf
- Buhl R, Maltais F, Abrahams R, Bjermer L, Derom E, Ferguson G, et al. Tiotropium and olodaterol fixed-dose combination versus mono-components in COPD (GOLD 2-4). Eur Respir J. 2015 Jan 8. pii: ERJ-01360-2014.
- Consejo General de Colegios Oficiales de Farmacéuticos. Bot PLUS WEB. https://botplusweb.portalfarma.com/
- Cortijo Gimeno J, Milara Paya J, Morcillo Sánchez E. Terapéutica del asma, EPOC e insuficiencia respiratoria. En: Terapéutica farmacológica de los trastornos de los aparatos respiratorio, osteomuscular y genitourinario. Madrid: Consejo General de Colegios Oficiales de Farmacéuticos; 2014. pp. 21-44.
- Cuéllar S. Vilanterol/Fluticasona (Relvar Ellipta®) en asma y EPOC. Panorama Actual Med 2014; 38(377): 867-74.
- Feldman GJ, Bernstein JA, Hamilton A, Nivens MC, Korducki L, LaForce C. The 24-h FEV1 time profile of olodaterol once daily via Respimat® and formoterol twice daily via Aerolizer® in patients with GOLD 2-4 COPD: results from two 6-week crossover studies. Springerplus. 2014; 3: 419. doi: 10.1186/2193-1801-3-419.
- Ferguson GT, Feldman GJ, Hofbauer P, Hamilton A, Allen L, Korducki L, Sachs P. Efficacy and safety of olodaterol once daily delivered via Respimat® in patients with GOLD 2-4 COPD: results from two replicate 48-week studies. Int J Chron Obstruct Pulmon Dis. 2014; 9: 629-45. doi: 10.2147/COPD. S61717.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Guía para el diagnóstico, tratamiento y prevención de la EPOC. Una guía para profesionales sanitarios (revisada en 2011).http://www.goldcopd.org/uploads/users/files/GOLD_Pocket11_Spanish_Jun7.pdf
- Jones PW, Beech KM, Chapman KR, Decramer M, Mahler DA, Wedzicha JA. Minimal clinically important differences in pharmacological trial. Am J Respir Crit Care Med. 2014; 189(3): 250-5.
- Koch A, Pizzichini E, Hamilton A, Hart L, Korducki L, De Salvo MC, Paggiaro P. Lung function efficacy and symptomatic benefit of olodaterol once daily delivered via Respimat® versus placebo and formoterol twice daily in patients with GOLD 2-4 COPD: results from two replicate 48-week studies. Int J Chron Obstruct Pulmon Dis. 2014; 9: 697-714. doi: 10.2147/COPD. S62502.
- Montuschi P, Ciabattoni G. Bronchodilating Drugs for Chronic Obstructive Pulmonary Disease: Current Status and Future Trends. J Med Chem. 2015 Jan 14. [Epub ahead of print]
- ZuWallack R, Allen L, Hernandez G, Ting N, Abrahams R. Efficacy and safety of combining olodaterol Respimat(®) and tiotropium HandiHaler(®) in patients with COPD: results of two randomized, double-blind, active-controlled studies. Int J Chron Obstruct Pulmon Dis. 2014; 9: 1133-44. doi: 10.2147/COPD. S72482.
1 El enfisema es un concepto anatomopatológico indicativo de destrucción de pared alveolar y agrandamiento anormal de los espacios aéreos distales a los bronquiolos terminales, sin fibrosis pulmonar evidente.
2 La definición de bronquitis crónica es puramente clínica: presencia de tos y expectoración durante más de 3 meses al año, al menos 2 años consecutivos, en pacientes en los que se han excluido otras causas de tos productiva. Sin embargo, para incluirse dentro del marco de la EPOC, la bronquitis crónica debe cursar con obstrucción crónica al flujo aéreo.
3 Presión de oxígeno en sangre arterial, PaO2 ≤7,3 kPa (55 mmHg) o tasa de saturación de oxígeno, SaO2 =88%, con o sin hipercapnia, en dos ocasiones al menos en un periodo de tres semanas; o bien PaO2 =7,3-8,0 kPa (55-60 mmHg) o SaO2 ≤88%, si hay evidencia de hipertensión pulmonar, edemas periféricos que sugieran una insuficiencia cardiaca, o policitemia (hematocrito >55%).
Artículos relacionados
-
5 Dic 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
29 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares
-
6 Oct 2025Medicamentos con nuevos principios activos o biosimilares Medicamentos con nuevos principios activos o biosimilares




